两种化学发光免疫检测系统检测血清CA153的结果一致性研究*
刘纲毅,陈 葭,谢妹珍
1.柳州市人民医院 检验科(柳州 545006);2.柳州市病毒性疾病精准医学重点实验室(柳州 545006);3.广西临床疾病生物技术研究重点实验室(柳州 545006);4.柳州市人民医院 放射科(柳州 545006)
肿瘤标志物是一类既能反映肿瘤发生、发展,也能监测肿瘤疗效的物质总称,广泛用于良恶性肿瘤的鉴别、早期诊断和疗效观察,是临床不可或缺的检测项目,在国内各级医院广泛开展,其中CA153 是常规检测项目之一[1]。CA153 是从乳腺癌患者的组织碎片及细胞质中提取的糖类抗原物质,是乳腺相关抗原,存在于多种腺癌细胞内,在乳腺癌患者体内显著升高[2]。大量临床研究[3]证实,CA153 是监测乳腺癌和肺腺癌复发和转移的指标。目前常用于CA153 检测的方法有酶标记法、放射物标记法以及化学发光标记法,因化学发光标记法检测具有高度敏感性和稳定性,在临床上应用最广泛[4]。迄今为止,国际标准化组织(international organization for standardization,ISO)还未能制定出CA153 的一级参考品或参考方法,各检测系统无法实现标准化溯源至同一结果,这也限制了各实验系统检测结果的统一。由于受诸多因素的影响,不同检测系统检测结果存在差异,如何实现不同免疫检测系统结果的一致性已成为迫切需要解决的问题。因此,本研究旨在探讨罗氏cobas E602型全自动电化学发光免疫分析仪和深圳新产业Biolumi 8000型模块化化学发光免疫分析仪检测CA153结果的一致性。
1 材料与方法
1.1 仪器与试剂
罗氏cobas E602 型全自动电化学发光免疫分析仪和深圳新产业Biolumi 8000 型模块化化学发光免疫分析仪,以及其配套的校准品、试剂和质控物均为朗道免疫质控品。
1.2 临床样本选择
纳入2020 年1 月至2022 年1 月柳州市人民医院收治的恶性肿瘤患者89 例,其中乳腺癌患者49 例,年龄(52.9±11.3)岁;肝癌患者40 例,年龄(54.1±12.6)岁。同时,选择同期来我院健康体检的健康志愿者46 例作为研究对象。所有受试者在清晨空腹抽取静脉血6 mL,分离血清后分割2 份样本置于-20 ℃冰箱保存,统一收集135 份样本后,同时解冻2 份血清,分别用罗氏Cobas E602 型全自动电化学发光免疫分析仪和深圳新产业Biolumi 8000 型模块化化学发光免疫分仪检测CA153 水平。所有受试者使用罗氏Cobas E602 型全自动电化学发光免疫分析仪检测CA153 的浓度范围为0~500 U/mL,其中低浓度(<30 U/mL)47 例,中浓度(30~300 U/mL)75 例,高浓度(300~500 U/mL)13 例。所有受试者的CA153 浓度经Kolmogorov-Smirnov检验满足正态分布。排除标准:1)患有精神疾病者;2)严重心、肝、肾功能损害者;3)严重溶血、黄疸、高脂血症者。所有比对样本均为剩余血清,本研究获柳州市人民医院伦理委员会批准(批准号:20200112)。
1.3 评价方法和标准
1.3.1 绝对偏倚分析和相对偏倚分析 计算两种检测系统对同一样本的测定值之差(绝对偏倚分析)或比值(相对偏倚分析)的平均数()和标准差(s),分别以(±1.96s)为上下限,统计绝对差值(绝对偏倚分析)或比值(相对偏倚分析)超出上下限的个数,计算个数占总数的百分比,百分比<5%为满足评价标准要求。
1.3.2 临床可接受性评价 根据回归方程,将CA153的参考值上限(X1)、目标检测系统的本次不同浓度标本检测均值(X2)和医学决定水平(X3)代入,计算检测系统的预测值(Y) 和相对偏倚SE%,公式如下:
临床可接受性判定:根据卫生部临床检验中心判断标准,检测系统在不同CA153 水平的相对偏倚,在SE%<12.5%时结果为临床可接受。
1.4 统计学方法
使用PRISM 7.0软件对数据进行统计分析。双尾t检验分析低浓度(<30 U/mL)、中浓度(30~300 U/mL)和高浓度(300~500 U/mL)CA153在两种检测系统中的差异。两组CA153 检测结果的相关性采用Pearson相关性分析。使用Medcal 20 进行Bland-Altman分析。检验水准α除特别说明外均设定为0.05。
2 结果
2.1 两种检测系统检测结果比较
两种检测系统对CA153 的检测结果差异均无统计学意义(P>0.05)(表1)。
表1 两种检测系统检测结果比较(U/mL,)
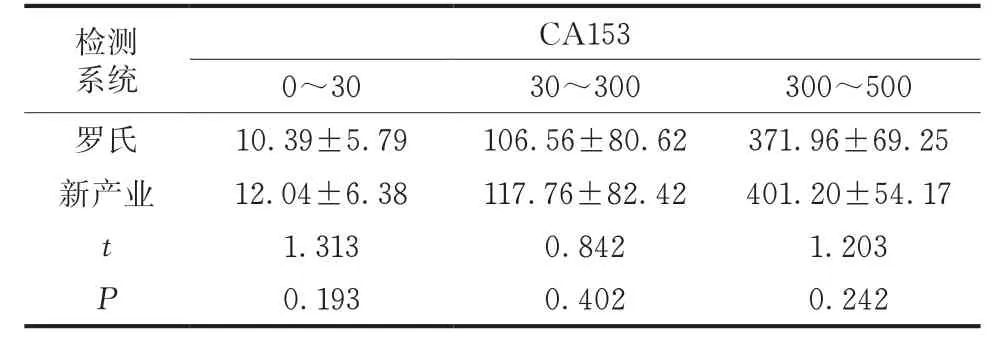
表1 两种检测系统检测结果比较(U/mL,)
?
2.2 两种检测系统检测结果的绝对偏倚和相对偏倚
低浓度和高浓度CA153 在95%一致性界限内的值占100.00%,绝对偏倚和相对偏倚均符合评价要求。中浓度CA153在95%一致性界限内的值有72个,占96.00%,相对偏倚和绝对偏倚均符合评价要求(表2)。
表2 两种检测系统的绝对偏倚和相对偏倚分析()
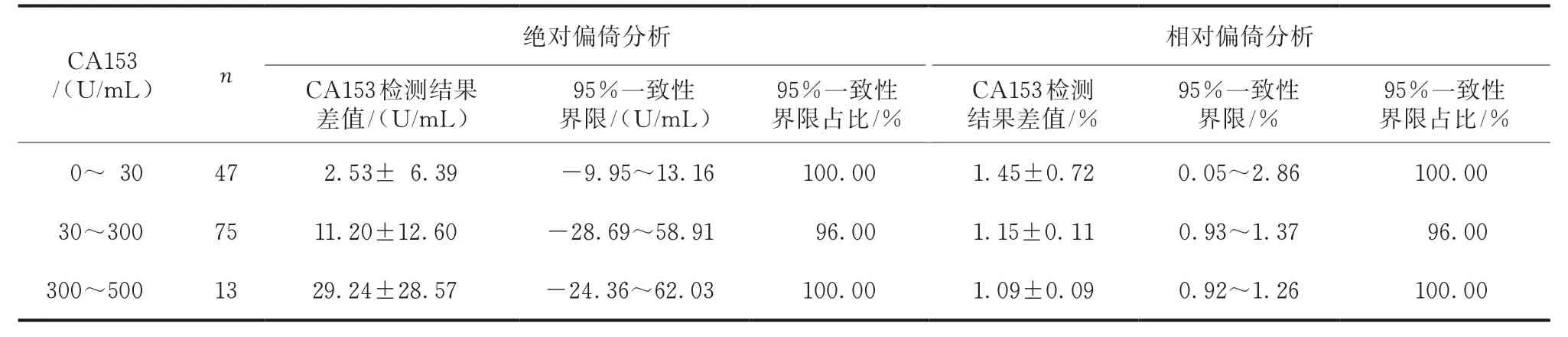
表2 两种检测系统的绝对偏倚和相对偏倚分析()
?
2.3 两种检测系统检测结果的相关性分析
对两种检测系统的CA153 检测结果进行Pearson相关性分析,发现两组在低、中、高浓度结果的相关系数分别为0.947、0.913、0.984,均呈高度正相关(P<0.001)。
2.4 临床可接受性评价
低、中、高浓度CA153 的相对偏倚SE%分别为58.31%、12.53%、10.76%。低、中浓度CA153 相对偏倚SE%均高于12.5%,评价结果为临床不接受,即两种检测系统低、中浓度具体数值不具有可比性。
2.5 两种检测系统检测结果的Bland-Altman 分析
Bland-Altman分析显示,在低浓度范围内,两种检测系统对CA153的检测差值均在1.96个标准差内(1.96个标准差用虚线标出),但随着检测浓度增高,两种检测系统偏差增大,中、高浓度范围均有点落在1.96个标准差外,说明中、高浓度检测数值不具有一致性(图1)。

图1 两种检测系统检测结果的Bland-Altman图
3 讨论
肿瘤标志物通常被用来检测肿瘤患者在随访期间的疾病复发情况[5-7]。近年来,新的检测分析系统不断出现,对其进行更好、更精确的评估至关重要。根据人类蛋白图谱数据库提供的信息,黏蛋白1(mucin1,MUC1)是由MUC1基因编码的高度糖基化跨膜糖蛋白,在几乎所有上皮细胞中都有表达,而CA153是MUC1的可溶性形式[8-10]。MUC1相对分子质量为400~450 kD,是异二聚体I型跨膜蛋白,具有200~500 nm的糖基化胞外结构域,由20 个氨基酸的重复单元组成。除了组成型表达于食道、胃、十二指肠、胰腺、子宫、前列腺、淋巴结、肺以及一些造血细胞外,MUC1 还在呼吸道、生殖道和胃肠道上皮细胞的一系列顶端边缘高度表达[11]。区分健康上皮细胞和癌细胞产生的MUC1 最重要的特征是O-链聚糖,不同来源的MUC1 O-链聚糖具有不同的链长和结构。在健康受试者中,MUC1 上的O-链聚糖具有线性聚乳胺链[12]。然而,较短的O-链聚糖在恶性肿瘤细胞中表达,被称为密集的Thomsen-Friedenreich (TF)抗原或唾液化的TF抗原[13-14]。血液检测由于具有无创、测量简单、可重复性等特点,是早期癌症诊断最理想的方法,阳性结果也可作为评价疾病进展和治疗效果的指标,因此,自20世纪80 年代以来,血清CA153 水平已被用作多种恶性肿瘤的诊断和疾病预后的生物标志物[15-18]。
本研究依据CA153 浓度范围,使用罗氏cobas E602 型全自动电化学发光免疫分析仪和深圳新产业Biolumi 8000 型模块化化学发光免疫分析仪检测血清CA153 水平,发现两种检测方法的CA153 检测结果差异均无统计学意义(P>0.05)。因此两种检测系统评估CA153 结果的一致性较好,临床结果具有可比性,即检验效能一致。
罗氏cobas E602 型全自动电化学发光免疫分析仪和深圳新产业Biolumi 8000 型模块化化学发光免疫分析仪的低、中浓度CA153 的相对偏倚SE%均高于12.5%,评价结果为临床不接受。评估两种定量测量方法的一致性常采用相关性研究和回归性研究[19],但相关性研究是分析一个变量与另一个变量之间的关系,而不是差异,因此,不宜用于评估两种测量方法的一致性[20]。1983 年,Bland和Altman提出了另一种分析方法,即Bland-Altman分析,通过研究均值差和构建一致性的极限来量化两种定量测量之间的一致性[21]。Bland-Altman分析是一种简单的评估平均差异之间的偏差,并估计一致区间的方法[22-25]。本研究中,Bland-Altman分析显示,两种检测系统检测结果的差值随着CA153浓度增高而增大,中、高浓度检测数值不具有一致性,即两种检测系统检测的具体数值不具有可比性。
目前常用于CA153 检测的方法均基于抗原抗体反应原理,虽然抗原抗体可像酶和底物一样产生特异性反应,但抗原抗体的反应与酶促反应有很大不同[26-28]。抗原抗体的特异性反应为可逆反应,会受到抗原抗体亲和力、反应温度、酸碱度和离子浓度的影响。罗氏cobas E602 型全自动电化学发光免疫分析仪是基于电化学发光免疫检测法(electrochemiluminescence immunoassay,ECLIA),而深圳新产业Biolumi 8000型模块化化学发光免疫分析仪是基于鲁米诺直接化学发光法(chemiluminescent enzyme immunoassay,ECLA),这两种方法都是化学发光标记法中的一种,均是基于抗原抗体反应原理,与临床生化检测方法有相通性,但抗原抗体反应的效率有差异,因此,不同化学发光标记法的具体数值不具有可比性。
综上所述,罗氏cobas E602型全自动电化学发光免疫分析仪和深圳新产业Biolumi 8000型模块化化学发光免疫分析仪检测CA153的相关性良好,两者的检验效能一致,均能满足临床检测需求。当CA153在30~300 U/mL浓度范围内时,两种检测系统的具体数值不具有可比性。本研究不足之处在于,纳入的样本量较少,今后需开展更大样本的研究,以对结果进行验证。

