利用人工智能预测肺部磨玻璃密度结节侵袭性的相关研究
刘 丹,熊 浩(通信作者)
(长江大学附属第一医院放射科 湖北 荆州 434000)
肺癌的发病率、病死率目前仍居于全球恶性肿瘤的首位;肺癌中约65%以上为肺腺癌[1]。随着胸部CT检查的普及,越来越多磨玻璃密度结节(ground glass nodule,GGN)被发现。临床应用CT 对肺腺癌患者进行检查时,可将边界清楚或不清楚的肺内磨玻璃样密度增高影定义为GGN[2]。影像学表现为GGN 除肺腺癌之外还可见于炎症、肺泡出血、局灶性纤维化等良性病变,传统阅片可能难以清晰界定影像学特征,传统手动量化参数所需时间较长,且一般不具有重复性,最终评估结果可能受医师主观因素影响,最终导致检测结果的准确性降低[3],故传统的胸部CT 评估GGN 浸润性的综合价值有所欠缺。随着计算机辅助系统的开发和改进,基于深度学习的人工智能(AI)辅助诊断系统对GGN 的大小、密度等定量指标更为客观,不仅可以快速对肺内GGN 进行自动识别和标记并提示危险程度,还能对GGN 特征进行定量参数分析[4]。既往相关研究表明,人工智能对GGN 的特征定量分析对其良恶性鉴别以及侵袭程度的预判具有重要的临床意义,可帮助临床及早制定治疗方案,最终改善患者预后结局[5]。基于此,本研究主要分析了人工智能在肺腺癌患者GGN 侵袭性预测中的效用,报道如下。
1 资料与方法
1.1 一般资料
选取2021 年6 月—2022 年12 月在长江大学附属第一医院放射科行胸部CT 检查,并且最终经手术和病理证实为肺腺癌的55 例患者,GGN 共60 枚。55 例患者中男性31 例,女性24 例;年龄52 ~78 岁,平均(63.15±3.73) 岁。患者均签署知情同意书。纳入标准:①至少包含1 枚磨玻璃结节并≤3 cm 的结节;②有薄层胸部CT 图像原始数据,即层厚≤1.5 mm。排除标准:①病灶直径>3 厘米;②图像质量偏低,未满足AI 诊断要求。
1.2 方法
采用GE Optima CT520 螺旋CT 扫描,管电压120 k V p,管电流70 ~150m A,螺距1.0,扫描厚度5.0 m m,图像矩阵512×512,视野360 m m。标准算法和肺算法重建图像,重建层厚为1.5 mm,层间距1.5 mm。图像分析采用肺窗(窗宽1 200 HU,窗位-600 HU)。扫描范围从胸廓入口至肺底,患者一次深吸气屏气后完成肺扫描。
1.3 肺结节图像分析
①导入数据:将所选55 个病例肺部原始DICOM 格式数据导入数坤公司提供的基于深度学习模型的人工智能软件工作站中。②研究观察每个GGN 的定量及定性相关指标:定量指标包括最大面积、3D 长径、平均CT 值、最小CT 值、最大CT 值等,定性相关指标包括边缘、分叶、空泡征;血管穿行、血管聚集;病变内部征象:空泡、支气管穿行征;形态:类圆形、集中、分散。③按病理结果浸润前及侵袭组分组,分别进行数据运算处理:经横断面、矢状面、冠状面中对不同侵袭性GGN 体积进行测量,并经横断面、矢状面、冠状面对GGN 实性成分占比分析。
1.4 观察指标
①统计并比较浸润前组与侵袭组一般临床资料(年龄、性别)与AI 量化参数(长径、短径、实性成分占比、平均CT 值、最大CT 值、最小CT 值、最大面积、体积)。②参考两组AI 量化参数检测结果为准,绘制受试者工作特征(receiver operating characteristic,ROC)曲线,并统计比较几种不同参数的曲线下面积(AUC)与诊断效能。③使用二元Logistics 回归综合分析各项AI 量化参数对GGN 侵袭性的独立预测价值。
1.5 统计学方法
采用SPSS 21.0 统计软件分析数据,符合正态分布的计量资料以均数±标准差(± s)表示,采用t检验;计数资料以频数(n)、百分率(%)表示,采用χ2检验;多因素分析采用二元Logistic 回归分析;以P<0.05 为差异具有统计学意义。
2 结果
2.1 两组一般资料与AI 量化参数比较
参考病理检查结果,60 枚GGN 被纳入浸润前组(n=34)与侵袭组(n=26);两组性别比例、年龄资料比较无显著差异(P>0.05);侵袭组长径、实性成分占比、平均CT 值、最大CT 值、最大面积与体积均高于浸润前组,最小CT 值低于浸润前组(P<0.05)。见表1。
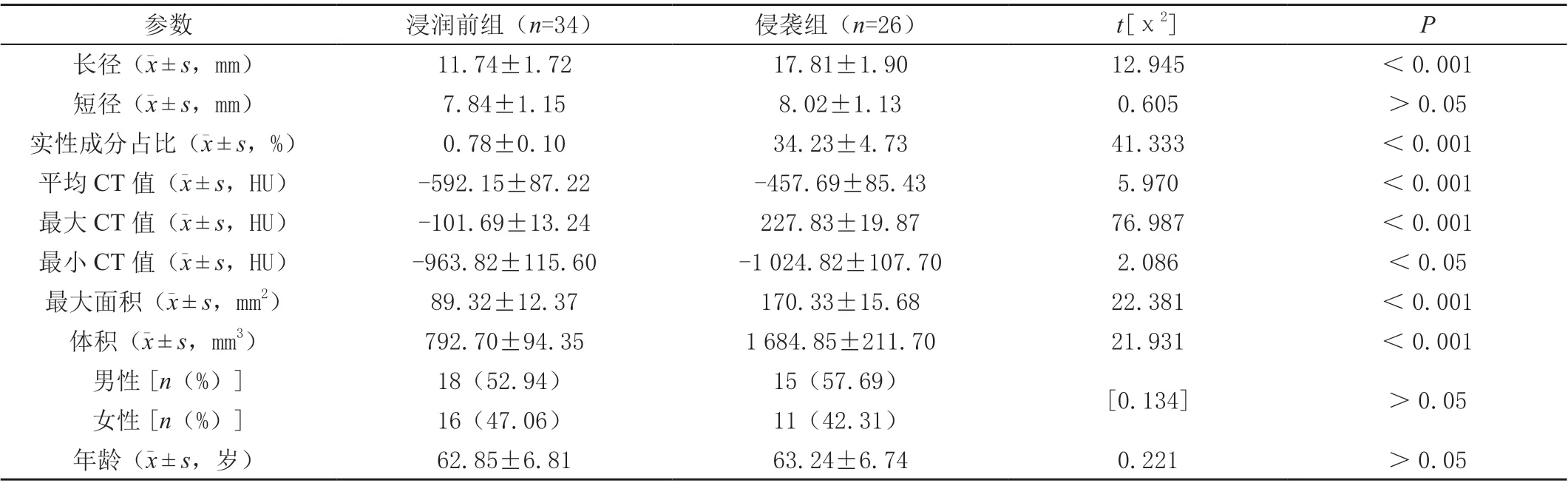
表1 两组一般资料与AI 量化参数比较
2.2 AI 量化参数的AUC 与诊断效能分析
AI 量化参数中的长径、实性成分占比、平均CT 值、最大面积、体积的AUC 分别为0.812、0.807、0.794、0.824、0.817,均对GGN 侵袭性有较好的预测价值(P<0.05)。而最大CT 值AUC 为0.479,最小CT值AUC 为0.463,对GGN 侵袭性的预测价值并不显著。见表2。
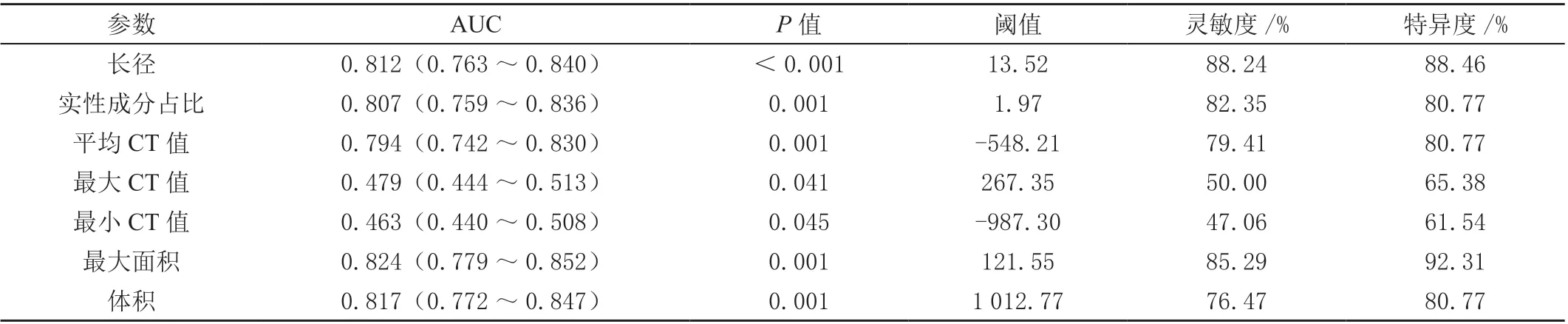
表2 AI 量化参数的AUC 与诊断效能统计
2.3 独立预测因子分析
二元Logistic 回归分析结果显示,长径、平均CT 值均属于预测GGN 侵袭性的独立影响因子(P<0.05)。见表3。

表3 二元Logistic 回归分析结果统计
3 讨论
肺腺癌是严重威胁患者生命质量的恶性肿瘤疾病,该病具有明显进展性,致死率较高,临床对该病患者通常需要根据其肿瘤浸润程度制定对应的治疗方案,进而改善患者预后结局,延长其生存期限。研究表明,临床对肺腺癌患者行肺部GGN 侵袭性评估能够判断其病情严重程度,进而为后续手术治疗方案的制定与改善提供参考[6]。但考虑到GGN 侵袭性并不属于一种特异性表现,肺部炎症状态、病灶纤维化状态均可能导致GGN 发生,此外,临床应用CT 检查后往往需要医师进行阅片操作,传统阅片可能难以清晰界定影像学特征。
近年来随着计算机辅助系统的开发与改进,AI 辅助诊断系统也开始在肺部肿瘤疾病GGN 侵袭性评估中开始应用,AI 在对CT 诊断参数的评估中更加客观,还能对GGN 特征进行定量参数分析,进而为肺腺癌患者疾病状态的诊断提供更加可靠的数据支持[7]。目前AI 对GGN量化参数主要涉及到CT 值、最大面积、实性成分占比、体积等。本研究通过比较浸润前组与侵袭组AI 量化参数发现,侵袭组长径、实性成分占比、平均CT 值、最大CT 值、最大面积与体积均高于浸润前组,最小CT 值低于浸润前组(P<0.05),表明肺腺癌患者GGN 侵袭情况发生后,其病灶长径、实性成分占比、CT 值、最大面积与体积均会发现明显的异常改变,临床通过使用AI对上述参数进行准确检测,可一定程度上预测肺腺癌患者GGN 侵袭风险,帮助早期预防治疗方案的制定。本研究中,AI 量化参数的最大CT 值与最小CT 值对GGN 侵袭性的预测价值偏低,AUC 分别为0.479 与0.463,究其原因在于,肺肿瘤疾病发生后,肿瘤组织主要沿肺泡壁生长,最小CT 值可能受到支气管影与未填充肺泡组织影响,进而导致最终结果的可信度降低;而最大CT 值则容易受到GGN 内出血、纤维化等病变情况综合影响,导致其在预测GGN 侵袭风险上存在一定局限性。
本研究通过对AI 量化参数进行二元Logistic 回归分析发现,长径、平均CT 值均属于预测GGN 侵袭性的独立影响因子(P<0.05),表明长径、平均CT 值在对GGN 侵袭性进行预测评估时,基本不会受到患者自身与外界因素影响,对GGN 侵袭性的评估结果更为准确,临床预测的价值性更高。临床对各类疾病采用CT 仪器进行诊断时组织密度的计量单位被定义为CT 值,通过对CT 值进行分析可明确患者病灶密度变化情况,通常情况下,组织CT 值增加提示患者肿瘤恶变风险越高。磨玻璃结节的直径相对较小,传统人工阅片测量方法所得结果往往不准确,误差情况的发生可能导致诊断准确性降低。而AI 临床应用后可准确测量病灶CT 值,在对肺腺癌患者进行复查时CT 值升高,则提示侵袭性病变的风险明显增大。最大面积是AI 在2D 所测最大长径所在的层面的面积,可帮助GGN 鉴别癌前病变和微浸润病变与浸润性病变[8]。考虑到肺结节本身属于欠规则的图形,单纯依靠医师恐难以获得精准肺结节最大切面。AI 的应用很好地解决了这一问题,使得最终测量结果更为接近实际值。长径是病灶表面网格顶点之间的最大成对欧几里得距离,其一定程度上反映了病变的生物学特点,病灶长径能够直接反映病灶病变程度,为患者病情进展情况的鉴别评估提供数据参考。传统测量方法是选取GGN的最大横截面,测量结果存在片面性;AI 系统的应用可在三维空间中对病灶长径进行多平面测量,其数据更加精确,而且具有很强的重复性及客观性[9]。长径、平均CT 值均能够通过多次测量使数据更加接近实际值,在GGN 侵袭风险预测中的应用有重要意义。
综上所述,AI 量化参数在肺腺癌患者GGN 侵袭性预测中的应用具有显著作用,可明晰患者GGN 浸润程度,评估患者疾病状态;AI 量化参数中的长径与平均CT 值属于独立预测因子,预测价值较高,能为患者病情进展评估提供更加准确的数据支持,帮助后续手术与其他治疗方案的制定。但AI 系统通常无法自主进行判断分析,仅能参考制定的规则与程序完成任务,因此临床实际对肺腺癌患者GGN 侵袭性预测时,需要综合考虑情况,结合医师与AI 技术,进而最大限度提升预测效能。

