子宫肌瘤孕妇无创产前DNA 检测的结果分析
谢平霖 陈培松 余学高 方炳雄 庄蓓丽
随着我国三胎政策的开放,高龄产妇越来越多,而胎儿的染色体非整倍体变异风险随着孕妇的年龄升高而升高[1]。目前侵入性的染色体核型分析是胎儿染色体非整倍体检测的“金标准”,但其存在一定的风险[2]。无创产前DNA 检测(non-invasive prenatal testing,NIPT)是基于孕妇外周血中含有胎儿游离DNA片段而研发的一种胎儿染色体非整倍体检测技术,因其具有很好的检测性能,准确率可达99%以上,且兼具安全性和可靠性[3],更易为大众接受。无创产前DNA 检测主要包括无创产前基因检测技术和扩展性无创产前基因检测技术。目前恶性肿瘤患者因为肿瘤脱落细胞可导致NIPT 检测结果假阳性而被纳为“慎用人群”,但对良性肿瘤患者,例如占孕妇比例为0.1%~3.9%的子宫肌瘤(Uterine myoma,UM)患者,相关指南暂未针对子宫肌瘤在NIPT 检测中的影响做出指导[4-5]。基于上述情况,本研究对2020 年4 月1 日至2021 年12 月31 日于中山大学附属第一医院进行NIPT 检测的3 876 例孕妇的检测结果和产前诊断及妊娠结果进行回顾性分析,探讨子宫肌瘤对孕妇患者NIPT检测的影响。现报道如下。
1 材料和方法
1.1 一般资料
回顾性分析2020 年4 月1 日至2021 年12 月31 日在本院进行NIPT 检测的孕妇,排除患有恶性肿瘤、近期接受过输血、移植手术或细胞治疗等[6]可能影响NIPT 检测结果的患者,共计3 876 例研究对象,年龄17~52 岁间,平均年龄(32.62±4.59)岁。根据孕妇在做NIPT 检测前的超声检查中是否发现有UM 分为361 例子宫肌瘤孕妇组(UM组)及3 515 名健康人群组(对照组),其中UM 组的年龄(35.20±4.16)岁,高于对照组的(32.35±4.55)岁,差异具有统计学意义(P<0.05)。
1.2 仪器与试剂
DNA 提取试剂盒(广州达安基因股份有限公司)、高灵敏荧光染料DNA 检测试剂盒(上海立菲生物技术有限公司)、测序反应通用试剂盒(广州市达瑞生物技术股份有限公司);测序仪器使用DA8600高通量测序仪(广州达安基因股份有限公司)。
1.3 方法
1.3.1 标本的采集及前处理
使用EDTA-K2 抗凝管采取孕妇外周血6 mL,并使用两步离心分离血浆:①先使用低速冷冻离心机,离心半径为17.13 cm,设置温度为4℃,2 890 r/min,离心10 min,吸取上层血浆转移到2.0 mL 的EP 管中。②使用高速冷冻离心机,离心半径为8.46 cm,设置温度为4℃,13 000 r/min,将上述EP 管放入离心10 min 后,再吸取0.7 mL 的上层血浆转移到2.0 mL 的EP 保存管备用。
1.3.2 DNA 提取及文库制备
严格按照DNA 提取试剂盒、测序反应通用试剂盒的说明书进行DNA 的提取和DNA 文库的制备。
1.3.3 高通量测序及结果的判读
使用DA8600 高通量测序仪对制备好的DNA文库进行测序,利用染色体非整倍体检测数据分析系统进行数据分析,运行序列比对软件将测序所得序列与人类基因组参考序列图谱比对,采用生物信息学对数据进行基于二元假设的Z-score 值判断,得到每个测序样本的Z值,并根据试剂盒说明书的参考范围进行结果判断,评估患儿患病风险(cut off:|Z|=3),当Z≥3 时,提示该染色体可能为三倍体,当Z≤-3 时,提示该染色体可能为单倍体。
1.3.4 结果的验证及随访
当NIPT 检测结果提示高风险时,进行介入性产前诊断并随访。对结果提示低风险的患者,进行妊娠随访跟踪。整理归纳实验组和对照组的NIPT 检测结果、产前诊断结果以及随访信息,并进行综合分析。
1.4 统计学处理
采用SPSS 19.0 软件对数据进行统计学处理,计数资料采用描述性分析,用频数和频率表示,组间比较使用卡方检验,当P<0.05时表示差异有统计学意义。
2 结果
2.1 UM 组与对照组的NIPT 检测的结果
UM 组共检测出染色体异常高风险共12 例,阳性率为3.32%(12/361),明显高于对照组的阳性率0.68%(24/3 515),差异具有统计学意义(χ2=24.82,P<0.05),且UM 组的假阳性率2.79%(10/359)也明显高于对照组0.31%(11/3 502),差异具有统计学意义(χ2=36.76,P<0.05),此外所有低风险患者跟踪回访后未出现胎儿染色体异常情况。见表1。
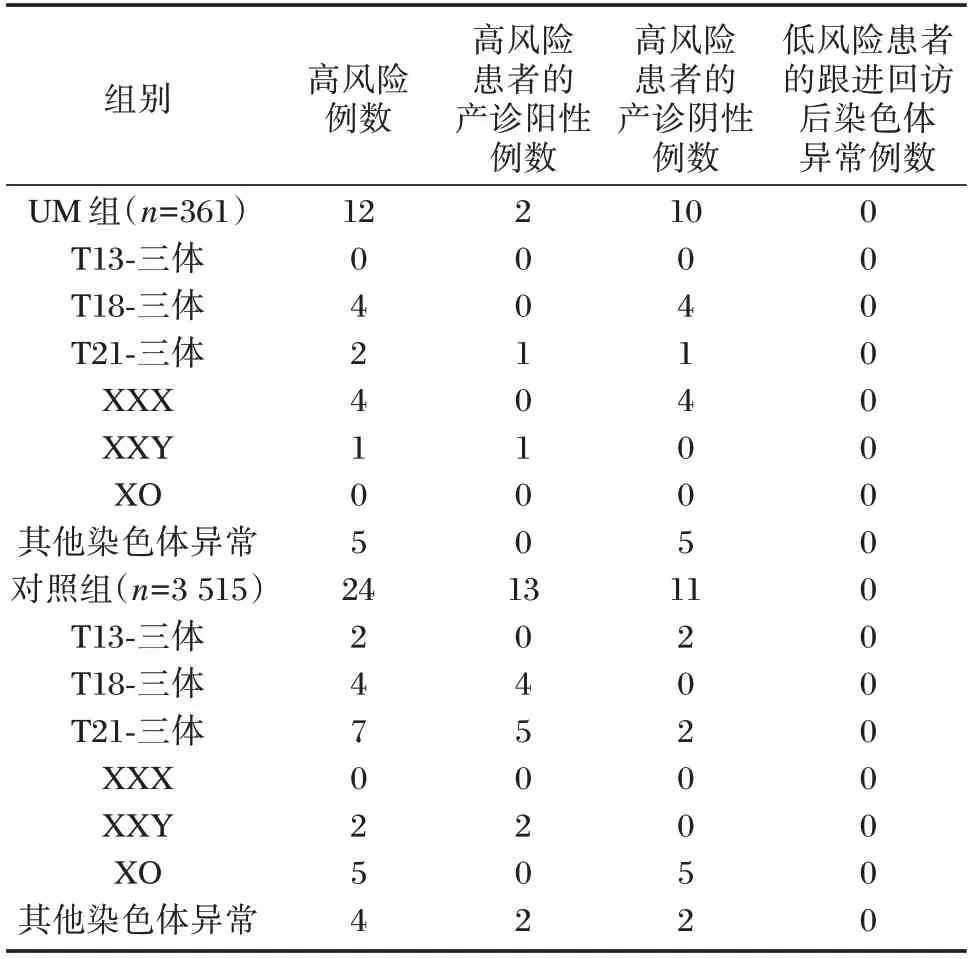
表1 UM 组与对照组的NIPT 检测结果Table 1 NIPT test results of UM group and control group
2.2 NIPT 检测在UM 组与对照组的胎儿染色体非整倍体中的检测效能
NIPT 检测在UM 组与对照组的染色体非整倍体检测的灵敏度、阴性预测值都达到了100%,但UM 组的特异度97.21%(349/359)明显低于对照组99.69%(3491/3502),差异具有统计学意义(χ2=36.76,P<0.05)。而UM 组阳性预测值16.67%(2/12)低于对照组54.17%(13/24),差异无统计学意义(χ2=3.21,P>0.05)。此外,在T18 染色体非整倍体检测中,UM 组的阳性预测值为0(0/4),明显低于对照组的阳性预测值100(4/4),差异具有统计学意义(χ2=4.50,P<0.05)。而在性染色体非整倍体检测中,UM 组检出4 例XXX,均为假阳性,而对照组则无XXX 的异常结果。见表2。
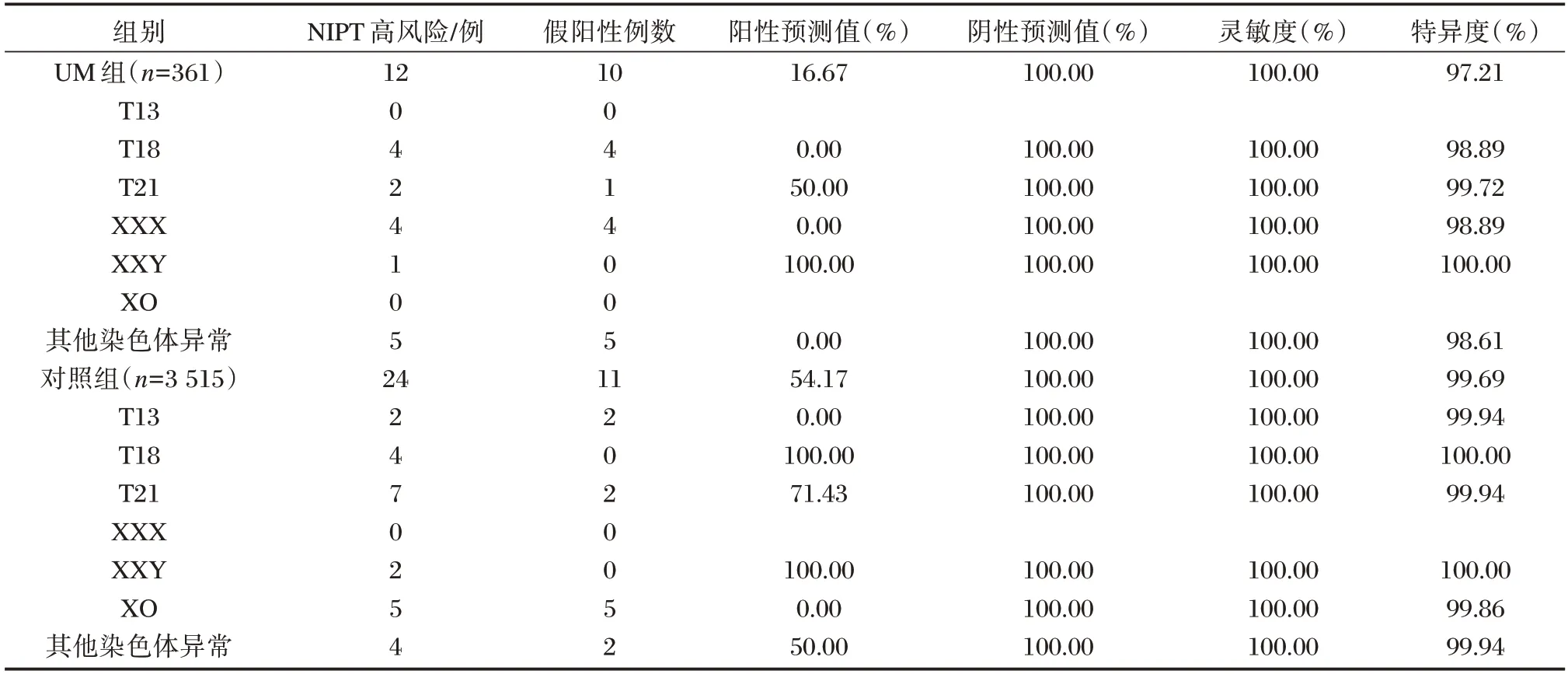
表2 NIPT 检测在UM 组与对照组中的检测效能Table 2 Detection efficiency of NIPT in UM group and control group
2.3 NIPT 检测的假阳性病例汇总分析
对UM 组假阴性结果病例进行汇总,发现UM组假阳性涉及有第1、7、8、15、18、21、22 及X 染色体,且有40%的假阳性都为T18 高风险和XXX,其中有3 例子宫肌瘤的直径都比较大(均≥70 mm)的浆膜下子宫肌瘤的结果同时提示为T18 高风险和XXX。见表3。
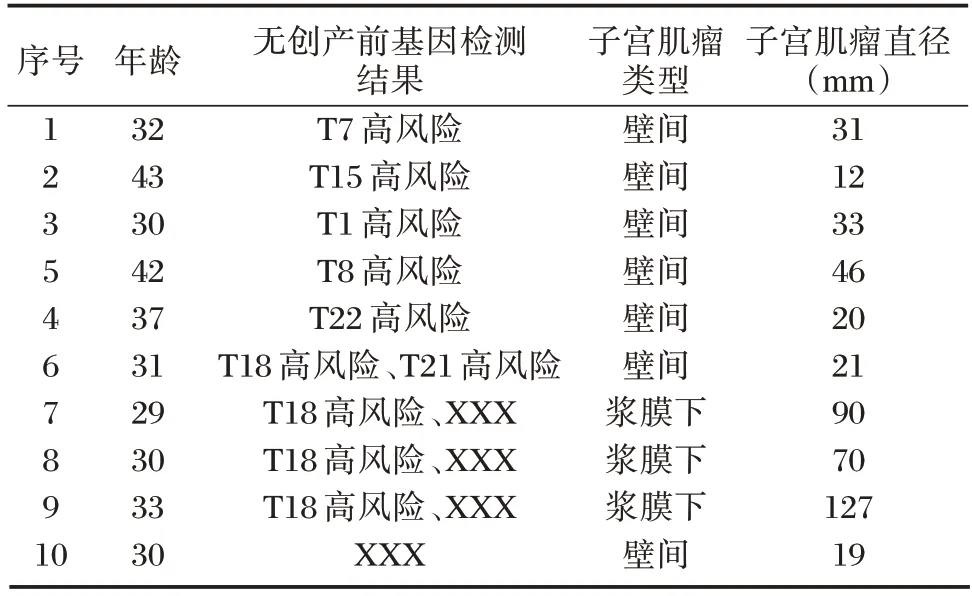
表3 无创产前检测中假阴性结果患者的基本情况Table 3 Basic information of patients with false negative results in noninvasive prenatal testing
3 讨论
我国每年出生人口中有4%~6%为先天性缺陷的儿童,其中70%的出生缺陷是遗传病所致,以染色体异常为主[7]。目前对于预防遗传性疾病最好的干预方式是进行产前诊断、产前干预,其中NIPT 检测因较血清学筛查和超声NT 而言,有着更好的检测效能[8],备受大众青睐。然而,无创产前基因检测并非百分百准确[5],如党颖慧等[9]报道发现,1 例患有子宫肌瘤的孕妇在进行NIPT 检测时,检测结果出现了假阳性。本研究对患有子宫肌瘤的孕妇群体进行整体分组研究,分析子宫肌瘤对NIPT 检测的影响。
在本研究中,虽然UM 组的年龄比对照组高,但王晓玲等[10]研究表明各年龄段并不影响NIPT的检测效能,故不影响两组的比较。本研究中,UM 组共检测出染色体异常高风险共12 例,阳性率为3.32%,明显高于对照组的阳性率0.68%,且UM 组的假阳性率2.79%也明显高于对照组0.31%,两组阳性率和假阳性率比较差异都具有统计学意义,说明UM 组的阳性率高于对照组可能是由于UM 组假阳性过多引起的,同时也提示子宫肌瘤会增加NIPT 结果出现假阳性的风险。
此外NIPT 检测在UM 组孕妇的胎儿染色体非整倍体检测中的灵敏度和阴性预测值达到100%,与以往文献[11-12]基本相符合,且NIPT 在UM 组中的特异度为97.21%,虽然低于对照组的99.69%,但仍说明NIPT 检测对UM 组孕妇的胎儿染色体非整倍体具备很高的检出能力,能有效预防染色体非整倍体胎儿的出生。
除此之外,UM 组的T18-三体和XXX 的阳性预测值低至为0,而对照组的T18-三体的阳性预测值为100%,提示子宫肌瘤患者NIPT 中T18-三体和XXX 的结果相对于健康人群而言可信度较低。而三例浆膜下类型的较大(直径≥70 mm)的子宫肌瘤同时导致NIPT 出现T18-三体和XXX 的假阳性结果,提示浆膜下类型的子宫肌瘤,在瘤体较大时,容易引起孕妇血清中的18 号染色体和X 染色体出现染色体非整倍体异常。UM 组中40%的假阳性为XXX 和T18-三体,其中XXX 异常结果的高检出率,与高达70%子宫肌瘤会发生X 染色体的异常有关[13],而T18-三体异常结果的高检出率以及其他染色体的异常则可能与子宫肌瘤发生的DNA 突变、基因多态性以及复杂的染色体重排有关[14]。
虽然子宫肌瘤是良性肿瘤,但其起源性是单克隆的,并且有40%~50%的子宫肌瘤会发生染色体畸变[15]。通过对UM 组假阳性病例的汇总分析发现,UM 组假阳性涉及第1、7、8、15、18、21、22 及X 染色体,这与甄珠等[16]对子宫肌瘤发生的相关染色体异常的细胞遗传学报道大体相符。说明子宫肌瘤发生染色体畸变的非整倍体染色体脱落细胞有可能会进入孕妇外周血,从而引起NIPT 检测的结果出现异常,进而导致结果假阳性。因此对于患有子宫肌瘤的孕妇,在进行NIPT 检测前,应告知其因子宫肌瘤可能存在的假阳性风险,避免孕妇拿到阳性结果报告后,在未进行产前诊断确认胎儿的健康状况前做出终止妊娠的错误决定。
综上所述,无创产前基因检测在患子宫肌瘤的孕妇的胎儿染色体非整倍体检测中有较高的应用价值,其染色体筛查高风险结果具有一定的预警作用,但对高风险结果需要结合产前诊断、临床表现进行综合判断。

