血清HMGB1、Alb 和NLR 对脑卒中恢复期肌少症的诊断价值
武磊 董卫青 张国梁 杨娜
脑卒中是目前全球内第二位死亡原因,占据全球总死亡人数的11.6%[1]。因骨骼肌为脑卒中的主要靶器官,因此脑卒中引起的肌少症则进一步加重患者功能障碍,阻碍患者康复进度[2]。肌少症最早由Rosenberg 提出,属于老年人群中较为常见的肌肉疾病,近几年呈现年轻化趋势,患者表现为肌肉质量下降、肌肉强度下降等,增加患者骨折、跌倒、残疾等风险性,严重情况下可增加患者死亡风险。因此,积极筛选高度敏感性标志物早期诊断脑卒中恢复期肌少症并及早防治,是改善患者预后重要研究方向。高迁移率族蛋白B1(High Mobility Group Protein 1,HMGB1)属于一类高度保守的非组蛋白DNA 结合核蛋白,在真核细胞中普遍表达并调节转录[3]。HMGB1 可通过多种途径参与脑卒中进展[4-5]。最近一项研究表明[6],HMGB1 参与肌少症进展。白蛋白(Albumin,Alb)与脑卒中3 个月结局有关,低Alb 水平可增加患者死亡风险。Alb 降低是老年肥胖患者发生肌少症的独立危险因素[7]。中性粒细胞与淋巴细胞计数比值(Neutrophil to Lymphocyte Ratio,NLR)可以反映脑卒中后免疫失衡状态[8]。NLR≥3 晚期子宫颈鳞癌预后独立危险因素[9]。但本研究旨在探讨血清HMGB1、Alb 和NLR 与脑卒中恢复期肌少症之间的关系,并评估其在诊断脑卒中恢复期肌少症中的准确性和有效性,为临床医生提供更准确的判断和评估手段,以指导脑卒中患者的康复治疗和护理,内容如下。
1 资料与方法
1.1 研究对象
分析2018 年8 月至2022 年6 月在山西省运城市中心医院就诊的脑卒中恢复期患者80 例病历资料,其中男性42 例,女性38 例,年龄65~80岁,平均年龄(71.21±7.05)岁。纳入标准:①符合2019 年中华医学会神经病学分会脑血管病学组制定的脑卒中诊断标准[10],且均经过CT、MRI 证实;②处于稳定期;③意识正常,能够积极配合研究;④临床病历资料完整。排除标准:①伴有严重心、肝、肾等疾病;②合并恶性肿瘤;③合并造血系统、内分泌系统等原发性疾病。本研究均经患者及家属知情同意,且已通过医院伦理委员会准许。
1.2 研究方法
1.2.1 收集患者病历资料
包括患者年龄、性别、基础疾病、体质量指数、病程、病变侧边、病变性质、实验室指标、入院用药史(利尿剂、血管紧张素转换酶抑制剂、抗凝血药)等。实验室指标包括HMGB1、Alb、NLR、Ca、糖化血红蛋白(Glycated Haemoglobin,HbA1c)、肌酸激酶(Creatine Kinase,CK)、血小板计数(Platelet,PLT)、血红蛋白(Hemoglobin,Hb)、凝血酶原时间(Prothrombin Time,PT)、部分凝血活酶时间(Activated Partial Thromboplastin Time,APTT)、总胆固醇(Total Cholesterol,TC)、低密度脂蛋白胆固醇(Low-Density Lipoprotein Cholesterol,LDL-C)、高密度脂蛋白胆固醇(High density lipoprotein cholesterol,HDL-C)、空腹血糖(Fasting Plasma Glucose,FPG)。
1.2.2 血清HMGB1、Alb 和NLR 检测
采集患者入院肘静脉血6 mL,3 000 r/min,离心15 min,半径为10 cm,获取上层血清,采用全自动血细胞分析仪检测血液中性粒细胞、淋巴细胞水平,计算NLR=中性粒细胞/淋巴细胞,采用酶联免疫吸附法检测血清HMGB1 水平,相关操作步骤严格按照说明书进行,依据标准品的浓度及OD值,参考标准曲线,并计算样品浓度。血清Alb 水平采用溴甲酚绿法。
1.2.3 肌少症的评估及分组
依据亚洲肌少症工作组(Asian Working Group for Sarcopenia,AWGS)诊断标准[11],①四肢骨骼肌质量指数(Appendicular Skeletal Muscle mass Index,ASMI):BIA 男性<7.0 kg/m2,女性<5.7 kg/m2,或双能X 线吸收测量法(DEXA)测定男性<7.0 kg/m2,女性<5.4 kg/m2;②握力:男性<26 kg,女性<18 kg;③身体活动能力:6 m 步行试验步速<0.8 m/s。符合①且满足②和/或③即刻确诊为肌少症。依据患者是否符合肌少症的诊断将患者分为肌少症组28 例和非肌少症组52 例。
1.3 统计学方法
采用SPSS 26.0 统计软件对数据进行分析,计量资料用()表示,组间比较用t检验;计数资料用n(%)表示,组间比较用χ2检验,绘制受试者工作特征曲线(ROC),影响因素的分析采用Logistic 回归模型,以P<0.05 为差异有统计学意义。
2 结果
80 例脑卒中恢复期患者,合并肌少症28 例,发生率为35.00%(28/80)。
2.1 两组一般资料比较
两组一般资料比较,差异均无统计学意义(P>0.05)。见表1。
表1 两组一般资料比较groups[n(%),()]Table 1 Comparison of general information between the two groups[n(%),()]
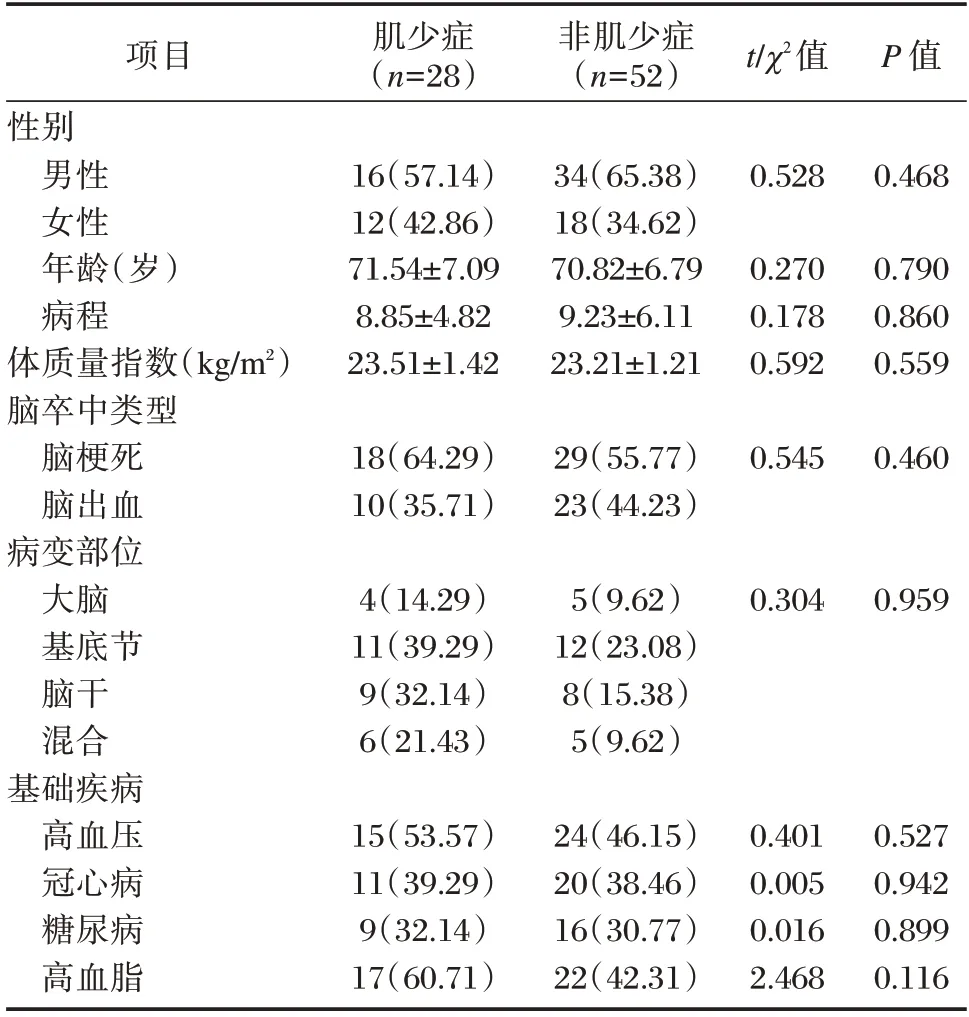
表1 两组一般资料比较groups[n(%),()]Table 1 Comparison of general information between the two groups[n(%),()]
2.2 两组实验室指标比较
两组HMGB1、Alb、NLR、CK、PLT、Hb、PT、APTT 比较,差异具有统计学意义(P<0.05),两组BUN、Scr、Ca、HbA1c、TC、LDL-C、HDL-C、FPG 比较,差异无统计学意义(P>0.05)。见表2。
表2 两组实验室指标比较()Table 2 Comparison of laboratory indicators between the two groups()

表2 两组实验室指标比较()Table 2 Comparison of laboratory indicators between the two groups()
2.3 两组入院用药史比较
两组入院用药史比较,差异均无统计学意义(P>0.05)。见表3。
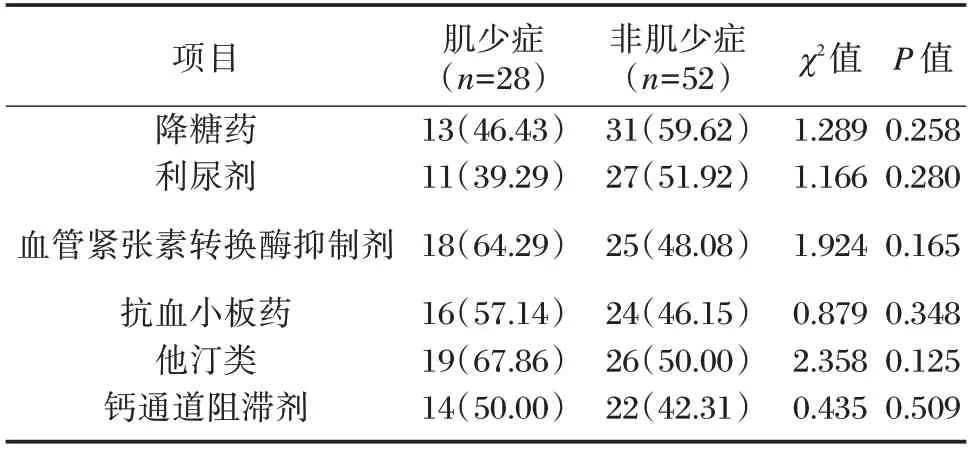
表3 两组入院用药史比较[n(%)]Table 3 Comparison of admission medication history between the two groups[n(%)]
2.4 脑卒中恢复期肌少症的影响因素分析
以脑卒中恢复期肌少症为因变量(否=0,是=1),以实验室指标中具有显著性差异的指标作为自变量,进行多因素Logistic 回归分析。结果显示:HMGB1 升高、Alb 下降、NLR 升高、CK 升高、PLT 下降、Hb 下降、PT 升高、APTT 升高均是脑卒中恢复期肌少症的危险因素(P<0.05)。见表4。

表4 脑卒中恢复期肌少症的多因素Logistic 回归分析参数Table 4 Multivariate Logistic regression analysis parameters of sarcopenia in convalescent stroke
2.5 血清HMGB1、Alb 和NLR 对脑卒中恢复期肌少症的诊断效能分析
血清HMGB1、Alb 和NLR 联合诊断效能高于单一诊断效能(P<0.05)。见表5、图1。
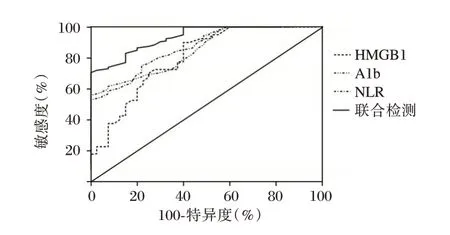
图1 ROC 曲线Figure 1 ROC curve
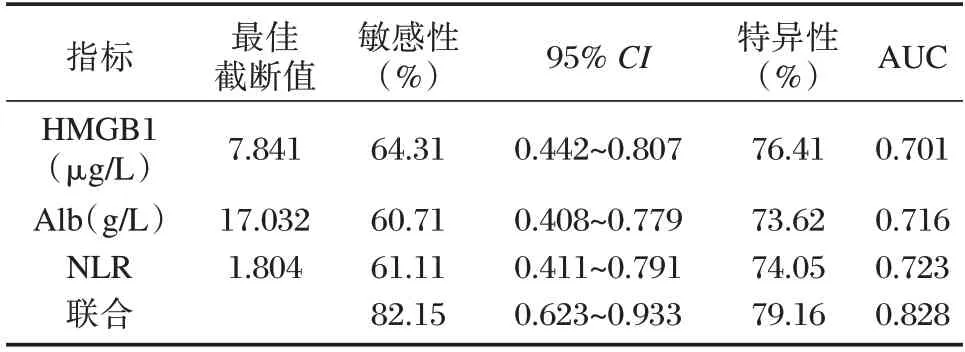
表5 血清HMGB1、Alb 和NLR 对脑卒中恢复期肌少症的诊断效能分析Table 5 Analysis of diagnostic efficacy of serum HMGB1,Alb and NLR in sarcopenia during convalescence of stroke
3 讨论
脑卒中肌少症可引起代谢疾病发生,增加心脑血管发生风险。另外也有研究称[12],脑卒中肌少症还可使患者活动能力下降,影响患者生活质量,还可加重神经功能受损程度。由此,积极预防脑卒中肌少症具有重要意义。脑卒中肌少症测量工具不同患病率也存在差异。一项Meta 分析显示[13],脑卒中肌少症患病率为42%,若以AWGS 诊断标准为53.5%,若以欧洲老年人肌少症工作组(European Working Group on Sarcopenia in Older People,EWGSOP)标准则患病率为48.3%,骨骼肌质量指数(Skeletal Muscle Mass Index,SMI)为标准则患病率为16.8%。本次研究结果显示,80 例脑卒中恢复期患者,合并肌少症28 例,发生率为35.00%,与目前报道具有相似性。
脑卒中恢复期肌少症的发病机制较为复杂,受到多种内在及外在因素的影响,如炎症反应、营养状况等均与肌少症密切相关。研究称[14],缺血性脑卒中患者血清异常升高的HMGB1 能够引起氧化应激反应、内皮损伤加剧。一项基础实验研究称[15],人参皂苷通过缓解缺血性脑卒中炎症反应可以降低HMGB1 蛋白表达。脑卒中营养状况如营养消耗过多可引起肌肉合成减少,促进肌少症的发生。一项研究报道[16],合并肌少症的脑梗死患者营养状况较未合并肌少症的脑梗死患者更差。通过监测Alb 水平可以评估机体的蛋白质状况和营养状况。NLR 常被用于评估机体全身性炎症反应[17]。Borges等[18]称,肿瘤患者NLR≥6.5 肌少症可达到61.54%。陈丽等[19]称,肌少症患者NLR 水平显著高于非肌少症,说明可能通过检测NLR 水平可预测肌少症。本次研究结果发现,肌少症组HMGB1、NLR 高于非肌少症,导致这一结果原因可能与炎症反应、神经损伤和炎性因子与肌肉损伤等多种因素共同作用有关,肌少症是一种免疫介导性疾病,机体的免疫系统处于激活状态,可能导致HMGB1、NLR 水平升高,另外肌少症患者的神经肌肉接头受损,导致肌肉萎缩和神经肌肉传导障碍,可能会引发细胞死亡,细胞死亡会释放细胞内物质,其中包括HMGB1,进而导致其水平升高。也可能肌少症患者身体代谢产生的自由基和氧化物质超过了机体清除的能力,导致氧化应激,氧化应激可以引起细胞损伤和死亡,并释放HMGB1 和NLR 等分子。肌少症组Alb 低于非肌少症,可能与肝功能受损、营养摄入不足、炎症反应及肾功能损害有关,肌少症患者在疾病发展过程中可能出现咀嚼、吞咽和消化吸收困难等问题,导致摄入的营养不足,因为白蛋白是一种需要人体摄入蛋白质后才能产生的蛋白质,所以肌少症患者的营养不良可能导致白蛋白水平降低。另外肌少症患者的肌肉可能会遭受到不同程度的损伤,导致释放的白蛋白流失到体外,从而降低体内的白蛋白水平。白蛋白由肝脏合成,若肝脏出现问题,也可能会导致白蛋白的合成减少,从而降低体内的白蛋白水平,推测肌少症患者可能出现肝功能异常导致合成白蛋白减少。Logistic 回归分析显示,HMGB1 升高、Alb 下降、NLR 升高是脑卒中肌少症危险因素,表明血清HMGB1、Alb、NLR 水平与脑卒中肌少症有关。ROC 曲线分析显示,血清HMGB1、Alb、NLR和联合 诊断AUC分别为0.701、0.716、0.723、0.828,进一步证实血清HMGB1、Alb 和NLR 与脑卒中恢复期肌少症密切相关,且可以用于辅助诊断脑卒中恢复期肌少症。综上所述,血清HMGB1、Alb 和NLR 可用于辅助诊断脑卒中恢复期肌少症,且诊断效能良好。

