胃镜活检与术后病理检查在胃癌诊断中的一致性、准确性研究
田 野
(中国人民解放军陆军第七十三集团军医院,福建 厦门 361000)
相关调查[1]显示,2017年我国每年胃癌新发病例达39.78/10万,病死率高达25.16/10万,1990—2017年我国胃癌发病率、病死率呈不同程度上升,尤其是中青年胃癌发病率也显著提高,胃癌发生率提高与人们不良饮食密切相关。因此,应重视胃癌防控工作,加强早期胃癌筛查和诊断,尽早治疗,降低病死率。胃癌早期无特异性症状,多与胃溃疡、胃炎等胃病症状相似,容易被忽视,故早期诊断难度较大[2]。目前,胃癌诊断方法包括实验室指标检测、影像学检查、胃镜检查、病理诊断等,其中胃镜检查是术前早期胃癌筛查重要方法,术后病理检查是胃癌诊断金标准[3]。术前胃镜活检可通过放大胃镜联合染色胃镜技术显示胃壁恶性肿瘤浸润程度,提高胃癌检出率,为患者治疗方案拟定提供参考依据。随着内镜技术不断发展,胃镜活检诊断效果逐渐提升,但是否能取代外科病理检查,实现患者个体化治疗,还存在一定的争议。本院尝试对比和分析术前胃镜活检方法与手术病理检查方法诊断一致性及准确性,发现术前胃镜活检对病变组织分化程度与分型的判断具有一定的价值,报道如下。
1 对象与方法
1.1 一般资料 研究经医院伦理委员会审核批准,回顾性分析2021年6月至2022年12月于我院行胃部分切除手术的87例胃癌患者临床资料。纳入标准:临床资料齐全;经影像学检查诊断胃部肿瘤;有正常交流能力;术前心电图、血常规、凝血功能等检查结果正常;患者及家属已签署研究知情同意书。排除标准:术前已进行放疗或化疗;合并精神系统疾病;合并其他恶性肿瘤;伴急性胃出血、胃穿孔;近1年行胃部切除手术;肝、肾等重要脏器功能不全;伴心血管疾病;生存周期小于6个月。87例患者中,男性患者54例,女性患者33例;年龄45~85岁,均值(67.92±8.87)岁;上腹胀33例,上腹痛23例,上消化道出血23例,恶心呕吐8例。
1.2 方法
1.2.1 术前胃镜活检 术前,对所有患者采用电子胃镜检查仪器(OLYMPUS GIF-H260)进行胃镜活检,细致观察胃黏膜,针对无法直观判断是否病变的组织部位,可钳取胃黏膜组织进行活检。针对胃黏膜下病变患者,采集患者黏膜中间凹陷位置的组织作为活检标本。针对平坦型胃癌病灶,应从肿瘤周围黏膜皱襞中段部位采集组织作为活检标本。针对凹陷型病灶,应采集溃疡病变周围组织。针对隆起型病灶,应除去隆起部位,从糜烂粗糙部位、色泽改变部位及胃黏膜基底部位采集组织作为活检标本。
1.2.2 术后病理检查 在手术过程中,观察患者病灶分布范围、大小、浸润情况,切除疑似病灶组织,将其作为病理检查标本,并送至病理科,经石蜡切片、染色和制片处理后,采用显微镜观察,记录组织浸润程度、分化情况、细胞学形态结构、是否发生转移、病理组织类型等。参照相关术后病理诊断标准进行病理诊断。
1.3 观察指标 ①对比两种检查方法的疑似胃癌、排除胃癌、确诊胃癌占比率:对术前胃镜活检和术后病理检查的标本进行分析,从血流情况、分化程度、细胞学形态判断是否符合《CACA胃癌整合诊治指南(精简版)》[4]中胃癌诊断标准。若样本组织无异常情况,则可排除。若各方面均符合标准,则确诊为胃癌。若仅存在一项或两项符合标准,且未完全符合病理确诊标准,即为疑似胃癌,需二次取样进行病理检查证实。②对比两种方法的不同病理类型和不同分化程度检出率,病理类型包括黏液腺癌、管状腺癌、乳头状腺癌、印戒细胞癌,分化程度包括分化型和分化不良型。③分析两种方法对胃癌细胞浸润深度诊断一致性。
1.4 统计学方法 采用SPSS 25.0统计学软件对本次研究数据进行分析,计数资料与计量资料分别以百分比(%)、表示,并分别行χ2检验、t检验。P<0.05表示数据存在统计学差异。
2 结果
2.1 术前胃镜活检与术后病理检查的确诊率比较 术前胃镜活检检出疑似胃癌、排除胃癌占比率高于术后病理检查,确诊胃癌占比率低于术后病理检查,差异有统计学意义(P<0.05)。见表1。
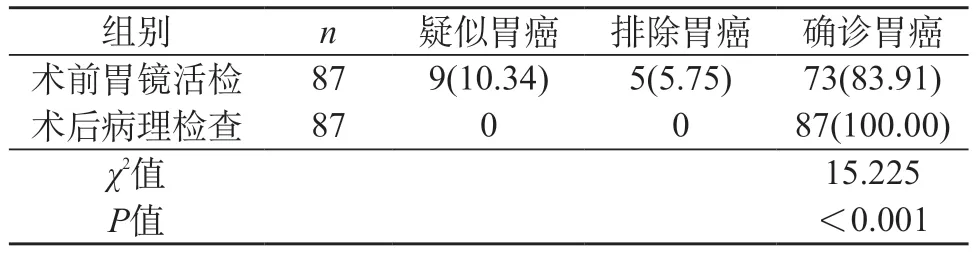
表1 术前胃镜活检与术后病理检查的确诊率比较[n(%)]
2.2 两种病理检查方法不同病理类型检出率比较 术前胃镜活检检出管状腺癌、印戒细胞癌占比率低于术后病理检查,黏液腺癌、乳头状腺癌占比率高于术后病理检查,差异有统计学意义(P<0.05)。见表2。
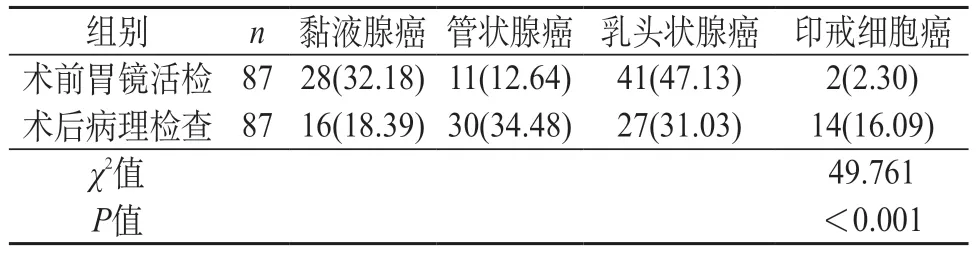
表2 两种病理检查方法不同病理类型检出率比较[n(%)]
2.3 术前胃镜活检与术后病理检查分化程度比较 术前胃镜活检分化型检出率低于术后病理检查,分化不良型检出率高于术后病理检查,差异有统计学意义(P<0.05)。见表3。
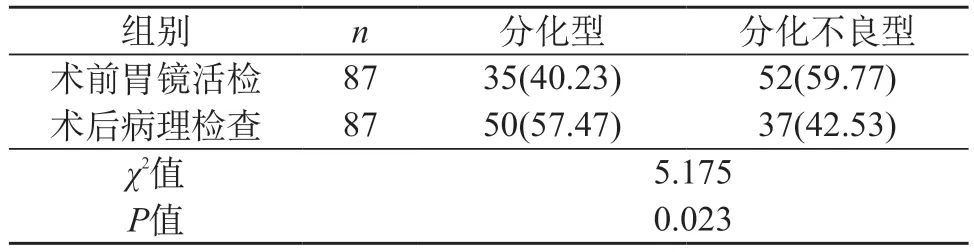
表3 术前胃镜活检与术后病理检查分化程度比较[n(%)]
2.4 术前胃镜活检与术后病理检查对胃癌细胞浸润深度诊断一致性分析 术前胃镜活检与术后病理检查对胃癌细胞浸润深度的诊断一致率为91.95%(80/87),Kappa一致性指数为0.826(P<0.05)。见表4。

表4 术前胃镜活检与术后病理检查对胃癌细胞浸润深度诊断结果(n)
3 讨论
胃癌发病与幽门螺杆菌感染、饮食生活、地域环境、慢性胃疾病及遗传等因素有关,好发于胃窦部,该疾病患者可出现消瘦、食欲缺乏、上腹疼痛等症状。随着肿瘤生长,对胃肠功能影响逐渐显著,症状也随之加重,当肿瘤破坏血管后,可引起黑便、胃出血等消化道出血症状,还会出现肿瘤细胞远处转移,错失最佳手术治疗时机,增加治疗难度,提高病死率[5]。
因此,尽早对疑似胃癌患者明确诊断,有利于及时切除胃癌组织,提高5年生存率。目前,外科手术病理检查是胃癌诊断金标准,但检查创伤性较大,还可能造成癌细胞种植转移。相比之下,术前胃镜活检检查创伤性较小,检查费用较低,操作简便,可以避免外科病理检查带来的疼痛不适感[6-7]。近年来,胃镜活检技术日益成熟,对胃癌诊断准确性也有所提升,使胃镜检查逐渐纳入常规体检中,对早期胃癌筛查发挥重要作用,同时随着内镜技术的发展,部分胃癌患者在胃镜黏膜切除术或黏膜剥离术下获得根治。
值得注意的是,胃镜取材范围和视野受到一定的限制,难以检查到全部病变组织,存在一定的不足。本研究对术前胃镜活检与术后病理检查对胃癌诊断准确性进行比较,结果显示,术前胃镜活检确诊胃癌占比率低于术后病理检查,疑似胃癌、排除胃癌占比率高于术后病理检查,差异有统计学意义(P<0.05)。由此提示,术前胃镜活检与术后病理检查对胃癌诊断结果缺乏一致性。分析原因,胃镜下在可疑病灶中取到的组织量和范围较小,对深部可疑组织不能取出进行化验,取材具有一定的局限性,无法全面囊括所有病变组织,还可能取到炎症组织或正常组织而造成误诊或漏诊[8]。术后病理检查是在手术中将切除的病变组织送至病理科检查,确定病例类型,可选取深部、面积较大的标本,术后病理检查组织比较完整,基本上不会出现误诊或漏诊情况,故诊断准确性较高[9-10]。本研究结果显示,在比较不同组织病理类型检出率中,相比于术后病理检查,术前胃镜活检检出管状腺癌、印戒细胞癌占比率较低,黏液腺癌、乳头状腺癌占比率较高;在比较不同分化程度检出率中,相比于术后病理检查,术前胃镜活检对分化型检出率较低,分化不良型检出率较高。这表明术前胃镜活检与术后病理检查在病变组织不同分化程度和病理类型诊断中缺乏一致性。究其原因,根据组织病理学,胃癌可分为腺癌、类癌、鳞癌、腺鳞癌等,腺癌按不同组织结构还可分为印戒细胞癌、黏液腺癌、管状腺癌与乳头状腺癌,同时根据不同分化程度,又分为低分化、中分化与高分化[11]。同一个恶性肿瘤的不同位置可覆盖多种病理类型,而且分化程度也不同。此外,早期胃癌患者肿瘤组织分裂生长速度缓慢,在胃镜观察下病变组织表现与胃溃疡、胃息肉等病变组织相似,对部分不同分化程度或病理类型的病变组织造成误诊或漏诊[12]。在本研究中,术前胃镜活检与术后病理检查对胃癌细胞浸润深度的诊断一致率为91.95%(80/87),Kappa一致性指数为0.826(P<0.05),提示术前胃镜活检与术后病理检查对胃癌细胞浸润程度诊断一致性较高,术前胃镜活检有利于提高早期胃癌检出率。这是因为早期胃癌组织局限于胃黏膜及其下层,肉眼观察到黏膜呈平坦型、隆起型、凹陷型,而进展期胃癌组织浸润超过黏膜下层。胃镜动态性观察胃黏膜,还能采用双焦距内镜放大观察细微浸润情况,从而准确判断癌细胞浸润程度[13]。同时胃镜活检采用导光纤维管镜经食管探查患者胃黏膜病变情况,减轻对患者黏膜组织的损伤和出血情况,可以保证视野清晰,更细致地观察胃黏膜浸润程度,为判断胃癌癌前病变及胃癌提供可靠依据。此外,也可采用电子染色内镜呈现胃黏膜胃出血变化情况,并对比周围正常组织,进一步提升早期胃癌检出率。为了更好地采用术前胃镜活检方法准确诊断胃癌,应进一步优化胃镜活检检查,最大限度弥补不足。对此,在胃镜活检过程中,需根据患者实际病变情况,针对性取材,伴有胃溃疡患者,溃疡病灶表面常出现大量白细胞、纤维索,底部出现坏死组织或肉芽组织,胃镜下应从溃疡样病灶隆起边缘内侧钳取活检组织,组织块直径为2 mm以上,数量为4块左右,组织深度为黏膜下层,高度警惕胃镜下不规则、微小、浅表病灶,有助于提高诊断准确性。同时,随着内镜技术水平逐渐提升,临床可根据实际情况采用较先进、简便的内镜技术进行术前胃镜活检,弥补常规内镜活检的不足,最大限度提高胃癌诊断准确率。
综上所述,采用术前胃镜活检法可准确反映早期胃癌胃黏膜浸润程度,在一定程度上有效判断病变组织不同病理类型和分化程度,为临床诊断胃癌提供参考建议,诊断价值较高。但术前胃镜活检法与术后病理检查结果存在一定的差异,对胃癌进一步确诊,还需采用术后病理检查。临床需结合实际情况采取术前胃镜活检与术后病理检查全面评估胃癌浸润深度、分化程度、形态改变情况,明确胃癌诊断结果,避免误诊或漏诊情况。

