抑癌基因VHL与RNASET2甲基化协同microRNA调控卵巢癌细胞耐药逆转
丁万宝 张培先 郭 欢 卢久琴 邓 磊 石 岚 戴 辉 鲍 新 赵艳芳
(昆明市延安医院肿瘤科,云南 昆明 650000)
卵巢癌严重威胁妇女生命和健康[1]。由于卵巢癌早期缺少症状,约70%的患者发现时已处于晚期,5年生存率仅为30%[2]。绝大多数卵巢癌患者在化疗后会复发并发展成多药耐药[3],卵巢癌产生耐药机制的原理、预防耐药和对抗耐药是当前研究的热点与难点。多药耐药是指肿瘤和某种化疗药物长时间接触之后对其产生耐药性,且同时交叉耐受其他结构和作用机制不同的化疗药物[4-5]。目前报道的引起肿瘤耐药有多种原因,其中较为典型的是各种凋亡蛋白或凋亡抑制蛋白参与化疗药物诱导的细胞凋亡以及耐药的发生[6]。另外,代谢改变,已知铂类敏感性与内源性叶酸缺乏有关[7]。
肿瘤细胞耐药性的形成大多由多药耐药相关基因的差异表达所致[8]。耐药相关基因包括细胞周期相关基因、多药耐药相关基因、原癌基因及抑癌基因等[9],其中抑癌基因是一类存在于正常细胞中,与原癌基因共同调控细胞生长和分化的基因,其功能丢失会引起细胞失控分裂和生长,最终导致肿瘤的发生[10]。抑癌基因表达异常是由遗传物质和表观遗传修饰异常所致[11-12]。表观遗传修饰包括DNA甲基化、组蛋白修饰及miRNA等[13]。DNA甲基化是目前研究最多的表观遗传调控机制之一,而由CpG岛的DNA超甲基化所致的抑癌基因的沉默更是目前表观遗传领域研究的重要内容[14]。另外,miRNA通过和靶基因之间一对多和多对一的调控关系,广泛参与调节机体生长发育、生理功能等生命活动过程,尤其是恶性肿瘤的发生发展过程[15]。DNA甲基化和miRNA之间还存在双向调控作用,这在很多肿瘤研究包括卵巢癌的研究中已得到证实[16-17]。
本研究通过筛选GEO 公共数据库数据集(GSE176218 Public on May 16,2022;GSE198077 Public on Apr 20,2022),比较耐药细胞和非耐药细胞的基因表达谱筛选在耐药细胞中的抑癌基因,然后通过CpG岛及甲基化位点分析,miRNA预测和GeneMANIA互作网络分析软件等对抑癌基因进行生物信息学分析,探索抑癌基因表观遗传修饰和卵巢癌多药耐药机制。
1 资料与方法
1.1 差异基因筛选 基因芯片获取:按照样本数量超过20例、设置对照组和人卵巢组织标本条件在NCBI的GEO数据库中随机筛选出2套卵巢癌数据集(GSE176218 Public on May 16,2022;GSE198077 Public on Apr 20,2022)(GSE176218,GSE198077)。从GPL570平台选择GSE79973、GSE54129,从GPL6947平台选择CSE29998数据集。其中GSE176218中有21例癌组织和111例正常组织,GSE198077中有50例癌组织和49例正常组织。系统检索GEO(Gene Expression Omnibus)(GSE176218,GSE198077)数据库,通过比较药物敏感和耐药样本基因表达差异对卵巢癌耐药相关基因芯片表达数据集进行检索。利用BH法分析差异基因表达,在GEO2R工具中开展多重假设检验方法。
1.2 抑癌基因CpG岛、甲基化位点及miRNA结合位点的生物信息学分析 通过在线CpG岛及甲基化位点分析软件CpGPlot和CpG Island Searcher对抑癌基因进行DNA甲基化预测。通过在线miRNA预测软件miRWalk和HOCTar对抑癌基因进行基因的靶miRNA预测,其同时包含了miRanda、miRDB等5个预测软件。“1”表示软件预测到了抑癌基因的靶miRNA,“0”表示没有预测到。针对每个抑癌基因,本研究仅选取得分最高的两个miRNA进行相关研究。通过GeneMANIA基因/蛋白网络分析软件对抑癌基因进行互作分析。
1.3 Kaplan-Meier数据库的使用 采用Kaplan-Meier Plotter在线分析抑癌基因表达水平与卵巢癌预后的关系,以抑癌基因表达水平的中位数作为分组依据,分为高、低表达两组,然后分别选择卵巢癌的总生存期进行分析。
1.4 细胞培养 人卵巢癌SKOV3细胞培养于含10%FBS的DMEM完全培养液中,37 ℃,5% CO2培养箱中长期传代培养。采用慢病毒shRNA技术构建稳定表达hsa-miR-635 shRNA和hsa-miR-106b shRNA或对照shRNA的慢病毒,感染SKOV3细胞构建稳定细胞株。
1.5 实时荧光定量PCR(RT-qPCR)miRNA逆转录采用miRcute miRNA第一链cDNA合成试剂盒。PCR反应采用miRcute miRNA荧光定量检测试剂盒。具体操作按试剂盒说明进行。
1.6 双荧光素酶报告基因检测 向人卵巢癌SKOV3细胞转染或不含靶基因3'-UTR序列的pLUC载体,筛选稳定转染细胞系。然后将化学合成的miR-635和miR-106分子的mimics分别共转染至上述稳定转染细胞系。细胞共转染48 h,按说明书,分别测定萤火虫荧光素酶RLU值。
1.7 细胞活力实验 将SKOV3细胞接种于96孔板,用不同浓度的药物或抑制剂处理后调整细胞密度至每孔5 000,将20 μL MTT溶液加入其中,孵育时间为4 h。对细胞培养进行终止,将培养液上清去掉,之后将150 μL的DMSO加入到每孔中,对其进行振荡,结晶融解之后在490 nm波长处对细胞吸光度进行检测。
1.8 统计学方法 采用SPSS 21.0统计学软件对数据进行分析,符合正态分布的计量资料用表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 差异基因筛选 利用公共平台数据库GEO,下载卵巢癌细胞系SKOV3耐药的相关数据(GSE176218,GSE198077),通过比较药物敏感和耐药样本的基因表达差异,筛选出2 450个表达差异基因,其中VHL和RNASET2基因表达差异最显著(表1,图1 A~B),且生存分析显示VHL和RNASET2高表达患者预后较好(图1 C~D)。将VHL和RNASET2基因作为候选基因,进行后续的功能研究。
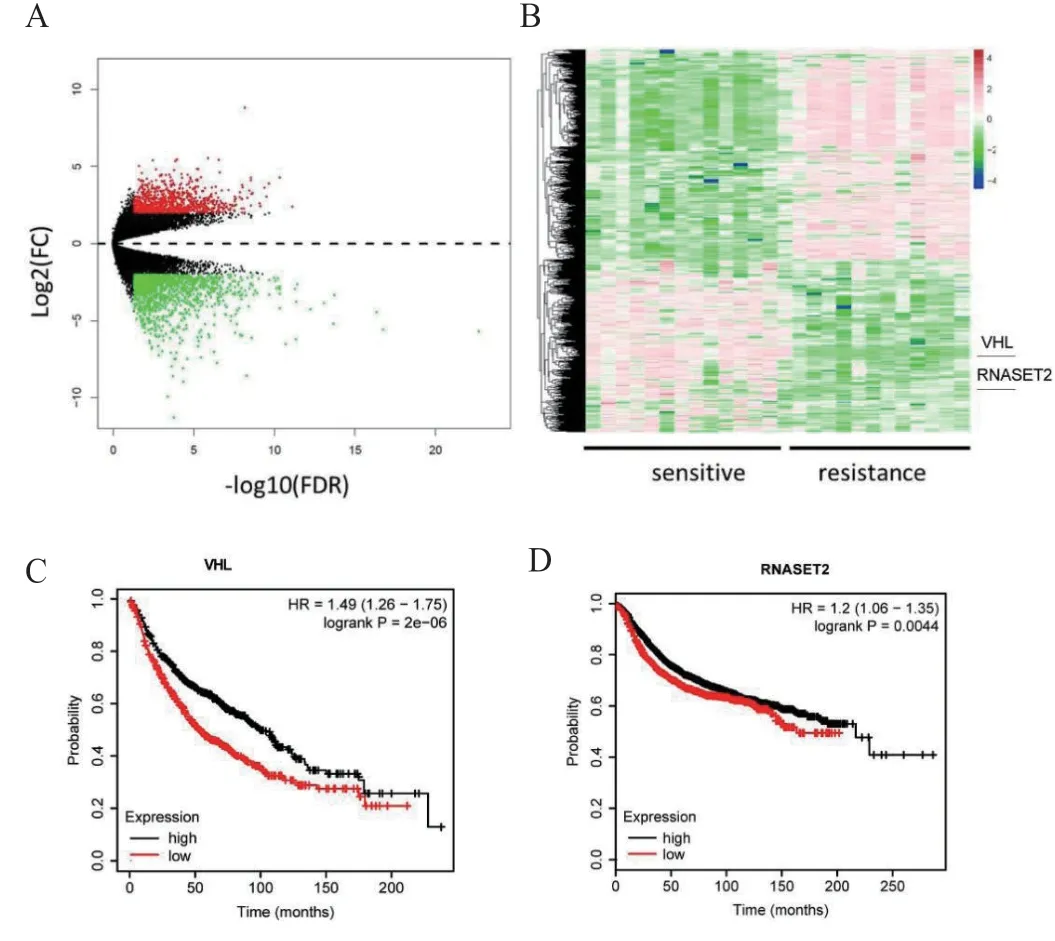
图1 差异基因筛选

表1 RNASET2和VHL基因芯片数据库数据及qPCR分析结果
2.2 VHL与RNASET2基因DNA甲基化程度和甲基化位点分析 通过甲基化位点分析软件CpG Island Searcher对VHL进行DNA甲基化预测,发现VHL与RNASET2均具有CpG岛和甲基化位点,推测VHL基因表达可能受DNA甲基化调控(图2 A)。利用甲基化抑制剂处理卵巢癌SKOV3/DDP耐药细胞,然后利用qPCR检测发现甲基化抑制剂处理后VHL和RNASET2表达显著升高(图2 B~C)。

图2 VHL和RNASET2基因DNA甲基化程度和甲基化位点分析
2.3 miRNA靶向抑癌基因的验证 利用shRNA技术在SKOV3/DDP细胞中分别敲低hsa-miR-635和hsa-miR-106b,结果显示sh-hsa-miR-635和sh-hsa-miR-106b稳转效率具有统计学意义(P<0.05)(图3 A~B),然后检测RNASET2和VHL基因表达,结果显示RNASET2和VHL基因表达显著升高(P<0.05)(表2,图3 C~D)。双荧光素酶检测结果显示,hsa-miR-635与RNASET2以及hsa-miR-106b与VHL间均存在靶向关系(图3 E~F)。
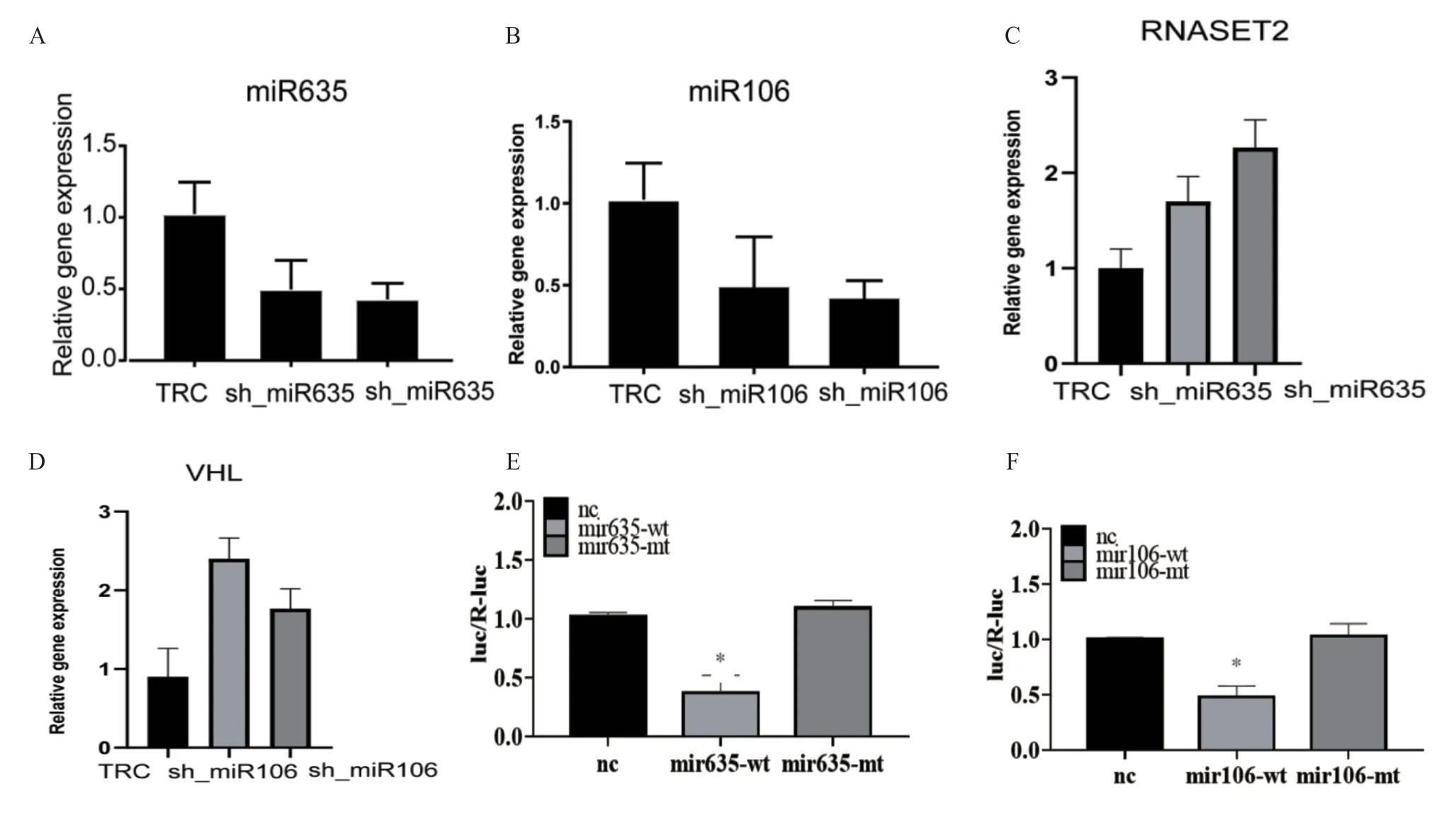
图3 miRNA靶向抑癌基因的验证
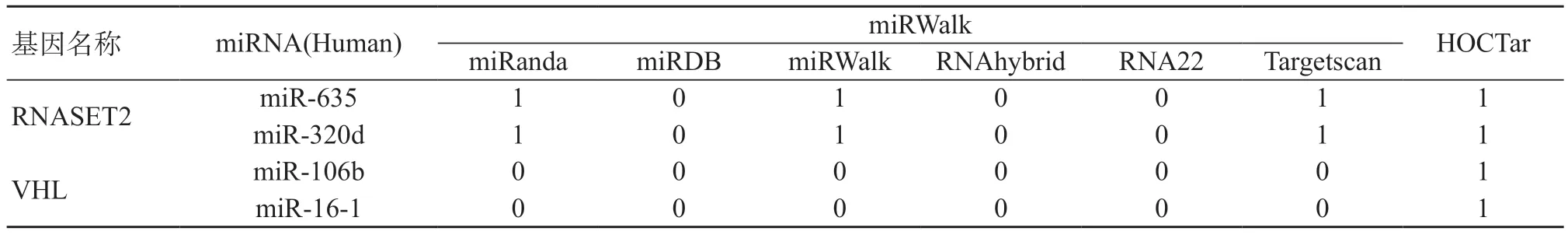
表2 在线软件miRWalk和HOCTar预测抑癌基因的靶miRNA
2.4 DNA甲基化及miRNA修饰协同调控卵巢癌细胞耐药性 在卵巢癌SKOV3/DDP耐药细胞系中敲低miR-106、miR-635、mi635+5-Aza-CdR,观察上述细胞系在化疗药物顺铂不同浓度作用下的细胞活力,结果显示敲低miR-106和miR-635都显著升高了细胞系对顺铂的敏感性,添加甲基化抑制剂后,敏感性进一步增加(图4)。

图4 MTT检测各组细胞在化疗药物顺铂不同浓度作用下的细胞活力
2.5 DNA甲基化及miRNA修饰协同通过PI3K/AKT分子机制调控卵巢癌细胞耐药性 有研究表明,miR-106可以调控PI3K/AKT信号通路[18],通过RT-PCR检测发现,敲低miR-106与miR-635和添加甲基化抑制剂后通过降低PI3K/AKT表达增加细胞对顺铂的敏感性(图5 A~D)。
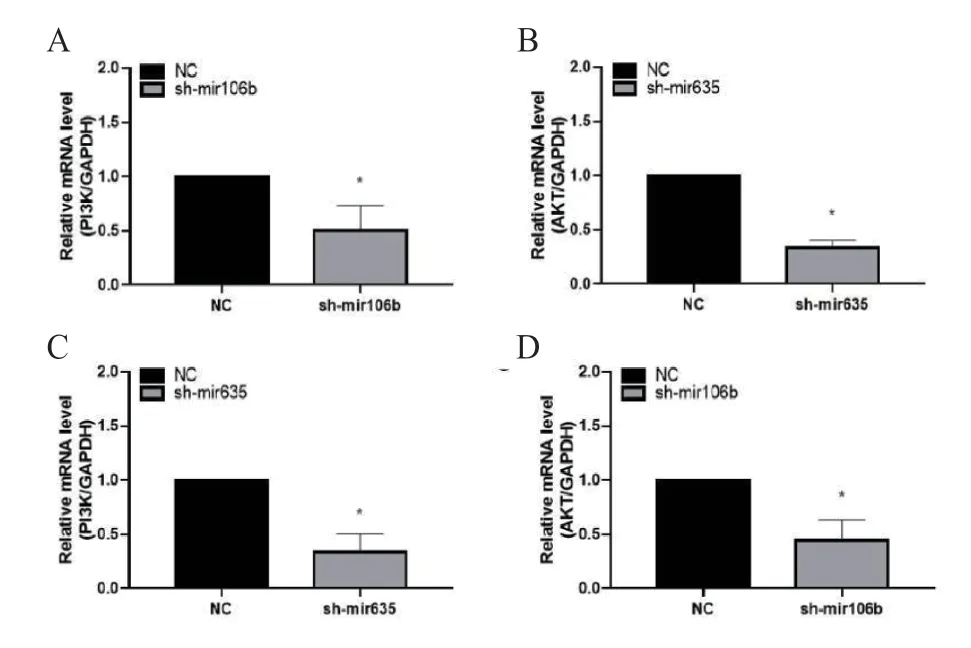
图5 RT-PCR检测PI3K/AKT水平上的表达变化
3 讨论
肿瘤多药耐药较为复杂,其中和多种生物学事件都有着很大关系,但均和差异表达存在密切关联[19]。本研究通过文献检索及功能富集等生物信息学分析,从卵巢癌耐药细胞系中筛选出2个与多药耐药相关的抑癌基因RNASET2和VHL。RNASET2被认为是第二类抑癌基因,并被证实通过参与调节微环境、肿瘤转移及细胞生长等来参与肿瘤的发生和发展。VHL是公认的抑癌基因,并被证实在多种肿瘤如肾癌、结肠癌及卵巢癌等多种实体癌的发展中发挥着重要作用[20],并通过参与=调控肿瘤生长和细胞死亡等方式参与肾癌细胞耐药的发生和发展[21]。
DNA甲基化和miRNA修饰是抑癌基因沉默表达的重要修饰方式,被证明和多药耐药的形成有关[22]。本研究发现,VHL、RNASET2均具有CpG岛和(或)甲基化位点,可能受DNA甲基化调控。DNA甲基化和miRNA修饰之间存在协同调控作用[23]。本研究通过Biogrid数据库查找基因水平和蛋白水平上的相互作用关系,并未发现RNASET2和VHL的相互作用关系,但它们分别与多个基因互作,且这些基因之间存在直接或间接的互作关系,在一定程度上可以说明RNASET2和VHL可能在功能上紧密相关[24]。
虽然抑癌基因的DNA甲基化和miRNA调控与卵巢癌多药耐药的相关研究取得了一定的进展,但由DNA甲基化和miRNA协同调控下的抑癌基因沉默与卵巢癌多药耐药相关的研究还鲜有报道。本研究结果表明,RNASET2和VHL基因沉默表达的DNA甲基化与miRNA的协同调控机制,在DNA甲基化抑制剂和miRNA抑制剂作用下,抑癌基因重新表达对卵巢癌细胞多药耐药的影响,DNA甲基化和miRNA协同调控下的抑癌基因通过影响PI3K/AKT信号通路影响卵巢癌多药耐药。本研究研究结果可对卵巢癌多药耐药问题进行更加深入研究和解决这一问题提供一定的参考和依据,对卵巢癌多药耐药的靶点治疗和靶药物的筛选提供理论指导,对临床诊断和预后有一定的指导意义。

