金花茶CnMYB4转录因子的克隆及表达分析
黄 松,许芳芳,张 辉,李 博,王 辉,周兴文
(1. 信阳农林学院, 河南 信阳 464000; 2. 信阳市林业科学研究所, 河南 信阳 464000;3. 玉林师范学院 生物与制药学院, 广西 玉林 537000; 4. 福建理工大学 建筑与城乡规划学院, 福建 福州 350118)
0 引言
金花茶(Camellianitidissima)是山茶科山茶属中黄色山茶花的代表植物,它的花瓣蜡质而金黄,花色漂亮,是培育黄色山茶的重要资源[1]。但通过杂交技术培育的大多数杂交后代的花朵并未呈现出金黄色,因此,金花茶花色成分及其形成机理的研究逐渐受到研究者的重视。已有研究发现,金花茶花瓣中富含的类黄酮物质,不仅是金花茶抵御外界胁迫的有用物质,而且还可能是导致金花茶花色形成的关键物质[2]。植物中类黄酮的合成由一系列结构基因编码的酶催化完成[3]。近年来,金花茶中许多与类黄酮合成有关的结构基因已被克隆,例如,CnCHS[4-5]、CnCHI[6]、CnDFR[7]、CnFLS[8]、CnF3’H[9]等结构基因。金花茶的花色形成机理正逐步被揭示,然而,目前关于金花茶花色形成的转录调控机制尚未阐明。
MYB转录因子是调控植物类黄酮合成的重要基因家族[10],该基因家族不仅数量众多,而且在植物器官形态建成、次生代谢、环境胁迫应答等过程中也发挥着重要作用[11-14]。根据MYB结构域的重复数量,MYB转录因子可划分为1R-MYB、2R-MYB(R2R3-MYB)、3R-MYB和4R-MYB等4种类型[15];其中R2R3-MYB转录因子含有的成员数量最多,是MYB转录因子家族中功能最多样化的亚族[16],但不同植物中R2R3-MYB转录因子的数量存在差异,例如,拟南芥(Arabidopsisthaliana)中有125个R2R3-MYB[17]、茶树(Camelliasinensis)中有122个[18]、巨桉(Eucalyptusgrandis)中有141个[19]、紫花苜蓿(Medicagosativa)中有186个[20]。根据MYB结构域的差异,R2R3-MYB转录因子在不同植物中可被进一步划分为不同的亚组[17]。AtMYB4转录因子属于SG4亚组(subgroup Ⅳ),除了AtMYB4,在拟南芥中SG4亚组含有的成员主要有AtMYB3、AtMYB7、AtMYB32、AtMYB308等[21],该亚组的转录因子具有调控苯丙烷、木质素等物质合成的功能,且大多数为抑制型转录因子[22]。
近年来,越来越多的MYB4已被克隆,例如,换锦花(Lycorissprengeri)LsMYB4转录因子[23]、茶树(Camelliasinensis)CsMYB4转录因子[24]、当归(Angelicasinensis)AsMYB4转录因子[25]、香蕉(Musaacuminata)MaMYB4转录因子[26]、绿萼凤仙花(Impatienschlorosepala)LcMYB4转录因子[27]等。部分MYB4基因的功能也被阐明,例如,拟南芥AtMYB4转录因子[28]、葡萄(VitisVinifera)VvMYB4-like转录因子[29]、烟草(Nicotianatabacum)NtMYB4转录因子[30]等,它们分别具有抑制苯丙氨酸合成、抑制花青苷积累、正向调节花青素合成等功能。之前的研究表明,类黄酮化合物是金花茶花色形成的关键物质,且在开花过程中CnMYB4转录因子的表达量与部分类黄酮合成结构基因的表达量存在着较强的相关关系[31]。但有关金花茶MYB4基因的克隆及表达研究尚未见报道。因此,为了解金花茶CnMYB4转录因子的表达情况,以及该转录因子在类黄酮合成途径中的调控作用,本研究将以金花茶花瓣为研究材料,利用RACE技术克隆金花茶CnMYB4转录因子的全长序列,对其进行生物信息学分析;并利用荧光定量PCR技术(qRT-PCTR),解析CnMYB4转录因子在金花茶的根、茎、叶、花等不同组织,以及不同开花过程的花瓣中的表达模式。
1 材料与方法
1.1 材料
在玉林师范学院苗圃中(N 22°40′58″,E 110°11′27″)选取生长良好、花盛开的金花茶植株;采集健康的金花茶植株的根、茎、叶、花等不同组织,以及不同开花时期的花瓣(图1),利用液氮对采集的金花茶组织进行速冻,随后保存在-70 ℃超低温冰箱中。

注:A.幼蕾期,B.初蕾期,C.显色期,D.半开期,E.盛开期
1.2 方法
1.2.1 金花茶不同组织总RNA的提取及CnMYB4转录因子的克隆
首先,利用RNA提取试剂盒(RNAprep Pure DP441,天根生化科技,中国北京)提取金花茶的根、茎、叶、花等不同组织的总RNA;随后,对金花茶总RNA进行琼脂糖凝胶电泳检测;最后,利用反转录试剂盒(PrimerScripTMRT reagent Kit, TaKaRa,中国大连)对总RNA进行反转录,从而获得cDNA模板。利用金花茶花瓣组织的转录组测序所获得的unigene序列,并从中筛选出金花茶CnMYB4转录因子序列,利用prime primer 3在线软件设计出金花茶CnMYB4转录因子的扩增特异性引物(表1),并利用该对引物对金花茶CnMYB4转录因子进行PCR扩增,PCR反应程序如下:94 ℃预变性,2 min;98 ℃变性,10 s;55 ℃退火,30 s;68 ℃延伸,60 s;共32个循环;68 ℃延伸5 min。

表1 CnMYB4转录因子克隆以及表达定量所用引物Tab. 1 Primers used for cloning and quantitative analysis of CnMYB4
利用1%琼脂糖凝胶电泳检测PCR扩增获得的产物,并将750 bp的电泳片段切下,使用琼脂糖凝胶DNA回收试剂盒(DP209-03,天根生化科技,中国北京)回收目的片段,按照试剂盒说明书进行操作。将目的片段连接在pEGOEP35S-H载体上(艾迪晶,中国武汉),再转化到大肠杆菌(Escherichiacoli)DH5α(TaKaRa,中国大连)中,随后进行菌落PCR检测,提取阳性菌斑的质粒进行测序,测序工作由武汉艾迪晶生物公司完成。
1.2.2CnMYB4转录因子的生物信息学分析
首先,使用TBtools软件[32]对金花茶CnMYB4转录因子的开放阅读框进行预测,利用NCBI网站的Conserved Domain Search程序(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)搜寻CnMYB4蛋白中所含有的保守结构域及超基因家族,通过NCBI网站的blastp程序(https://blast.ncbi.nlm.nih.gov/Blastp)搜寻金花茶CnMYB4的同源蛋白,选取4个与CnMYB4相似性最高的蛋白,并以拟南芥AtMYB4蛋白为参考,对上述6个蛋白进行多序列比对,该过程的构建及序列展示使用DNAMAN软件完成;随后,使用在线网站ExPASy(https://web.expasy.org/protparam/)对金花茶CnMYB4蛋白的基本理化性质进行预测,利用Plant-mPLoc在线网站(http://www.csbio.sjtu.edu.cn/cgi-bin/PlantmPLoc.cgi)对CnMYB4蛋白的亚细胞定位进行预测,金花茶CnMYB4蛋白的三级结构模型则利用SWISS-MODEL在线网站(https://swissmodel.expasy.org/interactive)进行预测;最后,利用最大似然法(maximum likelihood, ML)构建系统进化树(bootstrap=1000),分析金花茶CnMYB4蛋白的系统进化关系,该过程利用MEGA10软件构建完成。
1.2.3CnMYB4转录因子的定量分析
利用Primer 5软件设计CnMYB4转录因子的荧光定量PCR引物(表1);利用18S rRNA作为内参基因进行荧光定量PCR(qRT-PCR)反应[8-9],检测CnMYB4转录因子在侧根、茎、叶、盛开的花等不同组织中的表达情况,此外还检测了CnMYB4转录因子在花瓣发育过程中的表达情况,每个样品重复3次,采用2-∆∆CT法计算差异基因的相对表达量,并利用单因素方差分析模型分析不同表达量之间是否存在显著性差异。
2 结果与分析
2.1 金花茶CnMYB4转录因子的克隆
以金花茶花瓣的cDNA为模板,利用特异性引物扩增,随后进行凝胶电泳检测,得到了约750 bp的扩增条带(图2)。对扩增产物进行测序,金花茶CnMYB4转录因子序列的开放阅读框(CDS)含有735个碱基,共编码244个氨基酸。在NCBI数据库中,对CnMYB4蛋白的氨基酸编码序列进行Blast比对,发现CnMYB4与狭叶油茶(Camellialanceoleosa)Myb related 308-like蛋白(XP_028099008.1)、茶树CsMYB4a 蛋白(ARB51599.1)、君迁子(Diospyroslotus)Myb-related 308-like蛋白(XP_052191850.1)、葡萄VvMYB4a蛋白(NP_001268129.1)的相似性(identity)较高,分别为99.18%、99.18%、85.83%、84.00%。
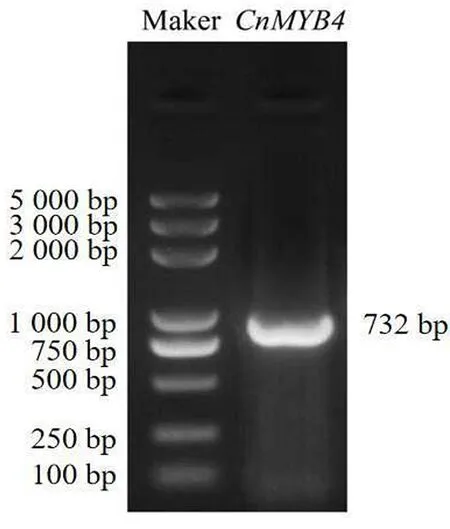
图2 金花茶CnMYB4转录因子cDNA的PCR扩增Fig. 2 PCR amplification of CnMYB4 transcription factor
2.2 金花茶CnMYB4编码蛋白的特征分析
金花茶CnMYB4蛋白的分子式为C1186H1895N347O370S14,原子总数为3 812,蛋白分子的质量约为27.38 kD,等电点(pI)为7.97。CnMYB4蛋白含有影响蛋白质酸碱性的氨基酸共68个,其中呈碱性的氨基酸有35个,由18个精氨酸(Arg)、17个赖氨酸(Lys)所组成,而呈酸性的氨基酸有33个,由12个天冬氨酸(Asp)、21个谷氨酸(Glu)组成;CnMYB4蛋白的不稳定系数值(instability index)为55.98,显示该蛋白为不稳定蛋白;CnMYB4蛋白的亲水指数(grand average of hydropathicity, GRAVY)为-0.624,显示该蛋白具有亲水性,而脂溶指数(aliphatic index)则为74.02。特定匹配上的Myb_DNA-binding(登记号:pfam00249)、SANT(登记号:smart00717、cd00167)等保守结构域存在于CnMYB4蛋白中,它们的起止氨基酸位点分别为67—111位、67—114位,这些结构域均属于SANT超基因家族(SANT superfamily,登记号:cl21498),分析结果显示金花茶CnMYB4蛋白具有植物MYB转录因子的典型保守区域(图3)。此外,对金花茶CnMYB4蛋白、狭叶油茶ClMYB308蛋白(XP_028099008.1)、茶树CsMYB4a蛋白(ARB51599.1)、君迁子DlMYB308-like蛋白(XP_052191850.1)、葡萄VvMYB4a蛋白(NP_001268129.1)以及拟南芥AtMYB4的蛋白序列进行同源比对,发现它们的N端序列相对比较保守,而C端序列的差异则相对较大,但它们都具有相同的R2 domain、R3 domain保守结构域以及C1(RGIDPxTHRP[L/I]NE)、C2(PDLNL[D/E]LxI[G/S])、Zf(Zinc finger)(G[Y/F]DFLGL)、C4(FLGLX4—7[V/L]L[D/G][F/Y][R/S]X1LEMK)等基序(motif)(图4),其中CnMYB4与近缘物种茶树CsMYB4a蛋白的相似性最高。
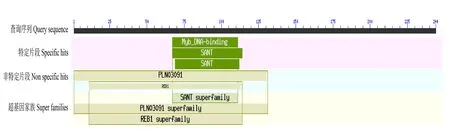
图3 金花茶CnMYB4蛋白的保守结构域预测Fig. 3 Prediting conservative domain of CnMYB4 protein

图4 金花茶CnMYB4蛋白与5个不同物种(狭叶油茶、茶树、君迁子、葡萄、拟南芥)的同源基因氨基酸序列比对Fig. 4 Amino acid sequence comparison of CnMYB4 protein with homologous genes of five different species (Camellia lanceoleosa,Camellia sinensis,Diospyros lotus L.,Vitis vinifera L.,Arabidopsis thaliana)
利用Psipred在线网站预测CnMYB4蛋白的二级结构,发现CnMYB4蛋白由无规则卷曲(random coil)、α-螺旋(α-helix)、β转角(β-turn)以及延伸链(extended strand)等元件组成,其中无规则卷曲、α-螺旋分别占比56.97%、27.05%(图5);此外,利用SWISS-MODEL对金花茶CnMYB4蛋白的三级结构进行预测,也发现了类似的结果,即存在着2个螺旋-转角-螺旋(helix-turn-helix,HTH)结构,符合R2R3-MYB蛋白的构型特征(图6)。随后利用在线网站(Plant-mPLoc)对CnMYB4蛋白进行亚细胞定位预测,结果表明该转录因子定位在细胞核中的可能性较大。
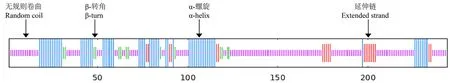
注:紫色为无规则卷曲,绿色为β转角,蓝色为α-螺旋,红色为延伸链。
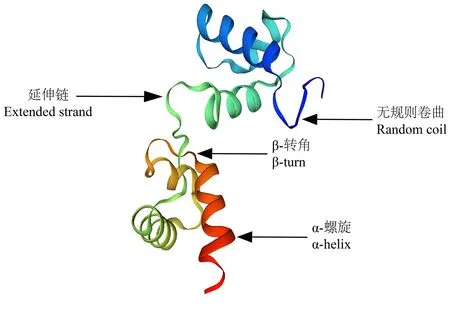
图6 金花茶CnMYB4蛋白的三维结构预测Fig. 6 Prediction of the tertiary structure of CnMYB4 protein
2.3 金花茶CnMYB4蛋白质的系统进化分析
为解析金花茶CnMYB4蛋白与其他植物MYB4蛋白的系统进化关系,通过NCBI数据库搜寻,获得了18条与金花茶CnMYB4蛋白同源性较高的氨基酸序列(Identity>78%),随后将这些氨基酸序列与金花茶CnMYB4蛋白一起构建系统进化树,结果显示金花茶CnMYB4蛋白与同为山茶科山茶属的茶树CsMYB4a蛋白的亲缘关系最近,在系统进化树中它们被聚类于一个小分支内;另外还发现金花茶CnMYB4蛋白与狭叶油茶、中华猕猴桃(Actinidiachinensis)、刺葡萄(Vitisdavidii)、葡萄等植物的MYB4或MYB308蛋白也具有较高的相似性,它们被聚类于一个亚分支内;而金花茶CnMYB4蛋白与褐枝猕猴桃(Actinidiarufa)、哥伦比亚锦葵(Herraniaumbratica)、木槿(Hibiscussyriacus)、榴莲(Duriozibethinus)、南京椴(Tiliamiqueliana)等植物的MYB4或MYB308蛋白的亲缘关系最远(图7)。
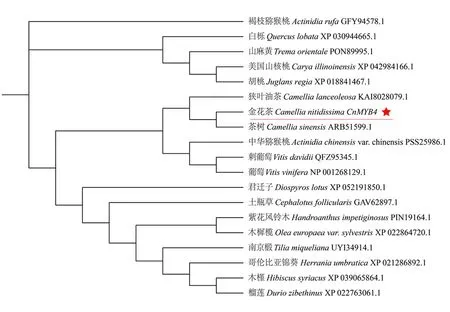
图7 金花茶CnMYB4蛋白的系统发生树Fig. 7 Phylogenetic tree of CnMYB4 protein
2.4 金花茶CnMYB4转录因子的表达量分析
对CnMYB4转录因子在金花茶的根、茎、叶、盛开的花等不同组织的表达量进行荧光定量PCR(qRT-PCR)检测,以侧根中CnMYB4的表达量为对照,发现CnMYB4主要在金花茶的花中高表达,在叶中的表达量相对较低,且CnMYB4转录因子在花、叶中的表达量与根中的表达量存在显著差异(图8)。此外,在幼蕾期(A)、初蕾期(B)、显色期(C)、半开期(D)、盛开期(E)等5个不同的开花阶段的花瓣中,CnMYB4转录因子的表达量在幼蕾期最高,在初蕾期最低,总体上表现为先高后低、逐步下降的趋势(图9)。
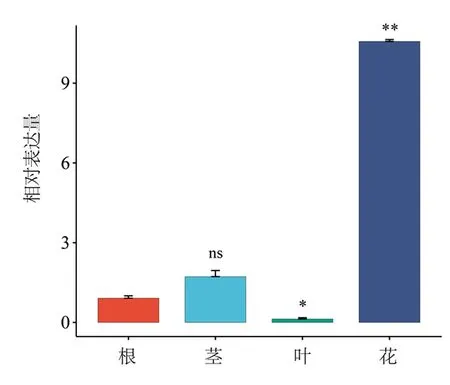
注:*.叶的表达量相对于根,差异显著(P<0.05);**.花的表达量相对于根,差异极显著(P<0.01);ns代表没有显著区别。
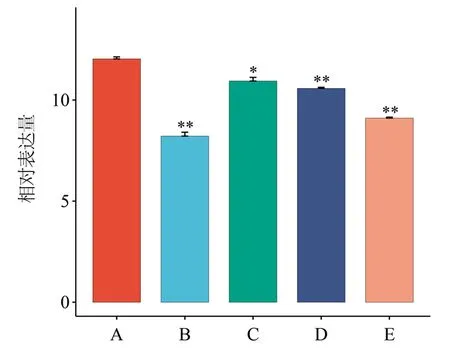
注:A为幼蕾期,B为初蕾期,C为显色期,D为半开期;E为盛开期;**.B、D、E的表达量相对于A,差异极显著(P<0.01);*.C的表达量相对于A,差异显著(P<0.05);ns代表没有显著区别。
3 讨论
本研究中克隆获得的金花茶CnMYB4转录因子全长序列为735 bp,编码244个氨基酸,且该转录因子含有R2R3-MYB转录因子所特有的保守基序,如Myb_DNA-binding、SANT等。另外,在系统进化分析中发现,金花茶CnMYB4蛋白与近缘物种油茶MYB308-like、茶树CsMYB4a蛋白的相似性较高,相似度达到了99.17%。一般而言,MYB4蛋白的C端保守性相对较差,但在同源序列比对中,发现CnMYB4、CsMYB4a、AtMYB4、VvMYB4等蛋白,除了具有保守的N端的序列结构,它们的C端序列结构也比较类似,都含有C1、C2、Zf、C4等基序(motif),其中C1基序是一个激活性的功能域,C2和C4基序是起抑制作用的功能域,而Zf基序的功能仍未研究清楚;研究发现具有C1、C2、Zf、C4基序的AtMYB4转录因子在植物中主要发挥抑制作用[28],且它与CnMYB4的序列相似性较高,综合序列同源比对和进化分析结果,推断CnMYB4转录因子在金花茶中具有负调控作用。
根据MYB结构域的差异,部分植物的MYB4转录因子被划分在R2R3-MYB转录因子的SG4亚组中。近年来,在植物次生代谢物合成机制的转录组研究中,发现部分植物的MYB4转录因子可能具有调控类黄酮合成的功能,例如,在桃儿七(Sinopodophyllumhexandrum)[33]、茶树[34]、桑葚(Morusalba)[35]等植物中发现MYB4转录因子位于预测的调控网络中心,并且在作用部位具有高表达量。本研究中CnMYB4转录因子的表达具有组织特异性,它在盛开的花中表达量较高,而在根、茎、叶等组织中表达量相对较低;另外,还发现CnMYB4转录因子在开花过程的花瓣中也具有较高的表达量,因此,推测CnMYB4转录因子主要在花中发挥作用。目前,越来越多MYB4转录因子的功能已被阐明,例如,荷花(Nelumbonucifera)NnMYB4具有负调控木质素合成的功能[36];茶树CsMYB4a具有降低启动子活性,进而负调节苯丙烷合成的功能[24]。茶树与金花茶同为山茶科山茶属植物,它们的亲缘关系密切,并且CnMYB4蛋白与CsMYB4a蛋白的相似性非常高,这两种植物的MYB4转录因子可能具有相同功能,CnMYB4转录因子可能通过调节金花茶中苯丙烷物质的合成,进而调节类黄酮物质含量的积累,从而影响金花茶花色的形成,但该转录因子的具体功能仍有待进一步阐明。
4 结论
CnMYB4转录因子具有MYB基因家族的保守结构域(Myb_DNA-binding、SANT),在C端具有C1、C2、Zf、C4等保守基序,与在类黄酮途径中发挥作用的茶树CsMYB4a蛋白的亲缘关系较近,但是与CsMYB4a不同的是,茶树基因研究大多以茶树叶片为基础进行研究,而在研究中发现CnMYB4主要在金花茶盛开花朵中高表达,且在金花茶开放过程中,CnMYB4的表达量呈先高后低的下降趋势,这在茶树的研究中是没有发现的。因此,推断CnMYB4主要在金花茶的花中发挥作用,且在金花茶开花过程中主要通过负向调控的作用来调节类黄酮物质的合成,从而调控金花茶花色的形成,这也为后续进一步分子机制研究打下基础,为金茶花分子育种提供候选基因。

