开腹与腹腔镜肝切除治疗肝癌合并微血管侵犯病人的近期疗效比较
朱明强,裴俊鹏,熊祥云,杨大帅,沈杰,丁佑铭
武汉大学人民医院肝胆外科,湖北 武汉 430060
肝癌约有80%为肝细胞癌,与慢性病毒性肝炎感染、暴露于酒精或黄曲霉毒素等因素密切相关[1-2]。原发性肝癌治疗方法多样,但根治性外科手术切除仍是最常见和最有效的方式[3-4]。相比于传统的开腹肝切除(open liver resection,OLR),腹腔镜肝切除(laparoscopic liver resection,LLR)具有微创、术后疼痛减轻、出血量少和恢复时间快的优点,已成为肝脏肿块广泛接受和标准的手术选择[5]。但LLR也存在气体栓塞、术中难以有效控制出血以及不易肝门阻断等不足之处。微血管侵犯(microvascular invasion,MVI)是指在显微镜下于内皮细胞衬覆的血管腔内可见癌细胞巢团,以癌旁门静脉分支为主[6]。MVI与肝癌肝切除病人术后生存密切相关[7-8]。目前,关于LLR与OLR治疗肝癌合并MVI病人的研究鲜有报道。本研究旨在评估这两种术式对治疗肝癌合并MVI病人的短期临床疗效,以期为肝癌病人围手术期管理提供一定的参考依据。
资料与方法
一、研究对象
回顾性收集2019年12月至2023年2月,武汉大学人民医院肝胆外科行外科手术治疗的88例原发性肝癌合并MVI病人的临床资料。根据外科手术方式分为OLR组(51例)和LLR组(37例)。纳入标准:(1)符合《原发性肝癌诊疗指南(2022年版)》的相关诊断[9],且病理学检查存在MVI;(2)年龄>18岁;(3)首次行肝切除术病人;(4)肝功能Child-Pugh分级A级或B级且无远处转移。排除标准:(1)肝癌复发或合并胆管癌、肝外转移病人;(2)行二步肝切除、联合其他器官的肝癌病人;(3)资料不完整者。本研究经过武汉大学人民医院伦理委员会批准(批件号:WDRY 2023-K064),所有病人均知情并签署知情同意书。
二、手术方法
1.LLR 麻醉成功后,平卧位,常规消毒铺无菌巾。脐上戳孔建立气腹,以五孔法戳孔置入其余操作Trocar,维持腹压于12 mmHg(1 mmHg=0.133 kPa),调整体位为头高足低右侧高位。先探查腹腔总体情况,结合术前影像学资料决定手术方式。行肝切除时,先以超声刀分离切断部分肝胃韧带,预置第一肝门阻断带,对疑似淋巴结转移者“脉络化”肝十二指肠韧带。对于行解剖性肝切除术病人,仔细解剖分离出相应的供应血管并予以结扎切断,再利用超声刀或电刀沿肝表面缺血线做一预切除线。而对于行肿瘤挖除术者,可直接在距肿瘤边缘1~2 cm处画预切线,以超声刀、电刀由浅及深、由足侧向头侧、逐层次离断肝组织,所遇管道均夹闭后凝断,于肿瘤根部以切缝器离断,完整切除肝肿瘤。记录肝门阻断次数和时间。检查创面无活动出血及胆漏,以标本袋取出肝脏标本。肝脏创面放置止血材料,肝断面常规放置负压引流管,引流管自腹壁戳孔引出并固定。腹腔内注入洛铂60 mg行恶性肿瘤特殊治疗。清点器械敷料无误,逐层缝合腹壁切口及脐上穿刺,切口加压包扎。
2.OLR 麻醉方式与体位同LLR组。上腹部剑突至右肋缘下反“L”形斜切口,逐层切开入腹,入腹后先探查。超声刀离断肝周围韧带,仔细解剖游离肝肿物表面粘连,显露肿块周围正常肝组织。解剖第一肝门,预置第一肝门阻断带。距离肿块周围1~2 cm利用电刀做一预切除线,钳夹法逐步沿预切线由浅及深、由脏面向膈面、由足侧向头侧逐层次离断肝组织,所遇出血均用双极电凝、缝扎止血。切缝器离断肿块肝段血管蒂后完整切除肿瘤。根据出血情况判断是否采取肝门阻断,同时记录阻断次数和时间。灭菌注射用水冲洗腹腔并吸尽,再次检查肝创面无明显活动出血及漏胆。创面喷洒生物胶并覆盖止血材料。常规放置负压引流管,经皮肤戳孔固定。洛铂60 mg行腹腔恶性肿瘤灌注化疗。清点器械、敷料无误,逐层关腹。
三、相关指标的收集
(1)术前基础资料:年龄、性别、体重指数(body mass index,BMI)、乙型肝炎、肝硬化、腹部手术史、年龄校正查尔森合并症指数(age-adjusted Charlson comorbidity index,aCCI)、美国麻醉医师协会(ASA)评分、肿瘤数目、分化程度、肿瘤最大径、Child-Pugh评分、中国肝癌分期(China liver cancer staging,CNLC)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、血清白蛋白、总胆红素(TBIL)、乳酸脱氢酶(LDH)、甲胎蛋白、吲哚菁绿15 min滞留率(indocyanine green retention rate at 15 min,ICG-R15)、凝血酶原时间(PT)、血红蛋白、血小板计数、血肌酐、总胆固醇、血清K+、血清Na+。(2)手术相关指标:术中平均动脉压、手术部位、肝段切除范围、解剖性肝切除、切缘性质、手术时间、术中出血量、肝门阻断时间、是否输血。(3)术后1周肝功能指标:ALT、AST、TBIL、白蛋白-胆红素(albumin-bilirubin,ALBI)评分、终末期肝病模型(model for end-stage liver disease,MELD)评分。(4)术后应激反应指标:白细胞计数、中性粒细胞计数、淋巴细胞计数、中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、控制营养状态(controlling nutritional status,CONUT)评分。(5)术后恢复情况:胃肠道恢复时间、引流管放置时间、总住院时间、并发症发生情况。
四、统计学方法
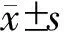
结 果
一、两组基础资料比较
OLR组和LLR组的肿瘤最大径、血清白蛋白水平差异有统计学意义(P<0.05),但在年龄、性别、BMI、乙型肝炎、肝硬化、腹部手术史、aCCI、ASA评分、肿瘤数目、分化程度、Child-Pugh评分、CNLC、ALT、AST、TBIL、LDH、甲胎蛋白、ICG-R15、PT、血红蛋白、血小板计数、血肌酐、总胆固醇、血清K+、血清Na+等方面差异均无统计学意义(均P>0.05),见表1。
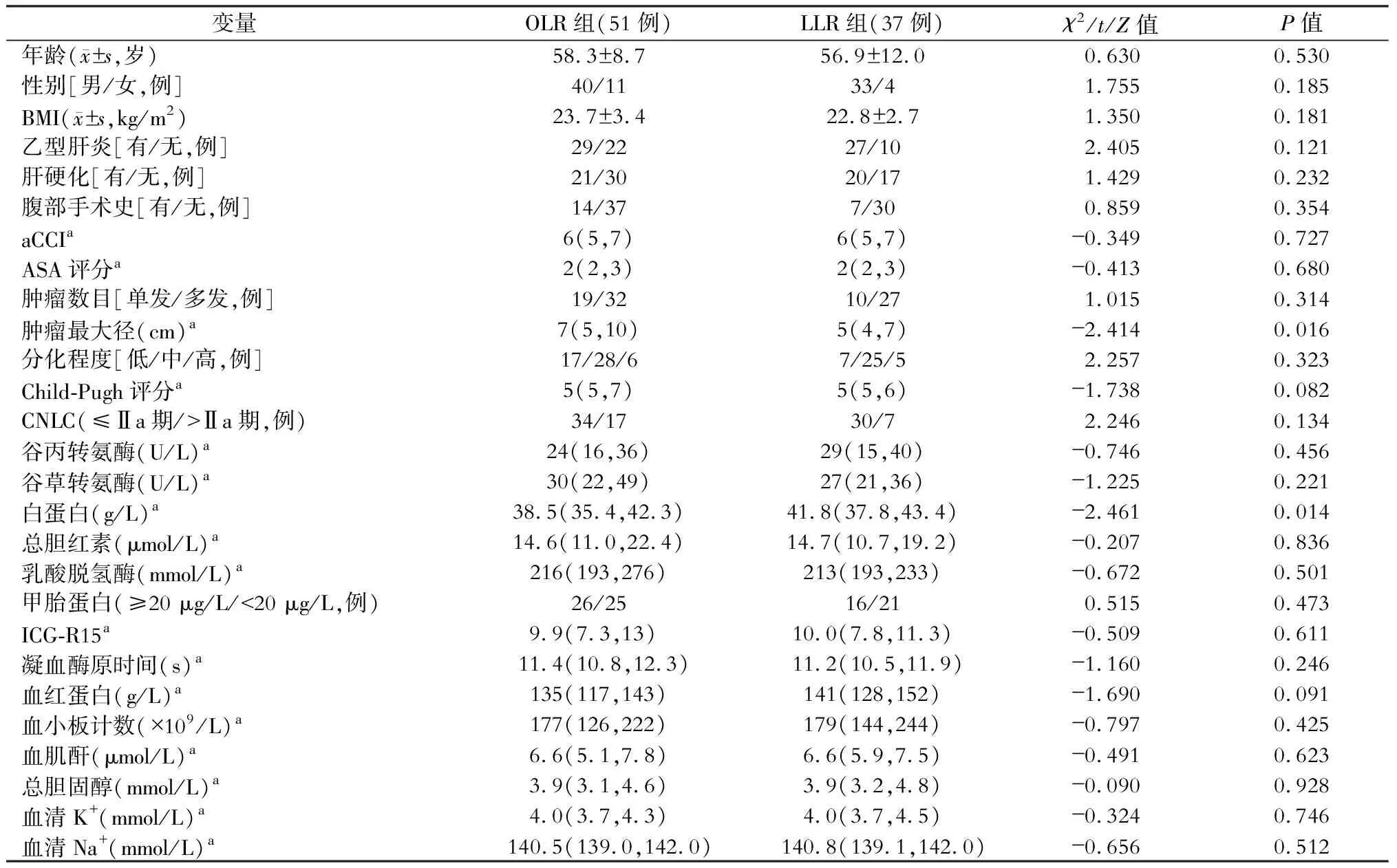
表1 开腹肝切除(OLR)与腹腔镜肝切除(LLR)的原发性肝癌合并微血管侵犯病人基础资料比较
二、手术指标的比较
两组在术中平均动脉压、术中出血量的差异有统计学意义(P<0.05),OLR组手术部位、肝段切除范围、是否解剖性肝切除、切缘性质、手术时间、术中出血量、肝门阻断时间、是否输血等与LLR组相比,差异均无统计学意义(均P>0.05),见表2。
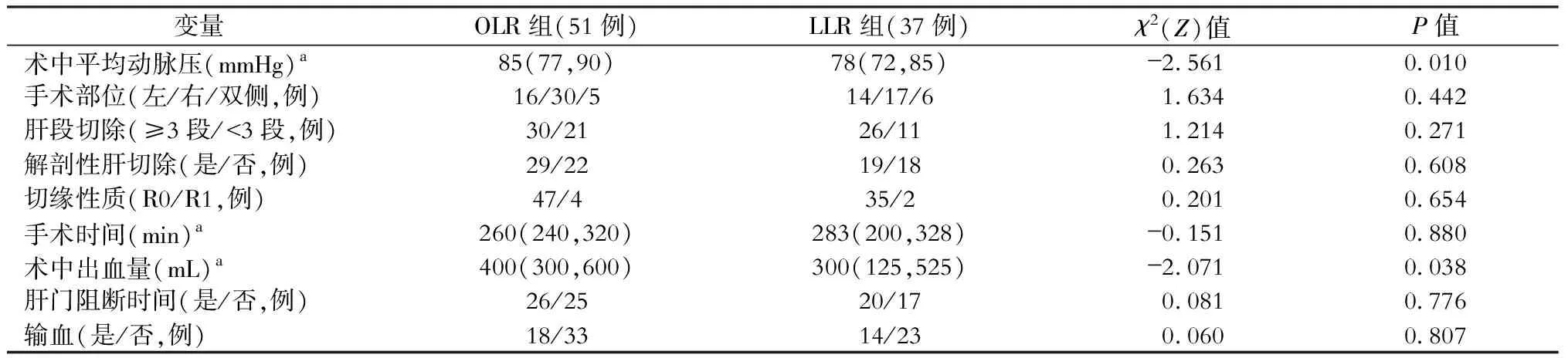
表2 开腹肝切除(OLR)与腹腔镜肝切除(LLR)的原发性肝癌合并微血管侵犯病人手术指标比较
三、术后应激反应的比较
术后白细胞计数、中性粒细胞计数、淋巴细胞计数、NLR、CONUT评分等指标在OLR组和LLR组间差异均无统计学意义(均P>0.05),见表3。
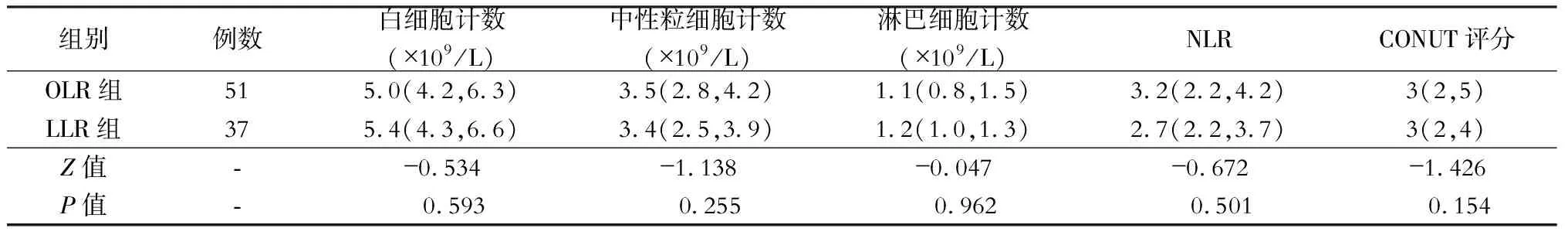
表3 开腹肝切除(OLR)与腹腔镜肝切除(LLR)的原发性肝癌合并微血管侵犯病人术后应激反应指标比较[M(Q1,Q3)]
四、术后肝功能的比较
术后ALT、AST、TBIL、MELD评分在OLR组和LLR组间差异均无统计学意义(均P>0.05),而ALBI评分两组间差异有统计学意义(P<0.05),见表4。
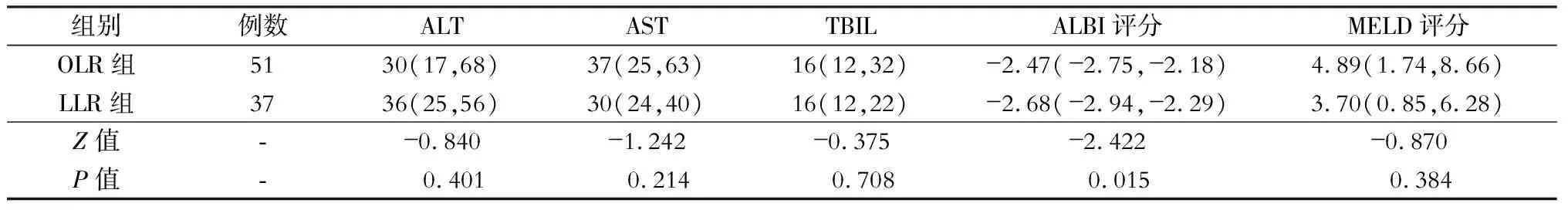
表4 开腹肝切除(OLR)与腹腔镜肝切除(LLR)的原发性肝癌合并微血管侵犯病人术后肝功能的比较[M(Q1,Q3)]
五、术后恢复情况的比较
LLR组病人胃肠道恢复时间、引流管放置时间和术后总住院时间明显短于OLR组(均P<0.05)。LLR组术后出现3例并发症:肝衰竭1例,术后出血1例,肺部感染1例;OLR组病人术后出现13例并发症:肝衰竭3例,肺部感染3例,腹腔感染2例,胆管炎2例,胆漏1例,切口感染1例,术后出血1例。在总并发症发生率方面,LLR组(8.1%)优于OLR组(25.5%),两组间差异有统计学意义(P<0.05)。结果详见表5。两组病人术后30 d内均未见死亡。
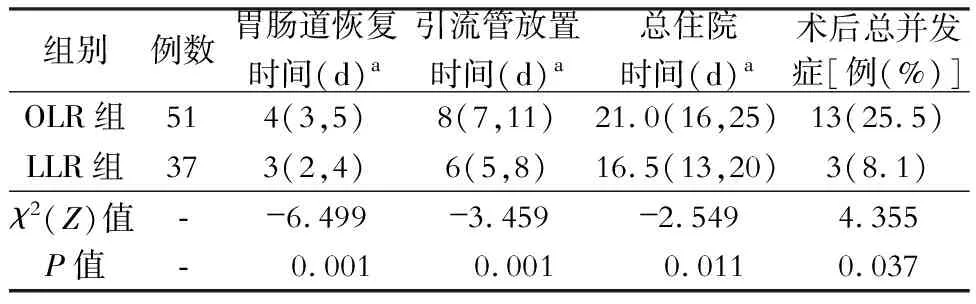
表5 开腹肝切除(OLR)与腹腔镜肝切除(LLR)的原发性肝癌合并微血管侵犯病人术后恢复情况比较
讨 论
肝癌与病毒性肝炎、慢性酒精中毒、胆汁淤积、寄生虫感染、药物与化学毒物和遗传代谢性疾病等因素密切相关[10-11]。外科手术切除是肝癌首选的治疗方法。OLR为传统的手术治疗方式,发展较成熟,可实现精准肝切除,但该术式存在创伤大、术后恢复慢等缺点[12-13]。
随着腹腔镜技术和腔镜器械的不断进步,LLR因其创伤小、出血量少、恢复快等优势,已在腹部外科逐渐开展[14]。但LLR因其自身的限制,在手术视野、肿瘤长径较小病变的精准定位、保证切缘阴性、淋巴结清扫操作以及器械触觉反馈不如手指灵敏以至难以判断肿瘤边缘等方面存在劣势[15-16]。因此,两种术式的疗效仍存在一定争议。MVI是原发性肝癌发生肝内外转移及术后复发的关键预后指标[17-18]。本研究比较了LLR与OLR治疗原发性肝癌合并MVI的近期效果与安全性。
LLR因腔镜操作系统灵活度不如OLR,多被认为手术难度增加,手术时间因此延长,部分既往研究给出了此结论[19]。但本研究中的LLR组手术时间与OLR组差异无统计学意义,与既往Ratti等[20]研究结果一致。本研究发现,OLR组白蛋白营养指标低于LLR组,可能与OLR组病人肝细胞损害严重及营养不良等因素所致;而在肿瘤最大径上,OLR组病人往往合并更差的形态学指标。同时,OLR因其创伤大、出血量多等应激因素的影响可导致术中平均动脉压有所升高。随着腹腔镜技术的成熟以及术者团队的良好配合,腹腔镜手术的不足得以改善。本研究中,OLR组的术中平均动脉高于LLR组,这可能与开腹手术所致的创伤应激有关。与OLR组相比,LLR组术中出血量明显更少,这与既往研究结果相符[21]。其原因可能与LLR腹部切口小、腹腔镜高清放大的术野利于血管精细操作、超声刀及时有效止血等因素有关。另外,本研究中还发现两组病人在手术部位、肝段切除范围、是否解剖性肝切除、切缘性质、肝门阻断时间、是否输血等比较,差异均无统计学意义(均P>0.05)。
当机体受到外伤和手术等外界应激时,血清中白细胞和中性粒细胞会升高。NLR是一种新的全身炎症反应标志物,而CONUT评分反映了病人的免疫营养状态,两者均与肝癌、胰腺癌等消化系统恶性肿瘤的预后密切相关[22-23]。本研究结果显示,术后白细胞计数、中性粒细胞计数、淋巴细胞计数、NLR、CONUT评分等应激指标在OLR组和LLR组间的差异均无统计学意义。在ALT、AST、TBIL、MELD评分等反映术后肝功能指标的比较上,两组之间的差异均无统计学意义。但LLR组在ALBI评分上要优于OLR组,原因可能与LLR组精细操作减轻了对残肝的损伤、切口小、恢复快以及OLR更大的肿瘤长径和更高的肿瘤分期等有关。
本研究显示,LLR组病人胃肠道恢复时间、引流管放置时间和术后总住院时间明显短于OLR组。LLR组腹壁手术切口小、组织损伤小,疼痛程度较轻,胃肠功能不良影响小,所以病人能及早进食及活动,促进了病人的恢复以及缩短了病人的住院时间。合并MVI的肝癌病人更容易发生血管和淋巴管侵袭,引起肿瘤的早期扩散和转移,影响肝癌术后并发症以及长期预后[24-25]。在并发症方面,LLR组优于OLR组,发生率分别为8.1%、25.5%,这也在一定程度上反映了LLR减少并发症方面的优越性。中国肝癌病人多伴不同程度的病毒性肝硬化,LLR微创有利于术后肝功能的恢复,减少术后肝功能不全等并发症的发生[26]。此研究中,OLR组和LLR组病人术后30 d内均未见死亡。
本研究也存在一定的局限性:首先,该研究属于单中心回顾性研究,尚未开展外部验证,证据效力较弱。笔者希望未来能进行多中心、大样本随机对照试验予以外部验证。其次,尚缺乏OLR与LLR治疗肝癌合并MVI病人中远期疗效比较的探索。综上所述,与OLR相比,LLR治疗肝癌合并MVI的病人在短期疗效上具有优势,是一种值得选择的治疗肝癌合并MVI病人的手术方式,但其中远期效果还需多中心、大样本随机对照试验予以外部验证。
利益冲突所有作者均声明不存在利益冲突

