后循环颅内动脉粥样硬化狭窄急性闭塞血管内治疗的疗效分析
余丹枫
缺血性卒中已成为我国致残致死率最高的疾病[1]。急性后循环大血管闭塞(posterior circulation emergent large vessel occlusion,pc-ELVO)虽然总体发病率不高,但患者病情较危重,病死率可达80%。虽然目前国内外指南并未给予pc-ELVO 血管内治疗最高等级的推荐[2],但目前越来越多的研究证实后循环急性大血管闭塞血管内治疗的有效性[3]。我国颅内动脉粥样硬化狭窄(intracranial atherosclerosis stenosis,ICAS)发病率33%~50%[4],是pc-ELVO 主要病因之一。而由于ICAS病变的特点,约30%患者单纯支架取栓并不能实现闭塞血管成功再通,需要进一步行球囊扩张血管成形术或补救性支架置入术[5],手术难度较高,风险较大,是目前血管内治疗的热点和难点之一。本研究探讨ICAS致pc-ELVO 血管内治疗的效果。
1 资料与方法
1.1 临床资料 收集2018 年1 月至2021 年12 月金华市中心医院pc-ELVO 行血管内治疗患者87 例。纳入标准:①急性缺血性卒中的诊断符合《中国急性缺血性脑卒中诊治指南2018》标准,术中DSA 证实为责任血管ICAS 所致大血管闭塞病变;②入院时美国国立卫生研究院卒中量表(NIHSS)评分≥6 分;③发病前改良Rankin 量表(mRS)评分<2 分;④患者及其家属对手术方案及治疗风险知情并签署知情同意书。排除标准:①头部CT 或MR 检查显示为颅内出血或大面积脑梗死;②存在严重对比剂过敏、主动脉夹层形成等血管内治疗禁忌证;③合并心、肾、肝等重要脏器功能衰竭。分为ICAS 组28 例,非ICAS 组59 例。采集患者入院时基线特征(性别、年龄)、高危因素(包括高血压、高脂血症、糖尿病、吸烟史、冠心病病史)、入院NIHSS 评分、侧支代偿等级、血管再通时间、手术时间、术中是否行血管成形(球囊扩张或支架置入)、术后改良脑梗死溶栓血流分级(mTICI)、术后90 d mRS评分、术后颅内出血、术后严重脑梗死、死亡率等临床资料并进行比较。
1.2 手术方法 所有患者均为全身麻醉,采用Seldinger 技术行股动脉穿刺,置入8F 动脉鞘,行全脑血管造影,评估侧支循环代偿情况(0 级缺血区无侧支循环形成;I 级缺血区周边可见缓慢的侧支循环灌注,但仍可见充盈缺损区;II 级缺血区周边可见快速的侧支循环充盈,缺血区部分血流灌注;III 级静脉晚期可见缺血区有缓慢但完全的侧支循环血液充盈;IV 级侧支循环快速而完全地充盈缺血区域,II 级及以上视为良好代偿)。微导管在微导丝导引下通过血管闭塞部位,到达颅内闭塞部位远端正常血管,微导管造影确认血管真腔,回撤微导管行微导管造影,判断闭塞性质、部位,血栓长度,在血栓位置使用支架或抽吸导管进行取栓操作达到血管有效再通,ICAS 组在造影确认残留重度狭窄(狭窄程度≥70%)或前向血流不能维持时,术中DYNACT 排除颅内出血,予静脉肝素化(50 U/kg,1,000 U/h追加),盐酸替罗非班静脉微泵维持,给予球囊扩张血管成形术,根据测量取合适大小Gateway 球囊进行球囊扩张(球囊大小以正常靶血管直径的60%~80%为宜,扩张速度以15~30 s 一个标准大气压),球囊充盈形态良好后维持约1 min 后缓慢释放球囊,球囊置于原位造影,评估血管扩张情况,排除夹层及出血等情况后回撤球囊。等待15~30 min 后再次造影,评估血管情况,若残余狭窄≤70%且前向血流稳定视为手术成功。如扩张效果不满意,可以重复扩张,必要时可更换其他型号球囊进行扩张,如观察后正向血流仍不能维持,行补救性支架置入术。
1.3 围术期管理 (1)影像学评估:术后于第1、3、7天复查头颅CT 评估脑梗死范围、颅内出血情况。(2)抗血小板药物或抗凝药物使用:术中排除出血后静脉微泵替罗非斑维持,如复查头颅CT 无明显颅内出血,则予口服阿司匹林100 mg+硫酸氢氯吡格雷75 mg 双联抗血小板治疗,替罗非斑重叠使用4 h 后停用或减量。同时口服他汀类药物。(3)术后神经重症监护治疗,血压维持在正常血压水平。(4)外科手术治疗:对于复查CT 提示小脑梗死后颅窝高压、颅内出血等情况,必要时行去骨瓣减压或开颅血肿清除术。
1.4 疗效评估 (1)血管再通评估:根据术后即刻mTICI 分级判断(0 级为完全闭塞,无向前血流;1 级为血流只能渗透到远端:2 级为血流通过病变的血管段使远端血管床部分显影;3 级为快速血流,远端血管床完全显影)。mTICI 0-2a 级为血管未再通,TICI 2b-3 级血管再通(2b 级为部分再通,3 级为完全再通)。(2)患者症状评估:通过术后90 d 改良Rankin 量表(modified rankin scale,mRS 评分)评估术后中期恢复状况,mRS评分0~2 分为恢复良好,3~5 分为恢复不良,6 分为死亡。(3)术中及术后严重并发症:本次主要统计术后严重脑梗死(脑干/小脑/丘脑大面积梗死)、颅内出血及死亡患者。
1.5 统计学方法 采用SPSS 19.0 统计软件。计数资料采用%表示,采用卡方或Fisher 精确检验。计量资料采用(±s)表示,采用两组独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 基线数据比较 见表1。

表1 两组患者基线临床资料
2.2 两组患者手术资料比较 见表2。

表2 两组患者手术资料
2.3 两组患者预后比较 见表3。
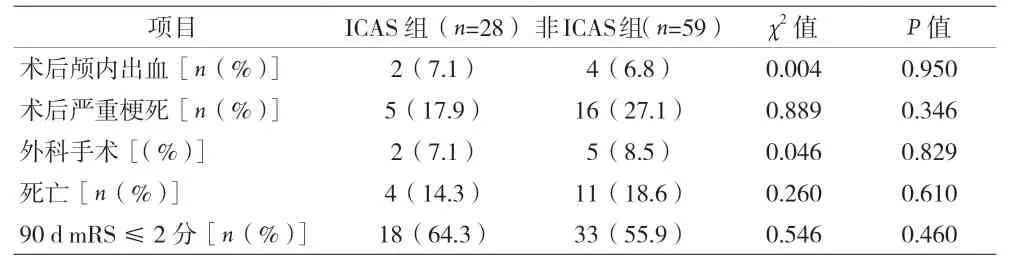
表3 两组患者预后比较
3 讨论
我国AIS 患者中ICAS 占45.3%~51.3%[6],而后循环发病率更高,可达到50%[7]。但目前对于ICAS 导致的pc-ELVO 研究较少,采用何种再通方式并没有定论。目前主流的方式是在支架取栓或抽吸取栓的基础上行血管成形术。对于栓塞性pc-ELVO 患者,抽吸取栓常能够顺利到达闭塞位置,对比支架取栓有更快的血管再通时间,操作也更为简单有效,本研究部分心源性栓塞患者通过抽吸能够获得有效且快速的血管再通。但对于ICAS 导致的pc-ELVO 患者,优先抽吸取栓在再通率上反而低于支架取栓,还会带来更高的医源性夹层发生率和后期补救率。其原因可能在于狭窄阻碍了抽吸导管的通过,负压抽吸可能导致斑块或血管内皮损伤,甚至导致夹层的发生,加速血小板聚集[8]。本研究中有3 例患者因抽吸导致夹层的发生,2 例位于基底动脉中段,1 例位于椎动脉V4 段,术中均行一期补救性支架置入。因此对比ICAS 导致的pc-ELVO 患者,优先支架取栓可能是更加合适的,因ICAS 导致的ELVO 病变常血栓负荷量较少,且新鲜血栓与支架的结合较好,支架拉栓即能够快速达成的血管再通[9]。同时支架取栓能够协助判断闭塞病变的性质,支架打开时“束腰征”提示ICAS 病变的可能较大,支架拉栓后有无严重狭窄残留有助于判断是否进一步行球囊扩张血管成形术。但如果在明确判断为ICAS 病变且拉栓效果不好时,不建议行多次支架拉栓,因多次拉栓有造成内膜损伤、斑块破损风险[10],且微导丝反复超选有形成夹层风险,反而延误再通时间。大部分ICAS 所致的ELVO 患者在血管再通后ICAS 处仍需要行球囊扩张血管成形或支架置入术,因此术中替罗非斑的使用是必要的,其可以减少术中血栓的形成,避免再闭塞,其在后循环取栓的应用中被证实是安全的[11]。
本研究中ICAS 导致的pc-ELVO 患者发病时症状相对较轻,这可能与其有着相对较好的侧支代偿有关,有研究表明侧支代偿等级是患者术后神经功能恢复的独立影响因素之一[12]。同时因良好的侧支代偿,ICAS导致的pc-ELVO 患者发病症状相对较轻,也有研究表明后循环急性卒中患者发病时的卒中严重程度是影响预后的独立预测因素[13]。本研究中ICAS 组患者血管侧支代偿更好,发病症状也较轻,术后更多的患者获得良好的神经功能恢复。
后循环的ICAS 病变多发生于椎动脉起始部、椎动脉V4 段和基底动脉中上段,在椎动脉V4 段和基底动脉中上段存在较多穿支血管,因此对于是否进行球囊扩张或支架置入需要谨慎判断。球囊扩张可能使血管内皮损伤及血管痉挛等发生致血流动力学障碍,导致局部血栓形成[14]。球囊扩张血管成形也会因“雪犁效应”导致斑块移位引起穿支血管闭塞导致脑干、小脑缺血梗死及基底动脉尖端综合征等严重并发症,而支架置入也可能导致血管痉挛、支架内血栓形成、术后高灌注等风险造成不可挽回的损伤。因此建议只有当取栓操作后仍存在持续严重狭窄的pc-ELVO 患者,尤其是存在低灌注或再闭塞风险高的患者,再考虑进行血管内成形术及支架植入治疗。本研究中ICAS 组71.4%的患者进行后续球囊扩张或支架置入血管成形术,但术后颅内出血、脑干/小脑严重梗死、死亡率并没有明显增加,表明合理的球囊扩张或支架置入血管成形术是安全的。
综上,吸烟、高血压等高危因素可能协助pc-ELVO患者的病因判断,ICAS 致pc-ELVO 良好的侧支血流代偿能够提供更多的手术时机和神经功能恢复机会,而有效的血管再通和合理的手术方式选择是血管内治疗的关键。相较于其他病因引起的pc-ELVO 患者,ICAS 致pc-ELVO 血管内治疗同样有效和安全。

