脂多糖诱导大鼠脓毒症相关心肺损伤模型的构建及评价
陈鹤翔,何 旋,吴晓静,夏中元,唐 杰
(1.武汉大学人民医院麻醉科,湖北 武汉 430060;2.咸丰县人民医院麻醉科,湖北 咸丰 445699)
脓毒症(sepsis)是机体对感染的反应失调,导致危及生命的器官功能障碍,其重点则是器官受损,而脓毒症引起的心肺靶器官损伤则是临床常见的急、危重症,发病率和死亡率皆极高[1,2]。构建模拟临床脓毒症模型对探索脓毒症及相关器官损伤的发病机制并寻求有效的预防治疗手段极其重要和关键。目前应用的盲肠结扎穿孔致脓毒症模型因手术操作及肠道菌群组成等差异而常常具有较大的变异性,腹腔注射脂多糖致脓毒症模型因其致病方式统一且可控、引起临床表现同质,以及可产生脓毒症休克等严重的病理反应[3-5],后者可有效应用于脓毒症临床前的实验研究,但关于其心肺损伤情况的具体研究却甚少。因此,本研究拟通过构建脂多糖诱导大鼠脓毒症模型,观察其心肺损伤特征,为建立可靠的脓毒症相关器官损伤模型提供参考。
1 材料与方法
1.1 实验动物 健康雄性SPF 级Sprague-Dawley 大鼠20 只,购自湖南省实验动物中心。动物合格证号:SYXK(湘)2020-0015,体重200~230 g,6~8 周龄,适应性饲养1 周。本研究已通过武汉大学人民医院实验动物福利伦理审查,编号:WDRM 动 (福)第20200820 号。
1.2 主要试剂与仪器 脂多糖(lipopolysaccharide,LPS,批号:L2880)购自Sigma Aldrich 公司,白介素1β(interleukin-1β,IL-1β,批号:ab255730)、白介素6(IL-6,批号:ab234570)、肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α,批号:ab46070)、脑钠肽(brain natriuretic peptide,BNP,批号:ab108815)及肌钙蛋白I(cardiac troponin I,cTnI,批 号:ab246529)酶联免疫吸附测定法(enzyme linked immunosorbent assay,ELISA)检测试剂盒购自Abcam公司,高迁移率族蛋白B1(high mobility group box-1,HMGB1,批号:ARG81351)ELISA 检测试剂盒购自Arigo 公司,苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒购自上海碧云天生物技术有限公司;超声诊断扫描仪购自Sonosite 公司,BX51-P 光学显微镜购自Olympus 公司。
1.3 方法
1.3.1 实验动物分组及处理 采用随机数字表法,将大鼠分为2 组(=10):对照组(C 组)和LPS 模型组(LPS 组),并行大鼠脓毒症模型的制备,实验前禁食12 h,自由饮水。将LPS 用无菌生理盐水配制成1 mg/ml LPS 溶液,LPS 组腹腔注射1 mg/ml LPS 溶液(10 mg/kg),C 组腹腔注射等容量无菌生理盐水。
1.3.2 心脏超声检测大鼠心功能 大鼠建模24 h 后使用2%戊巴比妥钠(30 mg/kg)进行腹腔内注射法麻醉。麻醉后的大鼠固定于操作台上,前胸部备皮,使用超声诊断扫描仪,将频率12 MHz 超声探头置于胸骨旁左心室长轴切面,测量左室收缩末期内径、左室舒张末期内径,M 型超声选取3 个心动周期测量取平均值,根据Teichholtz 公式计算左室射血分数(left ventricular ejection fraction,LVEF),并观察大鼠心肌收缩力及室壁运动幅度情况。
1.3.3 大鼠血清及心肺组织标本收集 心超检测结束后立即打开大鼠胸腔,使用采血针左心室釆血3 ml,加入干燥试管,4 ℃下3000 g(离心半径7.7 cm)离心15 min 后,取上清液,-80 ℃保存待用。同时,取大鼠心脏放入4 ℃生理盐水漂洗,沿左心室最大横径冠状切面取左心室心肌组织,置入40 g/L 多聚甲醛溶液中固定12 h 用于HE 染色。最后充分的暴露肺组织,完整取下整个肺脏组织备检测余下指标。
1.3.4 ELISA 检测相关炎症因子及心肌损伤指标 采用 ELISA 测定血清中 IL -1β、IL -6、TNF -α、HMGB1、BNP 及cTnI 的含量,严格按照试剂盒步骤进行操作。于96 孔板上标注相应空白孔、标准品孔和待测孔区域。空白孔先留置,50 μl 的标准品依不同浓度各加入相应标准品孔,40 μl 的稀释液和10 μl 的待测样本加入待测孔。之后在待测孔和标准品孔中加入辣根过氧化物酶标记的检测抗体100 μl,空白孔则不加,并将反应孔用封板膜封住,进行60 min 恒温温箱温育,结束后弃去液体,并于滤纸上拍干。随后将洗涤液加满孔中,1 min 静置后甩去并继续拍干,前后如此洗板5 次。最后将底物3,3’,5,5’-四甲基联苯胺工作液加入所有孔中,行15 min 37 ℃避光培育后将50 μl 硫酸终止液加入所有孔,并于15 min 的时间内在波长450 nm 处进行所有孔的光密度值测量。行标准曲线的绘制,3个复孔取平均值,计算血清样本中待测样本含量。
1.3.5 HE 染色观察心肌组织病理学变化 心肌组织标本固定后行脱水、透明、包埋处理,使用时切片。在心肌组织标本染色之前先使用二甲苯对切片进行脱蜡,随后入浓度由高到低乙醇以及蒸馏水。使用苏木精对切片进行数分钟的染色,并于酸水及氨水中各数秒钟进行分色处理。使用流水对切片进行1 h 冲洗并放入蒸馏水片刻,之后使用70%和90%乙醇对切片进行10 min 脱水,并使用伊红对切片进行数分钟的染色。切片经染色后使用无水乙醇脱水,并再次使用二甲苯透明处理。使用树胶滴于切片上,盖玻片进行封固,即可于光学显微镜下观察心肌组织病理形态变化。
1.3.6 肺损伤检测 留取左肺组织固定于4%多聚甲醛中进行病理学观察并行Smith 评分[6]。固定后对肺组织进行脱水、透明,石蜡包埋、切片,后行HE 染色,光学显微镜下观察两组大鼠肺组织病理学改变,并请两位病理科医师进行读片,对病理切片显示的肺组织损伤程度进行评分。评分根据肺水肿、肺泡及间质炎症、肺泡及间质出血、肺不张和透明膜形成的程度分别按各项严重程度行0~4 分的评定,无改变亦或非常轻微改变为0 分,轻度、中度、重度、极重度改变依次为1、2、3、4 分,各项评分之和即评定为肺损伤评分。
1.3.7 肺组织湿干比检测 取右肺组织,用滤纸将肺表面的水分吸干,并使用电子称快速称量其重量,此重量为大鼠肺组织湿重(W),然后置于80 ℃电热恒温干燥箱中烤72 h 至恒重后称其重量,此重量为大鼠肺组织干重(D),大鼠肺组织湿重值/大鼠肺组织干重值,即为大鼠肺组织湿干比(wet/dry,W/D)。通过计算W/D 来测量含水量,以评估肺组织的水肿程度。
1.4 统计学方法 采用SPSS 19.0 软件进行数据统计和分析,计量资料以()表示,组间比较采用独立样本检验,<0.05 表示差异有统计学意义。
2 结果
2.1 LPS 诱导大鼠脓毒症造模成功及血清中相关炎症因子水平 LPS 腹腔注药数小时后,大鼠逐渐开始表现有精神萎靡、呼吸短促,对刺激反应减弱等,12 h 后甚至有大鼠发生死亡,大鼠脓毒症模型制备成功,造模24 h 内LPS 组大鼠死亡4 只,存活大鼠纳入统计。与C 组大鼠比较,LPS 组大鼠血清中IL-1β、IL-6、TNF-α 及HMGB1 等相关炎症因子水平升高,差异有统计学意义(<0.05),见表1。
表1 两组大鼠存活率及血清中相关炎症因子含量的比较(±,pg/ml)
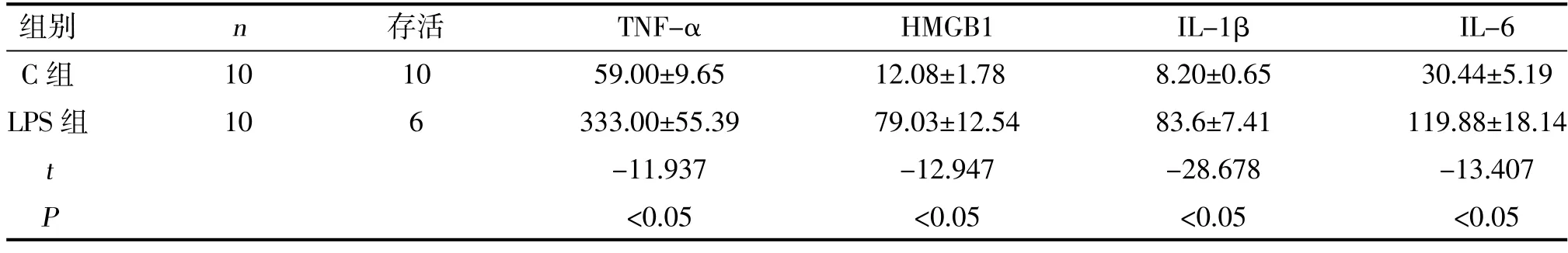
表1 两组大鼠存活率及血清中相关炎症因子含量的比较(±,pg/ml)
2.2 大鼠心功能及心肺损伤情况 造模24 h 后行心脏超声检查显示,LPS 组大鼠心肌收缩力和室壁运动幅度出现减弱,LVEF 较对照组降低(<0.05)。LPS 组大鼠血清中BNP 及cTnI 等心肌损伤指标水平升高,肺损伤评分及肺组织W/D 升高,差异有统计学意义(<0.05),见表2。
表2 两组大鼠心功能及心肺损伤情况的比较()

表2 两组大鼠心功能及心肺损伤情况的比较()
2.3 光镜下观察心肺组织病理学改变 C 组大鼠肺泡结构完整,支气管腔及肺泡腔内无明显病理改变,见图1A。LPS 模型组大鼠肺组织结构完整性消失,肺泡及肺间质大量出血,组织水肿,炎症细胞大量浸润(中性粒细胞为主),肺泡间隔增厚,见图1B。C 组大鼠心肌纤维形态结构无异常,核居中,横纹清楚,心肌细胞无明显水肿、变性及坏死,未见炎性细胞浸润,见图1C。L 组大鼠心肌纤维排列欠规整,心肌细胞明显水肿、部分心肌细胞核消失、炎性细胞浸润,变性坏死明显、红细胞渗出多,心肌损伤严重,见图1D。

图1 两组大鼠心肺组织病理形态变化(HE 染色,×200)
3 讨论
脓毒症和脓毒症休克每年可威胁全球数百万人的生命健康,其死亡率高达30%,心肺脏器是脓毒症介导脏器损伤的常见靶器官,其损伤是脓毒症不良预后的重要标志[7]。目前脓毒症建模并无统一标准,其伴随器官损伤模型也无明确评定标准,故探索构建并评价一种脓毒症及其伴随重要脏器损伤模型具有重要意义。研究显示[8],单次腹腔注射LPS 可用于有效制备大鼠脓毒症相关重要脏器损伤模型,LPS 20 mg/kg 腹腔注射5~12 h 后即可开始观察到肝脏、胃肠道及心肌等重要脏器损伤,为更明确的观察心肺组织损伤情况并降低模型死亡率,经过相关预实验后本研究采用了腹腔注射LPS 10 mg/kg 制备大鼠脓毒症模型以用于24 h 后观察心肺组织损伤情况。
本研究通过大鼠腹腔注射LPS,发现大鼠随时间进展明显有精神萎顿、对刺激反应减弱及呼吸短促等症状,且逐渐加重并于24 h 内有一定死亡率,这些临床快速筛查脓毒症患者指标[1,2]可初步证实大鼠脓毒症模型成立。同时,在注射24 h 后存活大鼠心肌收缩力及室壁运动幅度明显减退,伴有LVEF 降低;血清中TNF-α、IL-6、IL-1β、HMGB1 及cTnI、BNP 含量显著增加,且病理形态结果显示心肌组织纤维水肿、细胞变性坏死、线粒体空泡破裂、伴有增加的炎性细胞浸润等,肺组织肺泡壁显著增厚、间质性肺水肿、大量炎性细胞浸润,且肺损伤评分及W/D 明显升高。表明LPS 诱导大鼠脓毒症及心肺组织损伤模型制备成功。
LPS 作为革兰氏阴性细菌细胞壁的关键性组成成分,注射LPS 诱导脓毒症模型,可产生特定的内毒素中毒模式,并可在短时间内诱发大量炎性细胞因子如TNF-α、IL-6、IL-1β、HMGB1 等的释放,引发机体强烈的炎症反应。本研究结果显示,与C组大鼠比较,LPS 组大鼠无论血标本亦或心肺组织标本中相关炎症因子皆明显增多,证实机体发生了强烈的炎症反应,有效复刻了脓毒症模型。这种非多种微生物感染脓毒症模型虽并不能完全模拟脓毒症病理生理变化,但其致病方式统一且可控,相关炎症因子检测明确,使其具有一定的同质性,避免了盲肠结扎穿孔脓毒症模型因宿主对感染反应不同而产生的较大变异性[9,10]。同时,在该条件下,LPS 还可通过激活核转录因子κB 及丝裂原活化蛋白激酶等信号通路增加下游多种炎症介质的释放,并可致机体强氧化应激状态引起线粒体功能及能量代谢障碍等,进而在多种相关病理生理机制下造成急性肺损伤和心肌损伤等重要脏器功能障碍[11,12]。研究也证实[13-15],这些炎症因子水平的高低与心肺损伤的程度直接相关。
临床中关于脓毒症心肌损伤的大量研究是通过超声心动图进行[16,17],而cTnI 由于其高特异性和敏感性则被用于定义心肌损伤[18]。另有研究显示[19],在心肌损伤时BNP 升高变化可能更早于cTnI,可作为各种因素致心肌损伤早期诊断发现的一个较为敏感指标。Smith 评分作为半定量评分系统可有效的对损伤肺组织病理形态进行评分,而W/D 则可直接评定肺组织的水肿程度[6,20]。因此,本研究检测了以上相关指标,发现LPS 组大鼠心肌损伤标志物、心功能等明显病变及肺损伤评分、W/D 等明显升高,表明LPS 诱导脓毒症后心肺损伤严重,并可充分提供脓毒症心肺损伤模型的相关评定指标。
综上所述,通过腹腔注射脂多糖可成功诱导大鼠脓毒症并构建其相关心肺损伤模型,且该方法建立的脓毒症及心肺组织损伤模型稳定、可靠,可为探讨脓毒症及心肺组织损伤的病理机制及预防保护措施提供模型基础。

