吴茱萸碱脂质体的制备工艺研究
黄秋妹,阙慧卿,李 唯,钱丽萍,刘经亮
(1.广东食品药品职业学院,广东 广州 510520;2.福建省医学科学研究院药物所福建省医学测试重点实验室,福建 福州 350001)
吴茱萸Evodia rutaecarpa(Juss.)为芸香科吴茱萸属植物吴茱萸、疏毛吴茱萸或石虎的干燥近成熟果实[1]。吴茱萸碱(Evodiamine,EVO)又名吴茱萸胺,是从中药吴茱萸果实中提取分离出的一种色胺吲哚类生物碱,为吴茱萸的主要活性物质之一[2]。现代医学研究表明[3-6],EVO 具有抗肿瘤、降血脂、降血糖等多种药理活性,具有极高的药用价值。EVO 为脂溶性药物,几乎不溶于水,因其在水中的溶解性差影响其生物利用度及其应用。据文献报道[7-9],脂质体、纳米化、固体分散体等能够增加难溶性药物的溶解度以提高其体内生物利用度。脂质体(Liposomes,LP)是一种具有脂质双分子层包封成的微小囊状载体制剂,可将水溶性药物或者脂溶性药物分别包裹于亲水性头部形成的囊泡或双分子层膜中,在体内具有很好的生物相容性。脂质体因具有增加药物的溶解度、提高包封药物稳定性、提高药物生物利用度等优势而成为药物研究热点[9-11]。为了提高EVO 的溶解度及其生物利用度,本研究将EVO制备成脂质体,主要考察EVO 脂质体的制备工艺及含量测定方法,旨在为EVO 新制剂的开发提供研究基础。
1 仪器与试剂
1.1 仪器 RE-2000B 旋转蒸发仪(上海亚荣生化仪器厂);SARMT-N 水纯化系统(上海康雷分析仪器有限公司);ML204T/02 分析天平[梅特勒-托利多仪器(上海)有限公司];LC-20A 高效液相色谱仪(日本岛津);LGJ-18 冷冻干燥机(北京松源华兴科技发展有限公司),PALS 高分辨Zeta 电位及粒度分析仪(美国布鲁克海文)。
1.2 试剂 EVO 对照品(纯度≥98%,北京索莱宝科技有限公司,批号:01222B025),EVO(纯度98%,南通飞宇科技有限公司),胆固醇(北京索莱宝科技有限公司),大豆卵磷脂(生工生物工程上海股份有限公司),甲醇、乙腈(HPLC 级,国药集团化学试剂有限公司),四氢呋喃,冰醋酸等试剂为分析纯,新制超纯水。
2 方法与结果
2.1 EVO 脂质体制备方法 采用薄膜分散法制备脂质体[12-14]。分别精密称取基质(大豆卵磷脂、胆固醇、VitaE)与计算量EVO,溶于10 ml 氯仿溶液,搅拌使其完全溶解,转移至旋转蒸发仪中,45 ℃水浴条件下,常压旋蒸30 min,缓慢减压至0.07 MPa,待有机溶剂全部蒸出,继续旋蒸1 h,使脂质材料均匀成膜(油相);量取适量超纯水,参考文献用量加入适量丙三醇(1%)和泊洛沙姆188(0.2%),所得溶液置于40℃水浴中充分溶解、混匀,制备水相。将水相溶液加入油相,40 ℃水浴振荡充分水化,使薄膜充分溶胀、脱落形成脂质体混悬液,混悬液通过高压均质机进行高压乳匀,制备EVO-LP 溶液。取适量上述脂质体混悬液于冻干管中,加入冻干保护剂,置于冷冻干燥机中,冷冻干燥,即得EVO 冻干脂质体,4 ℃保存,备用。
2.2 脂质体中EVO 的含量测定
2.2.1 对照品溶液的制备 精密称取EVO 对照品适量,加甲醇制成每1 ml 约含EVO0.5 mg 溶液,即得。
2.2.2 供试品溶液的制备 精密量取液体EVO-LP 0.5 ml 于容量瓶中,加入适量甲醇,超声处理(功率300 W,频率40 kHz)30 min,放冷后用甲醇定容,摇匀,0.45 μm 微孔滤膜滤过,取续滤液,即得供试品溶液。取空白辅料,按照样品溶液的制备方法制备阴性对照溶液。
2.2.3 色谱条件 参考文献方法[15,16]进行实验条件摸索,确定色谱条件为:Xtimate C18 色谱柱(150 mm×4.5 mm,5 μm),以乙腈-水-四氢呋喃-醋酸(55∶45∶0.8∶0.1)为流动相,流速为1 ml/min,柱温为室温,进样量5 μl,检测波长225 nm。对照品、供试品和阴性对照的HPLC 色谱图见图1。
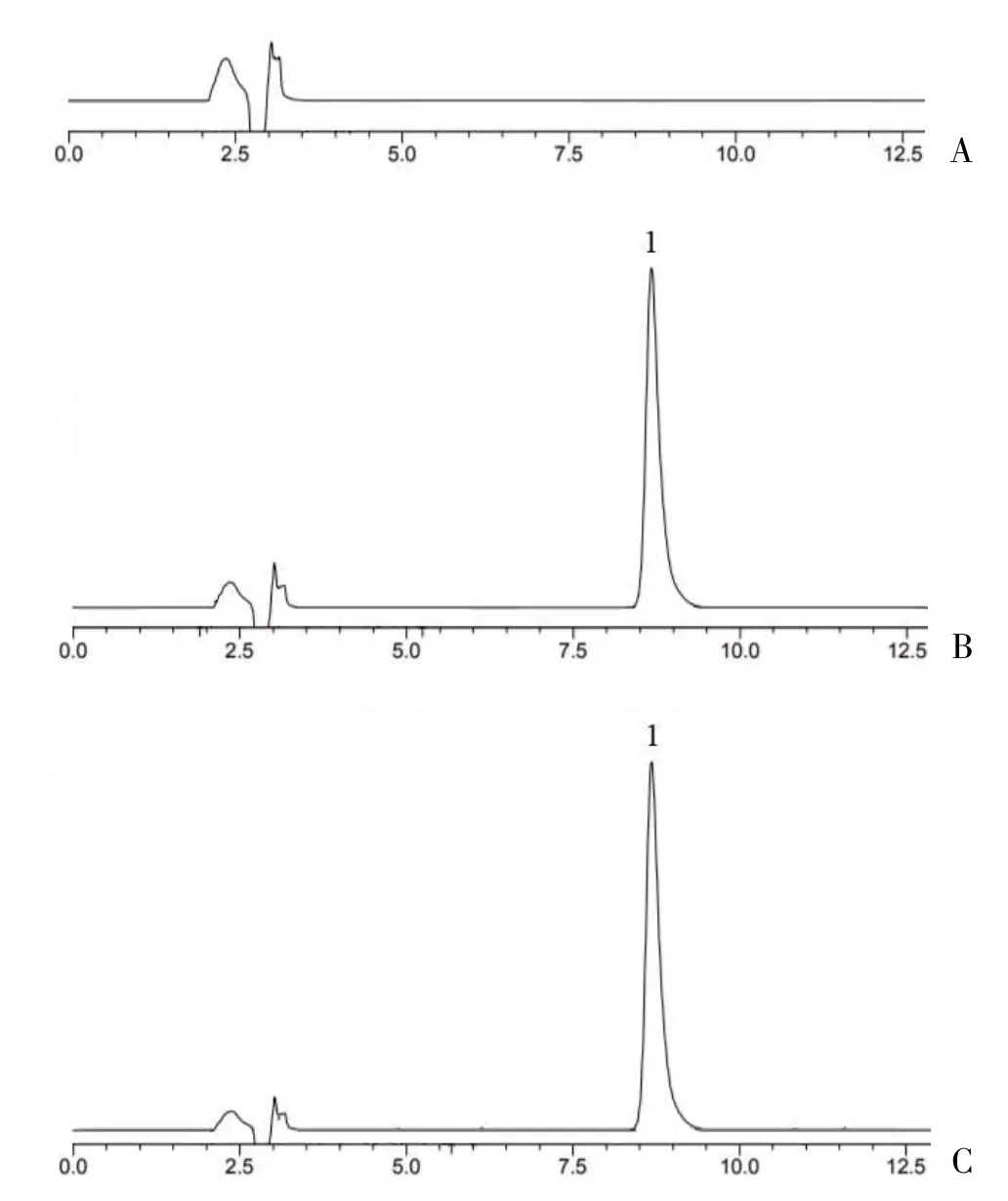
图1 对照品、供试品和阴性对照的HPLC 色谱图
2.2.4 线性关系考察精密量 取对照品溶液,逐级稀释至浓度为5.7、11.4、22.8、34.2、57.0 μg/ml 的溶液,按“2.2.3”项下的色谱柱条件进行检测,以峰面积(Y)为纵坐标,质量浓度(X)为横坐标进行线性回归,得到方程为Y=228466X-21376,r=0.9999,线性范围为28.5~285 ng。
2.2.5 精密度试验 取已知浓度的EVO 标准品溶液连续进样6 次,按照“2.2.3”项目色谱条件测定峰面积,计算RSD 为1.3%,表明仪器精密度良好。
2.2.6 重复性试验 取同一批样品按照“2.2.2”供试品溶液制备方法制备溶液,按“2.2.3”项下色谱条件进样含量测定,结果得出峰面积的RSD 为1.8%,表明该方法重复性良好。
2.2.7 稳定性试验 取同一份供试品溶液,按“2.2.3”项下色谱条件,分别于0、2、6、12、24 h 进样测定色谱峰面积,结果得出峰面积的RSD 为2.1%,表明供试品溶液的稳定性良好。
2.2.8 回收率试验 分别精密移取已知含量的EVOLP 样品6 份,分别置于10 ml 容量瓶中,分别加入相应量的EVO 对照品(0.57 mg/ml 溶液100 μl),按“2.2.2”项下的方法制备供试品溶液,按照“2.2.3”项下色谱条件进行检测,计算样品回收率为98.25%~101.2%,RSD 为2.8%。
2.3 制剂质量评价
2.3.1 包封率的测定[14,17]取适量葡聚糖G-10 充分溶胀、洗涤后,制备微型柱,分离EVO 脂质体,得到已包封的EVO 脂质体和游离EVO。采用上述含量测定方法测定W包、W游和W总,计算包封率EE(%)和载药量DL(%)。计算公式如下:
式中:W总为脂质体中EVO 的总量;W包为脂质体包封EVO 的含量;W游为游离EVO 的含量;W基质为大豆卵磷脂、胆固醇、VitaE 等基质的总质量。
2.3.2 粒径与Zeta 电位的测定 用高分辨Zeta 电位及粒度分析仪扫描,测定EVO 脂质体颗粒的平均粒径和Zeta 电位。
2.4 均匀设计优化EVO 脂质体制备工艺
2.4.1 评价指标与评分标准 从各号实验样品中,随机取冻干前脂质体样品10 ml,测量粒径(X1)和电位(X2);采用葡聚糖凝胶微柱分离未包封的EVO,测定EVO 脂质体的包封率(X3)。X1、X2和X3指标按0.25:0.25:0.5 的权重系数计算综合评分S。
2.4.2 试验设计 根据文献及单因素考察结果,确定影响EVO 脂质体的3 个因素为:磷脂浓度(A),磷胆比(B),药物浓度(C)。每个因素在5 个水平上变化(见表1),按照文献[18]均匀设计要求,选取U5(54)使用表1,2,4 列(表2)安排实验。

表1 因素水平表
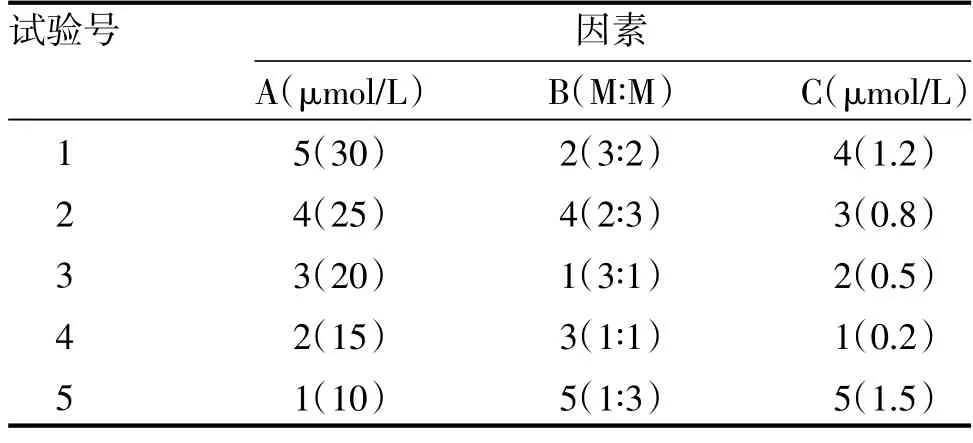
表2 U5(53)均匀实验试验因素水平表
2.4.3 实验结果与数据分析 以粒径、Zata 电位和包封率为评价指标,进行评分(表3),综合得分用SPSS 26.0 软件进行多重线性回归分析,结果发现磷脂浓度(μmol/L)对脂质体的综合评分的影响有统计学差异(=1.326,=62.907,=0.010),磷胆比(M∶M)对评分的影响没有统计学差异(=0.939=5.322,=0.118),EVO 浓度(μmol/L)对综合评分的影响有统计学差异(=-6.247,=18.611,=0.034)结果见表4。结合分析结果可得回归方程式如下:

表3 粒径、电位、包封率和评分结果

表4 分析结果
分析上述回归方程式,可以看出X1,X2两项前的系数均为正值,X3项前的系数为负值,即在考察范围内X1,X2的取值越大;X3的取值越小,Y(综合评分)越高,结合统计学结果,由于X2的变化引起的差异没有统计学意义,取中间值即可,X3应根据实际使用需要尽量降低浓度。综上,优化条件拟合为:X1=30 μmol/l,X2=1∶1,X3=0.8 μmol/l。将上述优化条件,代入回归方程式中,得预报的优化值为:
2.4.4 验证实验 按优选的工艺条件(X1=30 μmol/L,X2=1∶1,X3=0.8 μmol/L)进行试验,制备三批EVO 脂质体,并测定粒径、电位和包封率,结果见表5。其平均得分y=91.77,略高于前5 个试验号结果,与预报值基本一致,回归结果可信,所制备的脂质体均匀,稳定,最佳工艺条件可行。

表5 EVO-LP 工艺验证试验
3 讨论
纳米药物载体是指粒径在10~1000 nm 的一类新型载体,通常由天然或合成高分子材料制成。目前,药物载体系统已经被运用于多种给药途径,经临床研究发现,其不仅适用于注射,而且可以用于口服和透皮吸收系统,这体现了纳米药物载体多样化的利用途径和对于提高药物利用度的有效性、可行性[18]。EVO 为难溶性药物,本实验将其包封并通过高压乳匀技术制备成纳米脂质体,使其均匀分散于水溶液,并冻干保存,后期使用时通过加生理盐水复溶或制备滴丸等剂型,提高其生物利用度。
包封率是脂质体的关键质量属性,能反映出脂质体中药物包封程度的高低。脂质体的效用与其物理特性密切相关,粒径是脂质体的重要物理表征之一,是影响其自身转染效率、药代动力学性质、体内特异性分布等众多参数的重要指标[18]。Zeta 电位是脂质体的另一个重要指标,广泛应用于胶体系统的稳定性预测。因此选择包封率、粒径、zeta 电位为本项目的考察指标。脂质体的粒径越小,电位越大,则EVO被分散得越均匀,因此本实验评分时将粒径90 nm评为100 分,粒径每增大或减少30 nm 都减10 分;Zeta 电位以-34 mV 为100 分,每升高或者降低6 mV减10 分,按相应的权重系数计算综合评分。
本研究在前期EVO 脂质体单因素考察的基础上,采用均匀实验设计法设计并安排EVO-LP 的制备,测量每次实验制剂的综合得分(Y)与磷脂浓度(X1)、磷胆比(X2)、EVO 浓度(X3),应用SPSS 26.0统计学方法,建立多重线性回归方程,并分析和考察EVO-LP 的理化性质与磷脂浓度、磷胆比、EVO浓度等变量的关系,优选制备工艺,并通过实验得到脂质体的粒径为89.61,Zeta 电位-30.56 mV,包封率86.60%,验证该制备工艺稳定可行,为EVO 的新制剂研究提供参考。

