抗桃树细菌性穿孔病植物内生菌的筛选及其抑菌机制研究
曹鹏飞 吴华芬 陈银华

摘要:桃树细菌性穿孔病发生普遍,严重制约了桃产业的发展。为研究植物内生菌对桃树细菌性穿孔病病原菌的抑制作用,从健康桃树、博落回、金银花、板栗等健康植物材料中分离筛选出优势拮抗内生菌株,并测定其胞外代谢产物对病原菌细胞膜与细胞壁通透性、纤维素酶活性、胞外多糖(EPS)含量、呼吸代谢、核酸含量的影响。结果表明,分离得到的45株内生菌中,从金银花植株中分离的曲霉属JYY-3菌株抑菌效果最好,其最小抑菌浓度(MIC)、最低杀菌浓度(MBC)分别为50、200 mg/mL。经该菌株胞外代谢产物处理后,桃树细菌穿孔病病原菌核酸泄漏量、AKP活性和电导率显著提高,且浓度越高效果越明显。此外,JYY-3菌株胞外代谢产物能显著降低病原菌纤维素酶活性、EPS含量、DNA和RNA含量,抑制其琥珀酸脱氢酶(SDH)、苹果酸脱氢酶(MDH)活性,且浓度越高作用越强,经2.0MIC 菌株JYY-3代谢产物处理12 h后,桃树细菌穿孔病病原菌的SDH、MDH活性较对照组分别降低107.644、13.729 U/mg。可见,金银花内生菌株JYY-3对桃树细菌性穿孔病病原菌有显著的抑制作用,可通过抑制纤维素酶活性及EPS合成以减弱病原菌入侵植物能力,增大细胞壁和细胞膜通透性使内容物外泄,抑制核酸合成以及呼吸酶活性等途径抑制病原菌的繁殖。本研究结果为植物内生菌防治桃树细菌性穿孔病的进一步研究奠定了理论基础。
关键词:桃树细菌性穿孔病;植物内生菌;抑菌活性;抑菌机制;胞外代谢产物
中图分类号:S436.621.1+9文献标志码:A文章编号:1002-1302(2023)17-0131-07
桃树细菌性穿孔病是由黄单胞杆菌属甘蓝黑腐黄单胞菌(Xanthomonas campestris pv. pruni)侵染造成的劣性病害[1]。该病害在全国各地普遍发生,发病时间多在4—5月中旬,8月为发病盛期。若该病防治不及时,常造成大量落叶,营养累积减少,花芽形成异常,最终导致树势衰落,严重制约桃产业的发展。目前针对桃树细菌性穿孔病的防治主要以传统防治和化学防治为主,常用的化学农药主要有叶枯唑可湿性粉剂、二氯异氰酸钠、波尔多液及噻菌铜等[2]。这些化学农药主要在植株发病初期使用才能达到较好的防效,但随着病害的大面积暴发,防效会明显降低。同时,随着化学农药的反复使用常造成农药残留、环境污染等一系列问题。因此,寻找低毒、高效的防治手段迫在眉睫。
植物内生菌(endophyte)是存活于健康植物组织内部、不引发宿主植物表现出明显感染症状的微生物类群,是其微生态系统的重要组成部分[3-4]。据研究表明,许多内生菌能产生抗生素、水解酶类、黄酮和生物碱等次级代谢产物,可抵抗宿主植株中致病菌引起的病害发生[5]。目前已有学者对内生菌防治果树细菌性病害做了一定的研究,如刘冰等从脐橙中分离获得1株对柑橘溃疡病防效达89.4%的内生细菌[6];崔丽红等通过拮抗活性试验从9株绞股蓝根际内生菌中筛选出3株对猕猴桃溃疡病致病菌有明显抑制效果的内生菌,经盆栽试验表明这3株菌均可降低致病菌入侵植物体内的概率[7]。近年来,虽已分离出一些拮抗作用较强的内生菌,但主要用于果树溃疡病的防治,对于桃树细菌性穿孔病防治及其机制研究少有报道。因此,本研究从健康植株中分离筛选出对桃树细菌性穿孔病有拮抗作用的菌株,并对其抑菌机制进行初步研究,旨在为桃树细菌性穿孔病提供新的防治途径,为内生菌防治桃树细菌性穿孔病提供理论支撑。
1 材料与方法
1.1 植物材料与供试菌株
1.1.1 植物材料
健康的桃树、板栗植株,采自浙江省丽水市莲都区双黄乡雨伞岗;金银花和博落回采自莲都区白云山。以上样品均于2022年3月5日采回进行内生菌的分离。
1.1.2 供试菌株
桃树穿孔病病原菌甘蓝黑腐黄单胞菌,从患病的桃树茎部分离获得。
1.2 培养基与试剂
1.2.1 培养基
试验主要培养基有牛肉膏蛋白胨培养基、PDA培养基、高氏一号培养基,分别用于植物内生细菌、真菌和放线菌的分离与培养。
1.2.2 主要试剂
试验主要试剂有碱性磷酸酶(AKP)、苹果酸脱氢酶(MDH)、琥珀酸脱氢酶(SDH)等试剂盒均购自南京建成生物工程研究所,DAPI荧光染料购自Gen-View科技有限公司。
1.3 主要仪器
试验主要仪器有荧光分光光度计(天津拓普仪器有限公司,F97)、显微镜(徕卡显微系统,DMi8)、电导率仪(上海雷磁新泾仪器有限公司)、紫外可见分光光度计(上海光谱仪器有限公司,SP-756P)等。
1.4 植物内生菌的分离与优势拮抗菌株的筛选
1.4.1 植物内生菌株的分离及其胞外代谢产物的制备
采用组织块分离法[8],将健康桃树、板栗、博落回、金银花等植物的根、茎、叶消毒后,接种于牛肉膏蛋白胨、PDA、高氏一号培养基平板上,于适宜温度培养1~7 d,每天观察各平板上的菌落形态、颜色等特征,挑取菌落形态明显不同的单菌落经纯化后于4 ℃保存。将各菌株接入相应的培养液,于适宜温度振荡培养1~5 d,4 000 r/min离心10 min,取上清于55 ℃蒸发浓缩至20 mL后冷冻干燥,配成0.2 g/mL母液,用0.22 μm的无菌过滤器过滤除菌后低温保存备用。
1.4.2 优势拮抗菌株的筛选及MIC、MBC测定
取活化24 h的桃树穿孔病病原菌甘蓝黑腐黄单胞菌于牛肉膏液体培养基培养至对数期,稀释成2×107 CFU/mL。用滤纸片法[9]测定各内生菌菌株对病原菌的抑菌圈大小,初步筛选出优势菌株。用二倍稀释法[10]将初筛菌株胞外代谢产物稀释成1.562 5~400.000 0 mg/mL,每管加入2.5 mL对数期病原菌菌悬液(浓度为107 CFU/mL),以未接菌的培养液为对照,28 ℃ 振荡培养24 h后加入配制好的 2,3,5-三苯基氯化四氮唑(TTC)染液 5 μL,2 h后观察培养液颜色的變化,以未出现颜色的最低浓度为该菌株的最小抑菌浓度(MIC)[11]。以MIC最小的菌株为优势拮抗菌株。取优势菌株无色菌悬液进行平板计数,以刚好无菌落生长的浓度为最低杀菌浓度(MBC)。
1.5 优势拮抗菌株 JYY-3的鉴定
参考《真菌鉴定手册》[12],通过观察优势拮抗菌株 JYY-3 菌落的形态、大小、颜色以及菌丝、孢子和产孢结构等显微特征,以初步鉴定其种属。
1.6 优势拮抗菌株 JYY-3抑菌机制确定
1.6.1 菌株JYY-3胞外代谢产物对病原菌生长曲线的影响
将培养好的甘蓝黑腐黄单胞菌菌悬液与菌株JYY-3胞外代谢产物等体积混合培养,使胞外代谢产物终浓度分别为0.5、1.0、2.0倍MIC,以不加胞外代谢产物为对照,28 ℃振荡培养0、1、2、4、6、8、10、14、18、24 h后进行平板菌落计数[13],以培养时间为横坐标、菌落数为纵坐标,绘制菌株 JYY-3不同浓度胞外代谢产物作用下病原菌的生长曲线。
1.6.2 菌株JYY-3胞外代谢产物对病原菌细胞膜、细胞壁的影响
取病原菌菌悬液加入胞外代谢产物,使其终浓度为分别为0.5、1.0、2.0倍MIC,振荡培养0、1/6、1/3、1/2、2/3、5/6、1、2、8 h后取菌悬液,10 000 r/min、4 ℃离心10 min,取上清液测定电导率。取培养好的病原菌菌液于4 000 r/min离心 10 min,取沉淀用1×PBS缓冲液洗涤2次后用PBS缓冲液制成2×107CFU/mL菌悬液,加入胞外代谢产物,使其终浓度分别为0.5、1.0、2.0倍MIC,振荡培养0、1、2、3、4、5、6 h后取菌悬液,离心取上清液于260 nm处测定吸光度。另外按上述方法配制混合培养液,培养 0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 h后离心取上清,按试剂盒说明书测定碱性磷酸酶的活性。
1.6.3 菌株JYY-3胞外代谢产物对病原菌致病能力的影响
取病原菌菌液加入胞外代谢产物,配制混合培养液,培养2、4、12、24 h后取菌悬液,用二硝基水杨酸(DNS)法[14]测定纤维素酶活力。取病原菌菌液加入胞外代谢产物,使其终浓度分别为 1/128MIC、1/64MIC、1/32MIC,培养0、6、12、24、48 h后取菌悬液,3 000 r/min离心10 min,取沉淀,蒸馏水洗涤3次(10 000 r/min,10 min),合并上清液,取1 mL加入4 mL无水乙醇沉淀多糖,3 000 r/min离心10 min,1 mL 蒸馏水复溶多糖,采用浓硫酸苯酚法[15]测定病原菌的胞外多糖(EPS)含量。
1.6.4 菌株JYY-3胞外代谢产物对病原菌呼吸代谢的影响
取病原菌菌悬液加入胞外代谢产物,使其终浓度分别为0.5、1.0、2.0倍MIC,振荡培养2、6、12、24 h后取菌悬液,于5 000 r/min,4 ℃条件下离心5 min,参照黄燕飞的方法[16]制备粗酶液,按试剂盒说明书测定琥珀酸脱氢酶(SDH)和苹果酸脱氢酶(MDH)的活性,其活性以1 mg蛋白所含的活力单位数表示(U/mg)。
1.6.5 菌株JYY-3胞外代谢产物对病原菌核酸合成的影响 取病原菌菌悬液加入胞外代谢产物,使其终浓度分别为0.5、1.0、2.0倍MIC,振荡培养4、12、24 h后取菌悬液稀释至600 nm下吸光度为0.5,用4′,6-二脒基-2-苯基吲哚(DAPI)染色法[17]处理病原菌,于倒置荧光显微镜下观察荧光强度;用荧光分光光度计分别于364、400 nm 下测定病原菌 DNA和RNA的荧光强度。
1.7 数据分析
试验数据均用DPS数据处理系统软件进行分析。
2 结果与分析
2.1 植物内生菌的分离与优势拮抗菌株的筛选
本试验从健康桃树、博落回、板栗和金银花中共分离出45株内生菌,其中内生细菌和内生真菌各19株,内生放线菌7株。在4种植株中,從桃树上分离得到的内生细菌和内生真菌最多,分别为6、8株,内生放线菌于板栗中未有分离获得,在其余植株中分离得也较少,总计仅7株。拮抗试验结果表明,在这45株内生菌中共有38株对桃树穿孔病病原菌甘蓝黑腐黄单胞菌有抑制效果,其中15株内生细菌,18株内生真菌,5株内生放线菌。抑制效果较好的菌株分别为分离自桃树的内生菌株TY-1和TG-6及金银花内生菌株JYY-3,其抑菌圈直径分别达9.98、10.18、20.50 mm。经TTC染色法分析可知,分别经1.562 5~400.000 0 mg/mL 内生菌株TY-1、TG-6、JYY-3 代谢产物处理后,桃树细菌穿孔病病原菌培养液颜色随胞外代谢产物浓度增大而变浅直至无色,其中JYY-3菌株处理组在 50 mg/mL 时开始出现无色,TY-1、TG-6菌株2个处理组均在400 mg/mL时才呈无色。这表明3个菌株的胞外代谢产物均能抑制桃树细菌穿孔病病原菌生长,其中JYY-3菌株MIC为50 mg/mL,TY-1与TG-6菌株MIC均为400 mg/mL。MIC越小,说明其拮抗能力越强,故金银花内生菌株JYY-3为优势拮抗内生菌。由平板菌落计数结果可知,当菌株JYY-3代谢产物终浓度≥200 mg/mL时,平板上无菌落生长,因此其MBC为200 mg/mL。
2.2 优势拮抗菌株JYY-3的鉴定
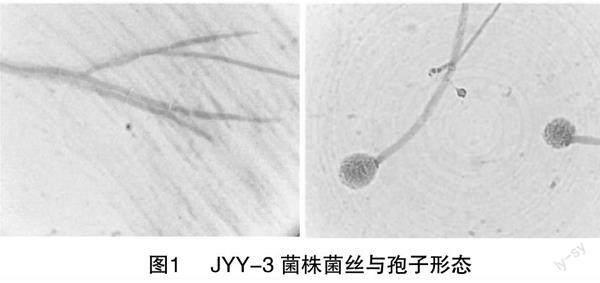
金银花内生菌株JYY-3的菌丝白色,疏松,菌落形态为圆形,向四周扩散,产绿色孢子;孢子梗光滑,呈杆状,顶端着生分生孢子团;孢子呈球形或卵状(图1),根据《真菌鉴定手册》可初步确定JYY-3菌株为曲霉属内生真菌。
2.3 优势拮抗菌株JYY-3对甘蓝黑腐黄单胞菌的抑菌机制
2.3.1 对桃树细菌穿孔病病原菌生长曲线的影响
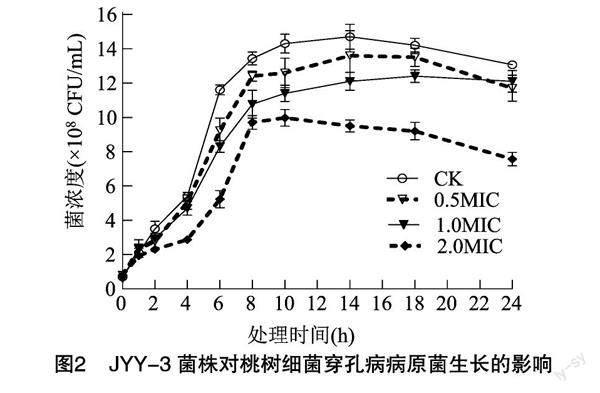
由图2可知,对照组几乎观察不到迟缓期,在4 h处即开始进入对数期,病菌大量繁殖,菌体数量迅速增加。经各浓度JYY-3菌株胞外代谢产物处理后,病原菌菌体浓度较对照组极显著下降(P<0.01),0.5MIC、1.0MIC 胞外代谢产物处理组的病原菌菌体均在4 h处进入对数期,但菌体数量增加较对照组小;2.0MIC处理组的病原菌增长最为缓慢,10 h后开始明显下降。各浓度处理组在14 h时的病原菌菌浓度与对照差异较大,分别减少10.23%、21.42%、36.36%,表明金银花内生菌株JYY-3胞外代谢产物可通过延长迟缓期或减弱穿孔病菌对数期,有效抑制菌体增长,达到抑菌效果,且浓度越大,抑制作用越明显。
2.3.2 对桃树细菌穿孔病病原菌细胞膜的影响
细胞通透性的改变会引起胞内成分如钾离子、钠离子、核酸等物质的释放[18],因此,可通过测定 JYY-3 菌株胞外代谢产物作用后穿孔病病原菌培养液电导率和核酸含量的变化来研究其对菌体细胞膜的影响。由图3可知,随处理时间的延长,对照组电导率于80 min内稳步上升,之后趋于稳定,这可能与病原菌菌体浓度的升高有一定的关系[19]。而在0~40 min内,各浓度JYY-3菌株胞外代谢产物处理组的电导率较对照组极显著上升(P<0.01),在40 min时达到最大,分别比对照组高0.94、1.06、3.47 μS/cm,说明高浓度的胞外代谢产物对细胞膜的影响较大,能使原生质及电解质外渗,增大细胞膜的通透性。之后随作用时间延长,2.0MIC组电导率略有下降,但高于对照组。1.0MIC、0.5MIC组电导率显著下降,明显低于对照组,这可能是由于JYY-3菌株代谢产物浓度较小,致使后期随着药效下降使其对病原菌细胞膜的作用减弱;反而可能由于对金属离子有螯合作用,使其电导率降低[19]。由图4可知,随着处理时间延长,对照组胞外大分子物质核酸含量维持在较低水平,而经JYY-3菌株胞外代谢产物处理后,菌体在260 nm处的吸光度显著高于对照组(P<0.05),在6 h时0.5MIC、1.0MIC、2.0MIC 组分别较对照高0.85、1.06、1.16,可见JYY-3菌株胞外代谢产物浓度越高,从菌体内流出的 DNA、RNA 等大分子物质成分越多,菌体细胞膜受损越严重。
2.3.3 对桃树细菌穿孔病病原菌细胞壁的影响
碱性磷酸酶(AKP)是存在于细菌细胞壁与细胞膜之间的一种酶,在菌体正常生长时胞外不能检测到该酶活性,但当细胞壁破坏后,将大量泄漏到胞外[20]。由图5可知,在0~4.0 h的处理时间内,对照组AKP活性始终较低,表明病原菌生长较好,细胞壁完整。但经不同浓度JYY-3菌株胞外代谢产物处理后,在最初的3.0 h内AKP活性迅速上升,之后趋于稳定,且胞外代谢产物浓度越高,AKP活性越高。这说明金银花内生菌株JYY-3胞外代谢产物能破坏桃树细菌穿孔病病原菌细胞壁的完整性,并且在较短的时间内就能造成菌体细胞壁通透性的增加。
2.3.4 对桃树细菌穿孔病病原菌纤维素酶的影响
纤维素酶是病原物产生的、能引起植物致病的重要因子,可通过水解宿主植物细胞壁组分使病原菌穿入并侵染宿主组织[21]。因此可通过测定纤维素酶的活性来研究JYY-3菌株胞外代谢产物对穿孔病菌侵入能力的影响。由图6可知,试验组穿孔病菌纤维素酶活性极显著低于对照组(P<0.01),且胞外代谢产物浓度越高,其活性越低。随胞外代谢产物处理时间的延长,纤维素酶活性不断下降,在12 h时与对照组差异最大,经0.5MIC、1.0MIC、2.0MIC胞外代谢产物作用后的菌体纤维素酶活性分别下降了50.43%、58.81%和74.87%。这表明金银花内生菌株JYY-3胞外代谢产物能通过抑制纤维素酶的活性来减弱桃树细菌穿孔病病原菌对宿主细胞细胞壁的破坏作用,从而削弱病原菌入侵能力,且胞外代谢产物浓度越高,效果越好。
2.3.5 对桃树细菌穿孔病病原菌胞外多糖(EPS)的影响
EPS是病原菌的致病生化因子,可导致宿主局部组织坏死,有助于病原菌抵御宿主细胞产生的抗菌活性物质或氧化剂的攻击,也能干扰宿主对病原菌的免疫识别[22]。由图7可知,经JYY-3菌株胞外代谢产物处理后穿孔病病原菌菌体EPS含量极显著的低于对照组。随着浓度的升高,EPS含量逐渐降低,其中1/20MIC组含量最低。这说明金银花内生菌株JYY-3胞外代谢产物能抑制桃树细菌穿孔病病原菌胞外多糖的合成,使其毒性和扩散能力降低,起到抑制病原菌致病性的作用,且胞外代谢产物浓度越高,抑制作用越强。
2.3.6 对桃树细菌穿孔病病原菌呼吸代谢的影响
琥珀酸脱氢酶(SDH) 和苹果酸脱氢酶(MDH)存在于所有氧呼吸细胞中,是三羧酸循环中的2种关键酶类,在电子传递与能量转换中起着关键作用[23-24]。由图8、图9可知,0~2 h内,不同浓度JYY-3菌株胞外代谢产物处理组的SDH、MDH活性极显著低于对照组。在12 h,2种酶活性下降最大,其中2.0MIC处理组SDH、MDH的活性最低,较对照组分别降低107.644、13.729 U/mg。这表明金银花内生菌株JYY-3可通过抑制SDH、MDH活性以抑制桃树细菌穿孔病病原菌的呼吸作用,从而对能量代谢系统产生影响,且浓度越高,影响越大。
2.3.7 對桃树细菌穿孔病病原菌胞内核酸含量的影响 蛋白质、DNA和RNA是衡量菌体生长状况的重要生物大分子,三者合成若受到影响会造成代谢紊乱[24-25]。由图10可知,经JYY-3菌株胞外代谢产物处理后,病原菌荧光强度明显降低,且浓度越高,荧光亮度越弱。由图11、图12可知,胞外代谢产物处理组DNA、RNA含量均极显著减少(P<0.01),经2.0MIC胞外代谢产物作用24 h后,穿孔病菌DNA、RNA含量分别减少了58.46%、77.8%,表明JYY-3菌株胞外代谢产物对桃树细菌穿孔病病原菌DNA、RNA的合成有抑制作用,且胞外代谢产物浓度越大,对病原菌正常生长代谢影响越严重。
3 讨论与结论
本试验从健康金银花、桃树、博落回、板栗植株中共分离得到45株内生菌,包括19株内生细菌,19株内生真菌,7株内生放线菌,其中抑菌活性最强的为从金银花植株中分离的JYY-3菌株,经鉴定为曲霉属。李瑾也证实金银花内生真菌JY-2也具有较好抑菌活性,但经鉴定其为镰刀菌属[26]。MIC测定结果表明,JYY-3菌株胞外代谢产物对桃树细菌穿孔病病原菌甘蓝黑腐黄单胞菌的最低抑菌浓度为50 mg/mL,当其等于或高于此浓度时能延长穿孔病菌迟缓期或减弱其对数期,使菌浓度保持在较低水平,以此达到抑制病原菌生长的目的。
病原菌在生长和繁殖过程中释放的代谢产物对于菌体吸收营养物质、吸附和入侵宿主机体以及抵抗宿主免疫因子的反应等具有极为重要的作用[27-29]。如林海云等在青枯雷尔氏菌致病机制研究中发现,病菌分泌的胞外多糖及纤维素酶可加快其在植物体内的扩散,进而造成植株萎蔫或死亡[30]。因此,可通过抑制纤维素酶、胞外多糖等物质合成来抑制病原菌对植物的入侵作用,如王芳研究发现,从苦参中筛选出的B36菌株能有效抑制叶霉病菌纤维素酶活性,从而降低其入侵番茄植株能力[31]。黄青春发现,拌种灵可通过抑制柑橘溃疡病病原菌胞外多糖分泌从而抑制该病害在植株中生长[32]。本试验研究结果也显示,经JYY-3菌株胞外代谢产物处理后,病原菌胞外多糖合成和纤维素酶活性在24 h较对照组分别降低58.81%、74.87%,这表明金银花内生菌株JYY-3胞外代谢产物可通过弱化胞外多糖的分泌及纤维素酶的活性来抑制桃树细菌穿孔病病原菌在植株中的生长及致病能力。
已有研究证实,许多活性成分的抑菌机制主要是通过破坏细胞壁及细胞膜的完整性和抑制蛋白、核酸的合成等途径来实现[33]。细胞膜和细胞壁是许多药物发挥抑菌作用的靶点,如谢晶等研究植酸对腐败希瓦氏菌的抑菌机制时发现,药物作用会导致细胞膜和细胞壁结构的破坏,使通透性增大,导致细菌内容物的外漏,使培养液电导率和AKP活性上升[19]。本试验也发现,经JYY-3菌株胞外代谢产物处理后,桃细菌穿孔病病原菌培养液中电导率和核酸含量、AKP活性均较对照组显著上升,这说明金银花内生菌株JYY-3可通过破坏病菌的细胞膜及细胞壁完整性以抑制桃树细菌穿孔病病原菌的生长。
蛋白质是生物生命活动的主要承担者,而核酸是遗传信息的携带者,核酸含量的减少,会直接导致蛋白合成量的降低,从会严重影响菌体细胞的各项生理机能[34]。本试验结果表明,经JYY-3菌株胞外代谢产物作用后,桃细菌穿孔病病原菌DNA和RNA含量极显著低于对照组,这说明金银花内生菌株JYY-3胞外代谢产物可明显抑制病原菌核酸的合成,从而影响其各项生理机能。另一方面,呼吸代谢是生物体进行各项生命活动的重要基础,若病原菌的呼吸链被阻断,其生长所需的能量就无法合成[23-24]。本试验结果显示,经菌株JYY-3胞外代谢产物处理后,桃细菌穿孔病病原菌呼吸代谢所必需的琥珀酸脱氢酶、苹果酸脱氢酶活性被显著抑制。这表明,金银花内生菌株JYY-3可通过抑制琥珀酸脱氢酶和苹果酸脫氢酶活性以阻断桃细菌穿孔病病原菌的呼吸链,进而抑制其生长。其作用机制可能是胞外代谢产物中的有效成分与这2个酶侧链的氨基酸结合,改变其构象,使酶活性降低,从而抑制病原菌的呼吸代谢,但其具体的作用机制尚未明确。
综上所述,从金银花健康植株中筛选出的曲霉属JYY-3菌株对桃树细菌性穿孔病有较强抑制作用,其抑菌机制主要是通过抑制病原菌胞内DNA、RNA的合成,破坏细胞壁、细胞膜的完整结构,抑制胞外多糖和纤维素酶合成,抑制菌体的呼吸代谢等途径来实现的。因此曲霉属JYY-3菌株有望用于桃树细菌性穿孔病的防治,但其抑菌活性物质的确定及分离还有待进一步研究。
参考文献:
[1]何 敬. 秦安县桃树细菌性穿孔病的发生及防治[J]. 甘肃农业科技,2019(7):88-89.
[2]秦 霞,杨红芳,刘清瑞. 桃树细菌性穿孔病的发生因素与综合防治[J]. 种业导刊,2016(7):13-14.
[3]Wilson D. Endophyte:the evolution of a term,and clarification of its use and definition[J]. Oikos,1995,73(2):274-276.
[4]Jia M,Chen L,Xin H L,et al. A friendly relationship between endophytic fungi and medicinal plants:a systematic review[J]. Frontiers in Microbiology,2016,7:906.
[5]尹雁玲,蔡 然,张功良,等. 植物内生菌增强植物对生物胁迫抗性的研究进展[J]. 广西植物,2023,43(2):212-220.
[6]刘 冰,李冬植,胡长志,等. 柑橘可培养内生细菌与寄主品种抗溃疡病相关性的初步研究[J]. 江西农业大学学报,2013,35(2):319-323,418.
[7]崔丽红,宋金秋,陈继富,等. 根际内生菌对猕猴桃溃疡病生防作用研究初探[J]. 上海农业学报,2017,33(6):28-32.
[8]黄海东,杨红澎,王 玉,等. 云雾龙胆内生菌的分离鉴定及抗菌活性分析[J]. 微生物学通报,2010,37(7):1017-1021.
[9]谭才邓,朱美娟,杜淑霞,等. 抑菌试验中抑菌圈法的比较研究[J]. 食品工业,2016,37(11):122-125.
[10]曾范利,于 录,葛 发,等. MABA法与二倍稀释法测定齐墩果酸体外抗结核菌活性[J]. 动物医学进展,2010,31(7):22-25.
[11]张 燕. 酸马奶源乳酸乳球菌代谢物和大黄联合作用对小鼠盲肠微生物以及营养代谢的影响[D]. 呼和浩特:内蒙古农业大学,2016:16-17.
[12]魏景超. 真菌鉴定手册[M]. 上海:上海科学技术出版社,1979:1-10.
[13]朱艳蕾. 细菌生长曲线测定实验方法的研究[J]. 微生物学杂志,2016,36(5):108-112.
[14]韩学易,陈 惠,吴 琦,等. 产纤维素酶枯草芽孢杆菌C-36的产酶条件研究[J]. 四川农业大学学报,2006,24(2):178-181.
[15]李佳佳,鞠玉琳,李 杨. 桦褐孔菌多糖的提取及含量测定方法的研究[J]. 湖北农业科学,2009,48(12):3133-3135.
[16]黄燕飞. 黄连水提物对痢疾杆菌的抑菌机制研究[D]. 合肥:安徽农业大学,2016:16.
[17]王海涛,王 倩,谢明杰. 大豆异黄酮对金黄色葡萄球菌的抑菌机制研究[J]. 中国农业科学,2009,42(7):2586-2591.
[18]谢 强,林玉桓,苗淑萍,等. 香芹酚对大肠杆菌和金黄色葡萄球菌细胞膜的影响[J]. 食品工业科技,2014,35(23):54-58,62.
[19]谢 晶,侯伟峰,汤 毅,等. 植酸对腐败希瓦氏菌的抑菌机理[J]. 食品工业科技,2011,32(10):85-88.
[20]李昌勤,赵 琳,薛志平,等. 隐丹参酮抑菌作用机制研究[J]. 中国药学杂志,2012,47(21):1706-1710.
[21]赵 蕾,张天宇. 植物病原菌产生的降解酶及其作用[J]. 微生物学通报,2002,29(1):89-93.
[22]葛红娟,龙桂友,戴素明,等. 冰糖橙与枸橼 C-05 对溃疡病菌生长特性的影响[J]. 中国农业科学,2015,48(7):1383-1391.
[23]徐明生,陈锦屏,上官新晨. 鱼精蛋白对黑曲霉细胞内的琥珀酸脱氢酶和苹果酸脱氢酶的影响[J]. 食品科学,2005,26(4):48-51.
[24]曹鹏飞,刘青娥. 杨梅枯萎病拮抗内生菌的分離及其抑菌机制研究[J]. 河南农业科学,2021,50( 4):96-105.[HJ1.7mm]
[25]周 磊,云宝仪,汪业菊,等. 大黄素对金黄色葡萄球菌的抑菌作用机制[J]. 中国生物化学与分子生物学报,2011,27(12):1156-1160.
[26]李 瑾. 金银花内生真菌的分离鉴定和抗菌性研究[D]. 郑州:河南工业大学,2010:60-61.
[27]周 晶. 病原菌致病性胞外产物(ECP)的研究进展[J]. 畜牧与饲料科学,2009,30 (1):8-9.
[28]陈 成. 拟态弧菌感染黄颡鱼的组织嗜性与动态病理损伤研究[D]. 雅安:四川农业大学,2016:5-6.
[29]娄喜艳,郭洋洋,裴冬丽. 河南商丘月季黑斑病病原菌鉴定及生物学特性[J]. 江苏农业科学,2021,49(19):138-143.
[30]林海云,车建美,刘 波,等. 青枯雷尔氏菌致病机制及其相关基因的研究进展[J]. 福建农业学报,2011,26(5):899-906.
[31]王 芳. 苦参内生拮抗细菌筛选及其抗菌物质纯化鉴定[D]. 沈阳:沈阳农业大学,2009:125-127.
[32]黄青春. 拌种灵(Amicarthiazol)对柑橘溃疡病菌作用机制研究[D]. 南京:南京农业大学,2001:59-70.
[33]邓 超,付海田,谷 鹏. 长裙竹荪子实体乙醚和乙酸乙酯提取物的化学组成分析及抑菌活性研究[J]. 食品工业科技,2014,35(22):128-134.
[34]吴华彰,费鸿君,赵云利,等. 萝卜硫素对大肠杆菌抑菌机制的研究[J]. 四川大学学报(医学版),2012,43(3):386-390.
收稿日期:2022-10-08
基金项目:浙江省丽水市重大科技计划(编号:2019ZDYF01)。
作者简介:曹鹏飞(1978—),男,陕西旬邑人,副研究员,从事园艺植物病理研究工作。E-mail:297473247@qq.com。
通信作者:吴华芬,高级农艺师,从事植物资源研究推广工作。E-mail:631154131@qq.com。

