花生蛋白糖基化修饰及其应用的研究进展
刘沛龙,刘昆仑
河南工业大学 粮食与物资储备学院,河南 郑州 450001
随着全球人口数量的增长及消费水平的提升,人们对蛋白质需求日益增加,动物蛋白资源逐渐供不应求[1]。近年来,国内外研究人员不断寻找优质蛋白资源以改善资源短缺的现状。研究发现,植物蛋白价格低廉、可获得性高、对环境的影响小,不仅能够满足人们对蛋白质的日常营养需求,还能减少环境污染[2]。随着对植物蛋白研究的不断深入,其在食品工业中得到了广泛的应用,一些植物蛋白被用来代替肉类、鸡蛋、牛奶等[3]。与其他植物蛋白相比,花生蛋白具有低水平的抗营养因子、良好的氨基酸结构以及较高的有效利用率,易于人体消化吸收[4]。在食品工业中,蛋白质的营养、感官、理化特性等都起着重要的作用[5]。由于花生蛋白主要由球蛋白和伴球蛋白组成,球蛋白在商业化生产中容易发生变形聚集,常以聚集体的形式出现,因此呈现较差的溶解性[6]。故花生粕作为良好的花生蛋白资源,多被用作动物饲料或农业废弃物,并未得到充分利用[7]。因此,改善花生蛋白的功能特性,充分利用现有的花生蛋白资源是亟须解决的问题。
近年来,通过蛋白质改性来改善其功能特性得到了广泛的关注。蛋白质改性可分为物理改性、化学改性以及酶改性[8],常见的改性方法包括球磨处理、超声处理、冻融循环处理、糖基化修饰、磷酸化[9-12]等。其中,化学修饰虽具有较好的有效性,但大多数具有毒性,会对人体健康产生危害。糖基化修饰过程反应温和,且不需要加入外来化学物质,修饰后花生蛋白的理化特性都有不同程度的改善。糖基化修饰是一种绿色、有效且具有潜力的改性方法,在食品工业中有良好的应用前景[13]。作者主要从糖基化修饰机理、常见的糖基化修饰方法、糖基化对花生蛋白功能特性及花生过敏原的影响、糖基化花生蛋白的应用等方面进行综述。
1 糖基化修饰机理
美拉德反应广泛存在于食品加工中,又被称为非酶促褐变反应,属于蛋白质的化学改性范畴。糖基化修饰是基于美拉德反应将碳水化合物以共价键形式与花生蛋白分子上的α-或ε-氨基相连接而形成糖基化蛋白的化学反应,反应方程如图1所示。
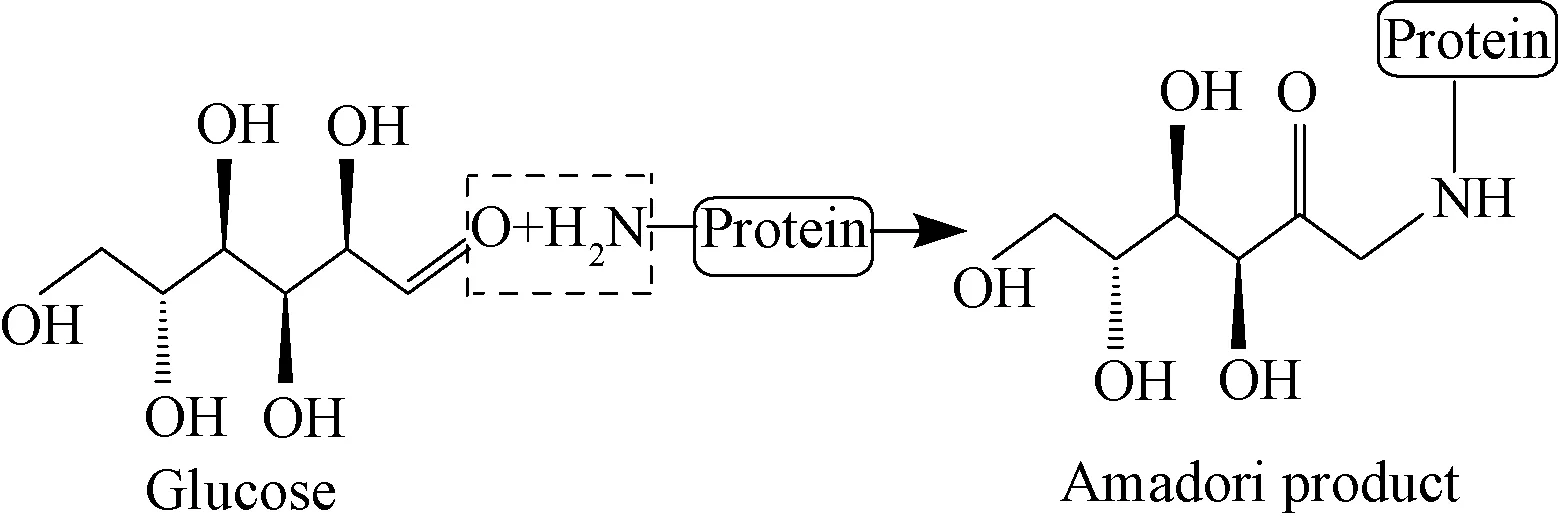
图1 糖基化反应方程Fig.1 Glycosylation reaction equation
美拉德反应最早由法国化学家Maillard于1912年提出,是一个复杂的化学反应体系,主要分为3个阶段[14-17]。第1阶段,蛋白质游离的氨基与还原糖中的羰基发生缩合反应,生成希夫碱,而后经Amadori重排生成更稳定的1-氨基-1-脱氧-2-酮糖。第2阶段,Amadori重排产物发生降解,当pH≤7时,经1,2-烯醇化反应生成糠醛或羟甲基糠醛,当pH>7时,主要是2,3-烯醇化反应,降解为还原素和各种裂变产物类,如丙酮、双乙酰等,这些高活性的降解产物进一步进行Strecker降解反应生成醛类、吡嗪类及褐色色素。第3阶段,中期的降解产物进一步发生包括环化、脱水、烯醇化、氧化、碎片化、重排、异构化和缩合在内的一系列反应,生成具有有色化合物的高分子量聚合物,统称为类黑素。
美拉德反应产物是多种感官活性化合物,影响蛋白质的质量,如结构、风味、颜色等[18]。经糖基化修饰后,蛋白质的功能特性都明显改善。但研究表明,美拉德反应得到的糖基化中间体容易参与进一步的降解、交联等反应,产生晚期糖基化终产物(AGEs)[19]。在糖基化修饰中,Nε-羧甲基赖氨酸和Nε-羧乙基赖氨酸被认为是两种典型的AGEs[20]。这些美拉德反应最终阶段产生的AGEs被认为是有毒有害物质[21]。一方面,AGEs可以诱导使蛋白质结构和功能改变;另一方面,AGEs可以激活受体介导的细胞反应,诱导促炎分子的合成,影响细胞存活、分化和增殖,并诱导代谢变化[22]。AGEs在正常的生理条件下,能够被人体清除,在高血糖或氧化应激条件下,则会被广泛积累[23]。为预防AGEs对人类健康带来不利影响,近年来,美拉德反应中后期的反应机理成为研究者们聚焦的重点。由于美拉德反应机理复杂,对其生成AGEs的机理研究仍处于初步阶段。目前常用酸水解后赖氨酸和糠氨酸的定量对早期美拉德反应的进展进行测定[24]。糖基化反应过程中,反应速率取决于温度、pH值、糖的种类、水分活度等多种因素[25]。过高的反应温度、过长的反应时间等都会增加类黑素等美拉德反应晚期产物形成,如何通过构建合理的反应体系将美拉德反应控制在偶合初期以限制或减少AGEs的生成是目前需要攻克的难点。
2 糖基化修饰方法
2.1 干热法
蛋白质糖基化修饰的传统方法可分为干热法和湿热法[26]。干热法通过蛋白与多糖混合,制备成水分散体,再将分散体冷冻干燥后在干燥器中孵育1周左右,得到糖基化产物。常用温度为50~60 ℃,相对湿度为60%~85%,降温即可终止反应的进行[27]。研究表明,干热法获得的产物具有良好乳化性能,能够在不需要化学物质的前提下进行蛋白质与多糖的共价偶联[28]。通过干热法得到的复合物具有较强的稳定性与分子完整性。易于控制反应条件,在一定条件下不产生有毒有害产物[29]。温度是影响蛋白质糖基化的重要因素,温度过高会增加美拉德反应产生AGEs的概率,不能保障糖基化蛋白的安全性。干热法一般选用的温度较温和,但反应时间较长,反应难以精确控制,反应阶段容易进一步向中后期进行。此外,反应过程中需要控制水分活度,耗能高,后期冷冻干燥作为工业化生产成本也较高,在食品的生产应用中存在缺陷。
2.2 湿热法
湿热法一般会选用在水或油溶液中加热,不需要冷冻干燥,一定程度上简化了反应过程,与干热法相比,缩短了反应时间。Pirestani等[30]通过湿热法将阿拉伯胶与菜籽油分离蛋白进行偶联,糖基化后的缀合物能够显著降低蛋白质的热聚集作用,改善蛋白质的溶解性、乳化性等功能特性。但湿热法对反应过程的控制相对困难,且得到的接枝物比较复杂[31]。在高温条件下,天然蛋白质易发生变性,无法有效获得品质良好的糖基化产物。因为反应混合物中存在水,可能会促使反应向相反方向进行,从而降低产率[32]。通过辅助手段结合湿热法处理,是目前具有良好前景的方法,能够有效促进糖基化修饰,在短时间内进行接枝改性。
2.3 其他辅助方法
为弥补传统糖基化修饰存在的缺陷,常以其他技术手段辅助进行糖基化反应,如超声、冷等离子体、球磨预处理、酶解[33-36]等,以加速反应速度,适用于工业化生产。多数辅助手段通过改变蛋白质结构,促进蛋白展开,从而使糖基化位点暴露,增加糖基化效率。如超声处理通过减小蛋白质的粒径、减少α-螺旋等方式改变蛋白质构象,增加糖基化位点,促进蛋白质与糖的偶合。有研究表明,中功率超声处理能够将蛋白质分散成可溶性的小分子蛋白质聚集体,增加蛋白质溶解度[37]。静电纺丝对蛋白质-多糖混合物进行物理结构的改变也能够较好地解决一些生产缺陷。在静电纺丝过程中弯曲与拉伸运动产生的分子排列,能够使反应物保持紧密的分子接触;在纤维的物理状态下,糖基化修饰还能减少褐变,限制AGEs的生成[38]。但辅助手段需要考虑成本与可操作性,处理强度、反应温度等都会影响偶联物的功能性质,从而影响其在商业化生产中的应用。在追求效率的同时,还需要注意对接枝物品质的影响,尽量在美拉德反应第1阶段进行蛋白质与糖的偶合,避免AGEs产物对人体造成危害。
3 糖基化对花生蛋白功能特性的影响
3.1 溶解性
溶解性是指物质在溶剂中溶解能力大小的一种属性。溶液与固体相处于平衡状态下的浓度,称为溶解度[39]。除温度、pH值等环境因素外,溶解度还受蛋白质分子本身的结构影响,如氨基酸组成、蛋白质分子构象等[40]。由于花生蛋白自身的刚性球形结构,溶解性较差,在食品加工中未能得到有效利用。糖基化修饰过程中,亲水多糖能够有效提高蛋白质与水分子的亲和力,提高溶解性。花生蛋白-多糖缀合物在等电点附近的溶解度高于天然蛋白质,表明多糖提供了空间稳定性[41]。Yu等[42]利用冷等离子体技术将花生蛋白与田菁胶(SG)进行共价结合,冷等离子体处理可以有效地诱导并加速美拉德反应的发生,增加—OH含量,从而改善花生蛋白的水化性能。Li等[43]通过干热法将花生蛋白进行糖基化修饰并对其溶解度与结构进行了分析测定,结果表明,相较于天然花生蛋白,蛋白质与多糖缀合物的溶解度显著提高。结构分析显示,缀合物较低的表面疏水性是由于多糖的屏蔽作用。多糖含量对花生蛋白溶解度具有一定的影响,过量的多糖甚至对溶解度具有负作用,如Cai等[44]研究了多糖对花生蛋白理化性质的影响,结果显示,随着多糖浓度的增加,蛋白质的溶解度呈现先增加后减小的趋势。推测为复合物形成了不溶性聚集体,连续的蛋白质大离子附着,多糖的总体净电荷减少,导致在可溶络合物中形成电中性,由于氢键的形成以及疏水、偶极子和电荷-偶极子相互作用而聚集沉淀。合适的多糖类型与浓度对糖基化反应至关重要,此外,温度、pH值等外部因素也应成为关注的重点。溶解性的提高也有利于花生蛋白其他理化性能的改善,使其在食品加工中发挥更高的应用价值。
3.2 乳化性
乳化性是指油与水形成乳状液的能力。蛋白质作为优质的乳化剂,同时含有疏水区和带电的亲水区,降低表面张力的同时在乳液界面上相互作用[45]。由于蛋白质在其等电点时容易发生聚集,使其在食品工业中的应用受到限制。经糖基化修饰后,蛋白质同时具有良好的乳化性与稳定性。糖基化产物形成的界面结合力比相应的非共价产物更强,有助于缀合物在油滴周围聚集成一个坚固、黏弹性的多层膜,从而阻止了蛋白的絮凝和聚集[46]。其他技术辅助糖基化修饰能够更有效地提高蛋白质的乳化性,如冷等离子体技术可以展开花生蛋白的二级、三级结构,暴露糖基化位点从而有效地诱导快速糖基化反应。Ji等[47]通过等离子体将花生分离蛋白与葡聚糖糖基化后进行了乳化液稳定性的测定,结果显示,花生分离蛋白与葡聚糖缀合物的乳化液稳定性高于混合物,在蛋白质的溶解度达到最大值时,乳化液稳定性也达到最高,表明蛋白质的溶解性是影响乳化性的重要因素。杨伟强等[48]研究了超声波辅助花生浓缩蛋白糖基化改性工艺,结果表明,改性浓缩蛋白的乳化活性和乳化稳定性高于浓缩蛋白。在一定糖浓度范围内,花生蛋白的乳化活性会逐渐增大。当糖浓度过大时,过多的羰基竞争参与糖基化反应,反而会降低糖基化蛋白的生成量,乳化活性与乳化稳定性也逐渐降低。曲刚[49]在研究中发现,糖基化蛋白的乳化特性与还原糖类型、比例和反应温度等密切相关,在相同的反应条件下,麦芽糖偶合得到的缀合物乳化性及乳化稳定性均优于葡萄糖。推测单糖的羰基含量更高,增加了氨基和羰基结合的概率,更有利于反应的进行。60 ℃时花生蛋白能够保持良好的乳化活性,过高的温度容易引起蛋白质变性从而降低乳化稳定性。目前研究更倾向于借用辅助手段,更高效地进行糖基化反应,但需要关注的是,改进糖基化本身的反应体系从而得到优质的糖基化产物也具有重要意义。经糖基化修饰的蛋白质作为乳化剂、生物壁材等应用于食品、药品工业中都有广阔的发展前景。
3.3 起泡性及泡沫稳定性
蛋白质倾向于在气-液水界面积聚,构成一个界面层,从而改变表面性质。通常蛋白质能够有效地稳定泡沫,并防止它们恢复到由平面界面分开的两个体相,在许多食品中起到稳定食品系统的作用[50]。因此在食品加工过程中,起泡性是重要的性能之一。溶解性是决定蛋白质起泡性及泡沫稳定性的先决条件,溶解性的增强通常就伴随着起泡性、泡沫稳定性的增强。此外,蛋白质的起泡性及泡沫稳定性还与pH值、温度、盐浓度等因素有关。糖基化修饰为蛋白提供了额外的亲水性基团并一定程度改变了蛋白质的构象,增加了蛋白质的溶解度,加速了气-液界面的吸附,从而提高了泡沫容量和稳定性[51]。Liu等[52]将花生蛋白与葡聚糖进行糖基化修饰,结果表明,糖基化花生蛋白起泡性与泡沫稳定性都显著提高。经分析,葡聚糖作为一种非表面活性的亲水多糖,在气-水界面吸收的倾向不大,但可以作为增稠剂或胶凝剂,增强蛋白质泡沫的稳定性,从而经过缀合后改善花生蛋白的泡沫稳定性。糖基化蛋白具有更高的溶解度,比原始蛋白质更快地从本体转移到界面,从而提高花生蛋白的起泡性。Han等[53]为改善花生分离蛋白的功能特性,采用超声辅助湿热法制备了花生分离蛋白与玉米丝多糖(CSP)的共价复合物,结果显示,CSP的加入显著提高了缀合物的起泡性和泡沫稳定性,且随着多糖浓度的增加泡沫稳定性逐渐提高。当花生分离蛋白的溶解度较高时,容易在空气和水之间形成一层胶膜,从而提高了蛋白质的泡沫稳定性。同时,CSP的络合作用抑制了蛋白质的聚集,有利于提高溶液起泡性。多糖的分子量也是影响缀合物界面性质的重要因素。低分子量多糖与蛋白质形成的缀合物相较于高分子量具有更强的抵抗表面活性剂引起的空气-水界面位移的能力,能够提高更多的还原端末端进行糖基化修饰从而提高缀合物生成的效率[54]。研究不同分子量多糖及蛋白质与多糖比例的关系对后续提高糖基化反应效率具有重要意义。在食品体系中,蛋白质的起泡性能够使其在食品界面中形成黏弹性薄膜,广泛应用于烘焙及啤酒制作等。
4 糖基化对花生过敏原的影响
花生是较常见的重要食物过敏原之一,会导致严重的过敏反应。花生过敏原的种类大致可分为三类:Ara h1、Ara h2、Ara h3[55]。其中Ara h1是最重要的花生过敏原,在花生过敏原中含量最高,占总花生蛋白含量的12%~16%[56]。当花生过敏患者的抗血清同时被Ara h1分子处理时,这些血清中的免疫球蛋白E (IgE)抗体将与Ara h1分子反应,表明Ara h1的C端和N端结构域对花生糖过敏原的表位形成有重要作用[57]。花生蛋白可以与糖共价或通过聚集结合,从而隐藏或破坏表位,糖蛋白的形成掩盖了核心抗原表位并阻断了抗原抗体反应从而降低了过敏反应[58]。Tian等[59]对糖基化花生蛋白进行表征,结果显示,经葡聚糖糖基化的rAra h1具有IgE结合能力,交联过程中保留了完整的线性表位,增强了花生蛋白的过敏反应。而在40 ℃时,rAra h1与葡萄糖胺之间的糖基化降低了过敏原抗原性,表明糖基化过程中形成的缀合物的结构受温度、糖种类等影响,因而表现出不同的过敏性。40 ℃时葡聚糖糖基化过程中形成的聚集物增加了空间位阻,破坏了完整的表位,导致rAra h1的免疫原性降低。也有研究推测,美拉德反应增加Ara h1的免疫原性和过敏原性是由于其能够改变Ara h1蛋白的结构,增加其对消化酶的抵抗力,并通过影响B细胞和T细胞的分化,导致TH2细胞因子和特异性抗体的释放增加[60]。史云凤[61]将纯化的重组花生Ara h1蛋白与葡萄糖干热处理,模拟糖基化反应并对得到的终末糖基化Ara h1蛋白进行致敏性评估,结果显示,经过高温糖基化修饰蛋白AGE-Ara h1显示出更高的过敏性。RBL细胞实验表明,AGE-Ara h1致敏的小鼠血清有更高的RBL脱颗粒能力。虽然糖基化使Ara h1与IgE的结合能力略有下降,但增加了使RBL细胞脱颗粒的能力,进而引发更严重的过敏反应。研究糖基化对rAra h1结构和免疫反应性的影响,阐明糖基化对致敏性影响的反应机理,从而得到降低Ara h1变应原性的有效反应条件是目前研究的重点。
5 糖基化花生蛋白的应用
5.1 在包装材料中的应用
为减少包装材料对环境造成的污染,学者们聚焦于对可生物降解包装的研究。由于植物蛋白具有环境可持续性,因此是当下最有吸引力和潜力的材料。通过美拉德反应获得的蛋白质-多糖缀合物具有显著的乳化特性、良好的拉伸强度和水蒸气阻隔性能。Li等[62]采用干热法将花生分离蛋白与阿拉伯胶进行糖基化,结果表明,与花生分离蛋白薄膜相比,糖基化薄膜的抗拉强度提高,水蒸气渗透性降低。随着糖基化程度增加,膜的网络结构呈现更加均一和无定形状态,并且能够减少蛋白质的浸出。Lin等[63]将花生蛋白经木糖修饰后,制备花生分离蛋白薄膜,结果显示,木糖在花生蛋白膜中的应用不仅提高了膜的强度和伸长率,而且降低了膜的水溶性,显著改善了花生蛋白生物降解膜的力学性能。Liu等[64]以木糖和花生分离蛋白为基质制备了薄膜,结果与上述相同,花生分离蛋白与木糖进行交联改性后,增加了花生蛋白的巯基含量和表面疏水性,显著提高了薄膜的力学性能和耐水性。在产物制备过程中,部分蛋白质分子展开,导致蛋白质内部的疏水基暴露,增加了木糖分子与花生分离蛋白之间的共价键。糖基化蛋白质作为具有两亲性的产物,形成的薄膜作为壁材包埋具有更稳定的效果。邱佳欢[65]以糖基化改性后的花生球蛋白/酪蛋白和羧甲基壳聚糖作为主要原料,将其应用于表没食子儿茶素没食子酸酯(EGCG)的保护和运输中,结果显示,复合改性下的糖基化蛋白结构显著变化,晶体构型由复杂趋向于有序。复合改性后的糖基化蛋白对EGCG具有较高的包封效果,此外还能延缓EGCG氧化分解,有效解决在模拟肠胃液中EGCG的突释现象。目前研究结果表明,花生蛋白经糖基化修饰能够得到性能良好的食品保鲜薄膜,并且其营养与环境保护方面均有较大的优势。多数蛋白作为壁材、包封材料能够保护包埋物的功能性,促进人体对包埋物的消化吸收,在实际应用中具有良好的发展前景。
5.2 在肉制品中的应用
花生蛋白作为优质的植物蛋白资源,在肉制品加工中能够保持组织结构稳定并提高其风味特性[66]。在食品加工过程中,花生分离蛋白的加入能够提高凝胶的持水性、弹性,形成更紧密的凝胶结构[67]。奥文芳[12]使用低聚异麦芽糖超声辅助接枝改性花生蛋白并将其应用于鱼糜中,结果表明,加入花生蛋白、花生蛋白接枝物均能改善鱼糜的得率、质构性质,且添加糖基化后的花生蛋白的鱼糜凝胶强度大于花生蛋白。糖基化引入的低聚异麦芽糖的亲水性羟基不仅可锁住水分,自身还可形成网络结构,同时还可以和肌原纤维蛋白交联形成三维网络,达到改善凝胶强度的目的。目前,糖基化修饰后的花生蛋白在肉制品中的应用研究较少,其风味特性、抗氧化性等在肉制品中的潜力还需要进一步研究探索。
6 展望
花生蛋白含有低剂量的抗营养因子、良好的氨基酸组成,是优质的植物蛋白资源。由于花生加工后蛋白质一定程度的变性以及蛋白质自身结构的限制,使其在食品工业上的应用受到了局限。蛋白质糖基化修饰通过蛋白质与亲水多糖共价连接,增加了羟基含量,提高了蛋白质与水分子的亲和力,并对花生蛋白的构象产生一定影响,从而有效改善了花生蛋白溶解性、乳化性、起泡性等性能。在一定条件下,糖基化反应还具有降低致敏性的潜力。在食品工业生产中,糖基化修饰后的花生蛋白多用作食品保鲜膜或壁材,不仅性能良好且环境可持续性高,还能作为肉制品添加剂满足不同食品中的特定营养功能。但目前对于糖基化美拉德反应后期产物的研究还不明确,现有的糖基化方法也并不具有在工业中大规模生产的能力。明确糖基化反应机理,建立合理的反应体系,利用现有辅助花生蛋白的糖基化反应,在减少反应时间的同时有效地进行糖基化接枝,减少糖基化晚期产物的生成是目前研究的重点。在保证蛋白质的功能价值及安全性的前提下,使糖基化修饰在大规模食品工业化生产中得到更广泛的应用。

