靶向人表皮生长因子受体3治疗非小细胞肺癌的研究进展
郑昌言 ,蒋家豪,宋戈,胡庆华
(1. 中国药科大学药学院,江苏 南京 211198;2. 上海复宏汉霖生物医药有限公司,上海 201615)
肺癌是全球发病率和死亡率最高的恶性肿瘤之一。国际癌症研究机构(International Agency for Research on Cancer,IARC)的肺癌统计数据显示,2020年全球新增约220万发病病例和约180万死亡病例[1]。肺癌的主要类型包括小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC),其中NSCLC约占所有肺癌病例的85%[2]。现有的临床治疗准则包括手术治疗、局部治疗、放射治疗和药物治疗,其中手术切除是Ⅰ/Ⅱ期NSCLC患者的推荐方法;对于不适合手术切除且表现良好的局部晚期患者,以放化疗结合或双重化疗为主;对于晚期NSCLC,具有基因组突变的肿瘤患者受益于分子靶向治疗[3]。大多数NSCLC 患者表现为晚期不可切除,因此针对NSCLC晚期的治疗显得尤为重要。据调查,高达69%的晚期NSCLC患者存在潜在的分子靶点[4]。肺癌的全基因组关联研究表明,驱动因子,如表皮生长因子受体(epidermal growth factor receptor,EGFR)突变、间质上皮转化因子(mesenchymalepithelial transition factor,MET)扩增、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)和Kirsten大鼠肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene homolog,KRAS)突变,均可通过刺激细胞增殖、转移、耐药等细胞学行为的下游信号通路增加肺癌风险[5]。在众多的驱动基因中,EGFR是突变率最高的基因之一,在一项涵盖全球151项研究(包括33 162例NSCLC/腺癌患者)的汇总分析中,约29%的患者出现EGFR突变,尤其在亚裔人种中高达50%[6]。EGFR突变的NSCLC患者是一个特殊的群体,大部分EGFR突变患者会对EGFR酪氨酸激酶抑制剂(tyrosine kinase receptor inhibitors,TKIs)敏感,然而受益于EGFR TKIs的患者普遍会出现临床耐药性[7]。尽管靶向治疗在分子驱动的NSCLC中有效,但仍需要开发新的治疗方法解决TKIs耐药性问题。
HER3是HER家族中独特的一员,因其缺乏固有酪氨酸激酶活性致使其在癌症中的作用一直被低估。然而近年来对HER3结构和功能的进一步研究表明,其对NSCLC的发生、发展以及耐药均起到重要的作用。因此,有效的HER3靶向治疗对于克服耐药性、提高药物疗效和改善癌症患者临床受益具有良好的开发前景。本篇综述主要介绍HER3与NSCLC的相关性以及HER3靶向治疗NSCLC的药物研究进展。
1 HER家族
HER家族由EGFR(ERBB1/HER1)、HER2(ERBB2)、HER3(ERBB3)和HER4(ERBB4)4个成员组成,其家族成员均由胞外结构域、跨膜结构域和胞内酪氨酸激酶结构域组成(见图1)[8]。除了HER2,其余家族成员均可通过与配体的相互作用形成同源二聚体或异源二聚体,引发下游信号通路,如磷脂酰肌醇3-激酶(phosphatidylinositide-3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/AKT)和大鼠肉瘤蛋白(rat sarcoma,RAS)/加速纤维肉瘤蛋白(rapidly accelerated fibrosarcoma,RAF)/有丝分裂原激活蛋白激酶(mitogen-activated protein kinase,MEK)/细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK),从而产生相应的生物学功能,包括细胞的增殖、逃逸、凋亡和血管生成等[9]。HER家族成员的潜在结合配体约11种,包括表皮生长因子(epidermal growth factor,EGF)、转化生长因子α(tansforming growth factor-α,TGF-α)和神经调节素(neuregulin,NRG)等(见图1)[10]。EGFR和HER4具有酪氨酸激酶活性,通过与相应的配体结合即可在不形成二聚体的情况下激活。HER2虽具有酪氨酸激酶活性,但无相应的配体结合,只能作为同一家族受体的高亲和力共受体,形成异源二聚体发挥作用;HER2在基因突变或扩增时也能通过形成同源二聚体而激活[11]。而HER3因其酪氨酸激酶异常,使其成为HER家族中独特的一员。HER3通过其独特的结构和特有的激活下游信号通路的能力,成为多种癌症复杂信号网络的一个关键节点。过去的十几年中,随着研究的不断深入,越来越多的证据表明HER激酶活性的异常激活导致许多肿瘤的发生和进展,并与肿瘤耐药密切相关[12]。

图1 HER家族受体的简易结构及其配体Figure 1 Basic structures and ligands of HER family members
2 HER3的结构和信号通路
HER3是HER家族的成员之一,由原癌基因c-ErbB3编码,是一个相对分子质量为180 000的跨膜糖蛋白[13]。该糖蛋白由3个结构域组成,分别为胞外配体结合结构域、疏水跨膜结构域和含羧基端尾部的胞内激酶结构域。其胞外结构域由4个亚结构域组成:Ⅰ(L1)、Ⅱ(C1)、Ⅲ(L2)和Ⅳ(C2),其中结构域Ⅰ、Ⅲ可与配体结合;结构域Ⅱ、Ⅳ(富含半胱氨酸)具有扩展结构,通过二硫键连接[14]。通常情况下,HER3以非活性单体的形式存在,通过结构域Ⅱ、Ⅳ之间的分子内相互作用保持闭合构象;当HER3与配体结合后,可使结构域Ⅱ、Ⅳ转换为活性构象,暴露结合活性位点,与其他受体形成二聚体而发挥作用。与同家族的其他成员不同,HER3的激酶结构域由于活性位点氨基酸的突变和修饰,其酪氨酸激酶活性受损,仅有EGFR自磷酸化活性的1/1 000,主要通过与其他成员形成异源二聚体而发挥作用[15]。同家族中,HER3主要与EGFR或HER2形成二聚体,与HER4的亲和力较低;同时,HER3能与部分非HER家族成员形成二聚体,例如间充质-上皮转换受体(cellularmesenchymalepithelial transition factor,c-MET)和成纤维细胞生长因子受体2(fibroblast growth factor receptor 2,FGFR2)[16]。
NRG1是HER3的主要配体,以自分泌或旁分泌的方式激活相关受体。HER3自身不能形成同源二聚体,但其胞外结构域结合NRG1后,可使构象发生变化,与同家族成员形成异源二聚体,促使异二聚体的胞内激酶活化,从而诱导自身C端尾部酪氨酸残基磷酸化,进而募集下游信号分子并激活下游信号通路(见图2)[17]。其中,HER3对PI3K/AKT信号通路的激活最为显著,其磷酸化后的酪氨酸残基可直接与PI3K的p85亚基结合,诱导PI3K活性,进而引发多种下游信号[18]。在HER家族同源二聚体或异源二聚体中,NRG1/HER3/HER2复合物的活性最强,可以强烈地激活PI3K/AKT信号级联以及RAS/分裂素原活化蛋白激酶(mitogen-activated protein kinases,MAPK)通路,增强细胞的存活和增殖[19]。
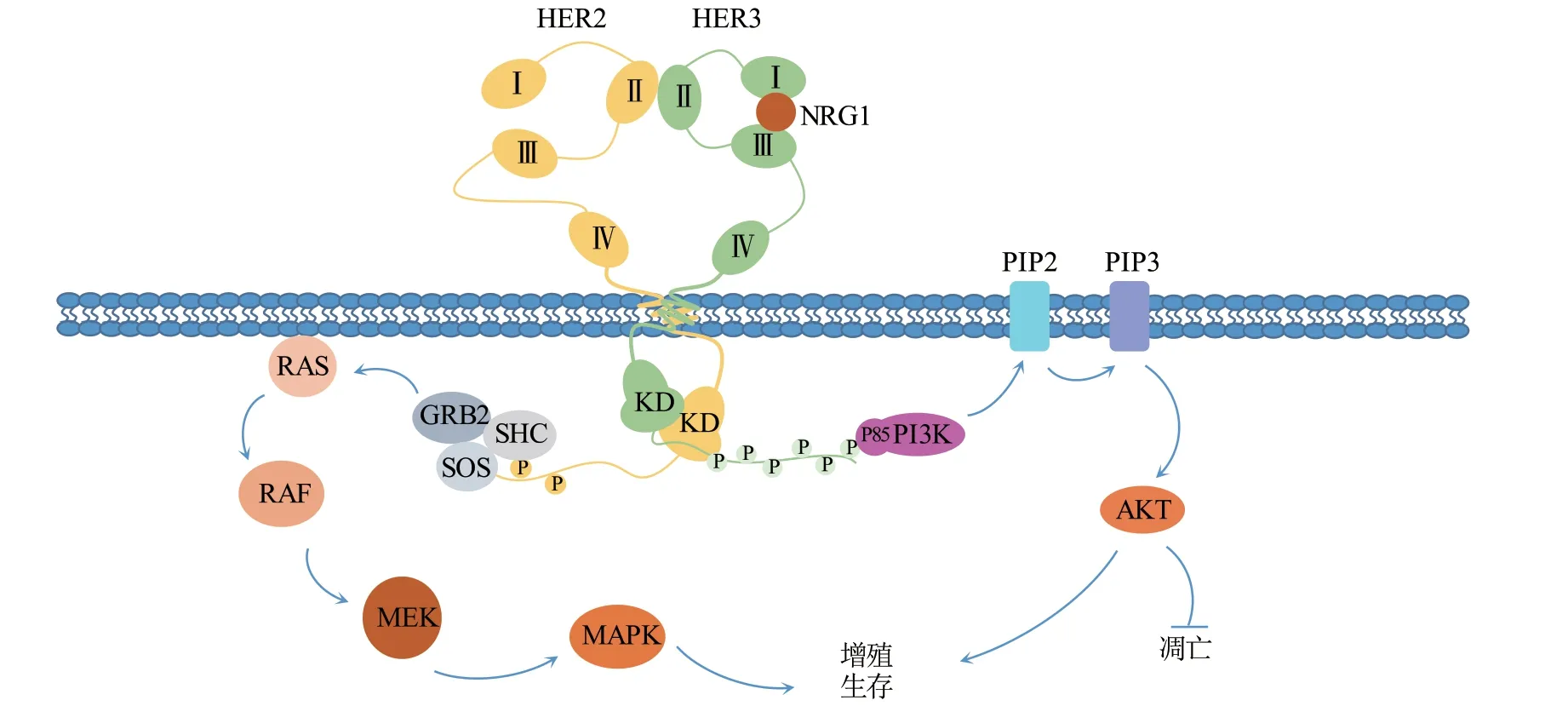
图2 HER3的二聚化及其信号级联Figure 2 HER3 dimerization and signaling cascade
3 HER3介导的NSCLC的进展
HER3在各种癌症中普遍表达,包括乳腺癌、卵巢癌、结肠癌、胃癌、肺癌和胰腺癌等[20]。其中HER3在约83%的原发性NSCLC中表达[21]。与同家族其他成员相比,HER3缺乏内在的激酶活性,但可与其他同家族受体结合引发癌细胞的增殖、侵袭和耐药,这与NSCLC患者存活率下降显著相关[22]。研究表明,约50%的NSCLC脑转移存在EGFR、HER2或HER3的过表达,且HER3的配体NRG-1在脑中也高表达,进一步表明HER3在癌细胞转移中扮演重要的角色[23]。EGFR突变是临床上NSCLC最常见的致癌突变之一,HER3可通过与突变的EGFR结合,从而被反式磷酸化并激活,介导PI3K/AKT通路,引起肿瘤的发生和发展[24]。
NRG1作为HER3的配体,在不同类型的癌症中表现出不同的表达水平,其中头颈部鳞状细胞癌和鳞状细胞肺癌呈现高水平表达,NRG1基因融合表达与NSCLC的发展相关[25-26]。NRG1的基因融合使肿瘤细胞表面EGF样结构域的NRG1异常表达,并诱导HER3异源二聚体的形成,从而激活PI3K/AKT、MAPK和其他信号通路,使肿瘤细胞异常增殖[27]。此外,有研究表明,肺癌患者中HER3高表达与NRG1基因融合显著相关[28]。
研究表明,HER3与NSCLC患者耐药密切相关。耐药性的产生机制通常涉及替代药物干预的代偿途径。HER3能与HER2、EGFR以及非HER家族的c-MET形成异源二聚体并强烈激活PI3K/AKT通路,这使得HER3能够启动代偿途径,引发耐药[29]。EGFR突变的NSCLC患者可以通过EGFR TKIs有效治疗,但大多数患者终会对其产生获得性耐药,其主要原因是继发性EGFR突变,以T790M突变最为常见[30]。此外,其他的耐药机制还包括编码其他受体酪氨酸激酶(receptor tyrosine kinase,RTK)的基因扩增,以及肝细胞生长因子(hepatocyte growth factor,HGF)及其受体c-MET或AXL蛋白过表达[31]。对EGFR TKIs敏感的NSCLC,PI3K/AKT通路的激活依赖于HER3信号转导,而EGFR TKIs可使其信号转导受阻和下游信号通路失活,从而起到抗肿瘤作用;但在TKIs耐药的NSCLC中,HER3对TKIs引起的信号通路失活具有拮抗作用[24]。研究表明当EGFR突变的NSCLC同时存在MET基因组扩增时,即使在EGFR TKIs的处理下,HER3仍能够通过与c-MET形成异源二聚体来替代HER3/EGFR维持HER3的持续激活,引发PI3K/AKT信号通路以抵抗细胞凋亡[32]。HER3表达上调是其参与EGFR TKIs耐药的另一种方式。研究表明,EGFR TKIs对HER3信号的抑制只能短暂下调HER3磷酸化,并且由于PI3K/AKT的抑制,反馈促进叉头状转录因子O(forkhead box O,FoxO)依赖性的HER3转录,上调了HER3的表达[33]。HER3过表达可促使HER3磷酸化-去磷酸化反应平衡前移,导致HER3和AKT处于过磷酸化状态,这需要更高浓度的EGFR TKIs来完全解离异源二聚体或更有效的HER3靶向药物使HER3完全去磷酸化[34]。
HER3独特的生理特征和肿瘤发生机制使其可以作为治疗NSCLC的具有前景性的治疗靶点。
4 靶向HER3治疗NSCLC的抗体药物临床研究现状
HER家族成员在肿瘤组织中广泛过表达,同时在肿瘤的发生和发展过程中起着重要作用,HER家族的靶向治疗已成为肿瘤治疗中的研究热点。以往对HER家族成员的研究大多数集中在EGFR和HER2上,且已有多种靶向EGFR和HER2的靶向疗法被批准用于临床,而HER3由于缺乏强力的酪氨酸激酶活性,一直未被重视。但是随着研究的不断深入,HER3在肿瘤中的作用不断被发现并逐渐成为肿瘤治疗的热门靶点。
基于目前对HER3生物学的了解,有效的抗HER3治疗可以采用下列机制中的一种或几种组合:1)使HER3保持闭合构象;2)捕获HER3的配体NRG;3)阻断配体与HER3的结合位点;4)引发HER3内化;5)阻断HER3与其他HER家族成员的二聚化;6)利用免疫细胞杀死表达内源性HER3的癌细胞[35]。在当前的治疗模式中,临床开发的大部分HER3靶向治疗都属于抗体类,虽然还未获批上市,但是许多药物已处于临床开发的不同阶段(见表1)。下面将对与NSCLC相关的HER3靶向治疗抗体药物的临床研究现状进行简单阐述。
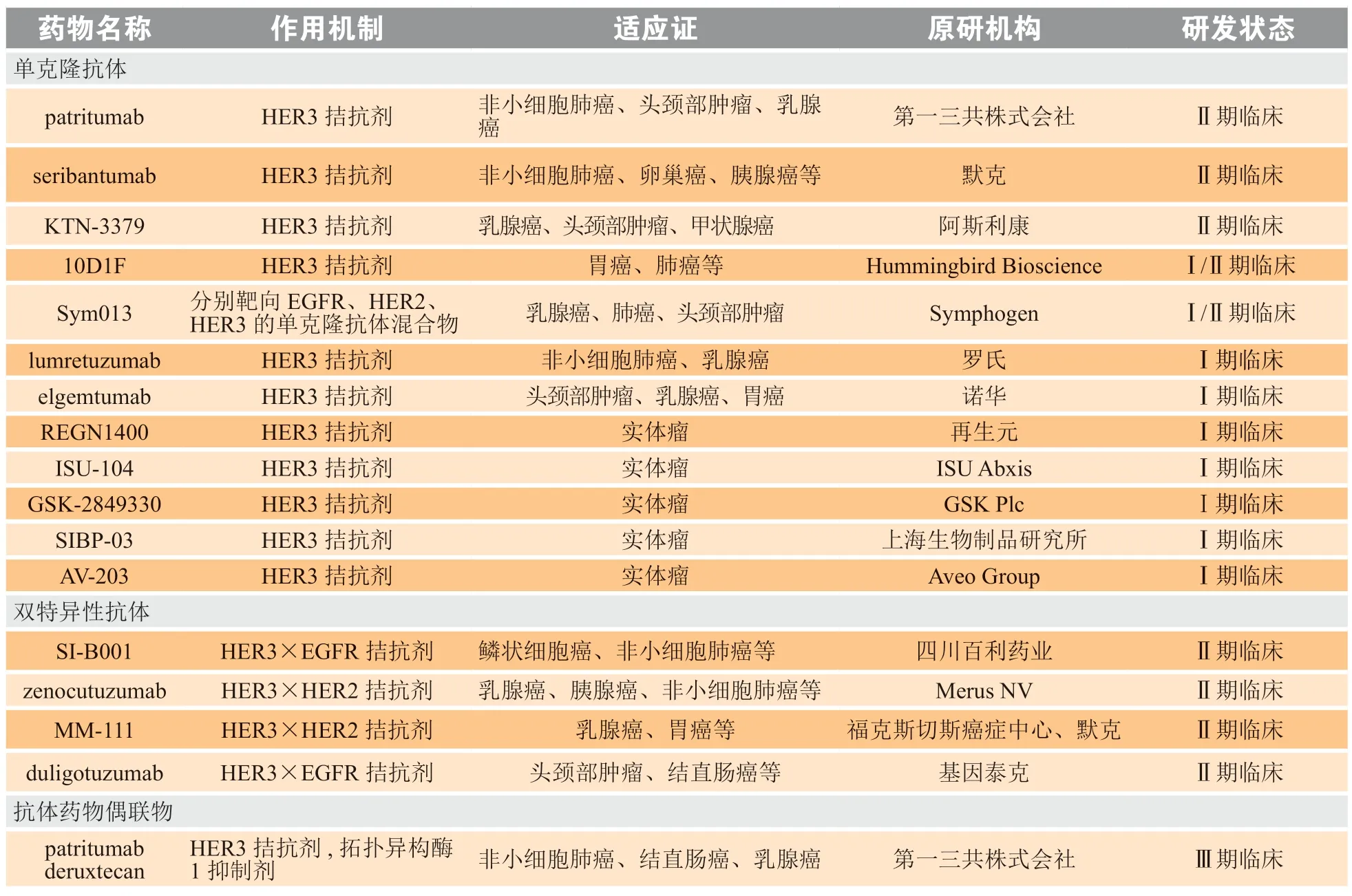
表1 处于临床研究阶段的抗HER3抗体类药物Table 1 Anti-HER3 antibody drugs under clinical investigation
4.1 单克隆抗体
Patritumab(U3-1287)是全人源化单克隆IgG1抗体,通过靶向HER3胞外结构域,阻断NRG与HER3的结合来阻止HER3异源二聚化,诱导HER3内化,从而抑制肿瘤增殖[25]。研究发现,Patritumab的抗癌效果取决于NRG的表达水平,且在异种移植瘤小鼠模型研究中观察到其对NRG高表达的NSCLC具有较好的抗癌疗效。此外,体内外实验表明,Patritumab能够有效克服因NRG-1过表达而产生的NSCLC耐药,其与EGFR TKIs联合治疗能够改善获得性耐药NSCLC患者的临床受益[36]。在与EGFR TKIs erlotinib联合治疗的Ⅰ期临床试验中,晚期NSCLC患者的客观缓解率(objective response rate,ORR)为4.2%,疾病控制率(disease control rate,DCR)为62.5%[37]。在patritumab与erlotinib联合治疗局部晚期或转移性NSCLC患者的Ⅱ期临床试验中发现,肿瘤中NRG mRNA高表达的患者,Patritumab + erlotinib 组的无进展生存时间(progression-free-survival,PFS)明显优于安慰剂+ erlotinib组[38]。当NSCLC患者血浆中含有高水平可溶性NRG时,Patritumab + erlotinib组表现出比安慰剂组更优的PFS[39]。然而,后续的patritumab 与erlotinib联合治疗的Ⅱ期随机临床试验在中期分析时被终止,可能是由于在NRG高表达的局部晚期或转移性NSCLC患者中,与安慰剂组相比,实验组没有表现出更优异的药效[40]。Patritumab联合erlotinib治疗局部晚期或转移性NSCLC患者的Ⅲ期临床试验因没能证实两药联用拥有更好的临床获益而被终止[41]。虽然patritumab能阻断NRG与HER3的结合,但HER3仍能通过配体非依赖途径与同家族成员形成异源二聚体而发挥作用。在部分EGFR突变的NSCLC中观察到突变的EGFR能够在HER3未与配体结合的情况下与之形成二聚体,激活下游信号通路,引起癌症发展,这可能是patritumab联合erlotinib临床试验失败的原因之一。
Seribantumab(MM-121)是靶向HER3的全人源化单克隆IgG2抗体,不但可以阻断NRG与HER3的结合,同时阻断HER3与同源家族蛋白形成异源二聚体,并诱导HER3内化和降解[42]。临床前研究数据表明,Seribantumab在各种类型的癌细胞系和患者来源的异种移植瘤模型中具有抗肿瘤活性,包括NRG1融合的肺癌、卵巢癌和胰腺癌[43]。Seribantumab治疗晚期或难治性实体瘤Ⅰ期研究表明其单药治疗在NSCLC在内的多种肿瘤类型中表现出良好的耐受性[44]。Seribantumab联合erlotinib治疗NSCLC患者的Ⅰ/Ⅱ期试验结果显示,Seribantumab + erlotinib组的PFS为8.1,ORR为4.7%,单药erlotinib组的PFS为7.7,ORR为5.6%,Seribantumab与erlotinib联用对延长PFS未表现出更优的效果[45]。此外,Seribantumab联合微管解聚抑制剂多西他赛(docetaxel)和叶酸拮抗剂培美曲塞(pemetrexed)治疗NRG高表达的NSCLC患者的Ⅱ期研究也因为未能改善PFS(实验组PFS为3.0,对照组PFS为4.0)且观察到较高的治疗突发性不良事件(treatment emergent adverse events,TEAE)而提前终止[46]。目前,Seribantumab治疗NRG1融合的晚期癌症患者的Ⅱ期临床研究正在进行。首批参与治疗的12位患者中有11位患有NCSLC,其中10位可评估疗效的患者的ORR为30%,DCR为90%,耐受性良好[47]。初步数据表明,在NRG1融合的晚期癌症患者中,Seribantumab表现出良好的抗肿瘤效果和安全性。
10D1F(HMBD-001)是靶向HER3的人源化IgG1抗体,该抗体能够有效结合HER3,阻断其与HER2/EGFR的异源二聚化,抑制PI3K等信号通路的激活,从而阻止肿瘤的增殖[48]。10D1F与HER3的结合既不依赖于NRG1的结合,也不受HER3受体构象的影响,能够利用新的作用机制更有效地抑制配体依赖和非依赖的HER3驱动的肿瘤增殖。临床前研究报道,10D1F单独使用时能有效抑制包括NSCLC在内的多种肿瘤细胞模型的增殖;同时,10D1F相比现有的抗HER3的抗体(如seribantumab)以及抗EGFR或抗HER2抗体更能有效抑制肿瘤细胞增殖。在NRG1融合的临床前模型中,与其他HER3靶向抗体相比,10D1F显示出更好的抑制肿瘤生长效果[49]。目前10D1F正处于Ⅰ/Ⅱ期临床阶段,主要评估其在包括NSCLC在内的晚期HER3阳性实体瘤患者中的疗效,探究10D1F单独或与其他抗癌药物联合使用的最高耐受剂量和潜在的不良反应,以及潜在的适应证[50]。
Lumretuzumab(RG7116)是靶向HER3的人源化IgG1抗体,能够阻止HER3的异源二聚化和磷酸化,并抑制下游信号通路[51]。Ⅰ期研究结果显示,其在晚期阳性实体瘤患者(包括3例NSCLC)中的DCR为21%[52]。而一项评估lumretuzumab联合卡铂和紫杉醇治疗鳞状组织晚期或转移性NSCLC的Ⅰb/Ⅱ期研究因疗效有限而被终止,并放弃在NSCLC 适应证上的后续开发[53]。
4.2 双特异性抗体
Zenocutuzumab(MCLA-128)是双特异性人源化IgG1抗体,包含2个不同的Fab臂,分别靶向HER2和HER3的胞外结构域,通过独特的锚定方式(HER2臂)和阻断机制(HER3臂)阻止NRG1与HER3结合、并阻止HER3与HER2以及EGFR异源二聚化、阻断HER3磷酸化和下游信号传导[54]。此外,糖工程修饰的IgG1增强了对Fc受体的亲和力,从而增强抗体依赖细胞介导的细胞毒作用(antibody-dependent cell-mediated cytotoxicity,ADCC)和补体依赖的细胞毒性(complement dependent cytotoxicity,CDC)效应。其临床前研究显示,Zenocutuzumab能有效阻断NRG1融合的肺癌细胞系和异种移植瘤模型下游增殖信号的传递,诱导细胞凋亡,抑制NRG1重排驱动的细胞和肿瘤的生长[55]。Ⅰ期结果显示,Zenocutuzumab具有良好的安全性和耐受性[56]。目前,针对NRG1融合阳性癌症(包括NSCLC)的全球多中心Ⅰ/Ⅱ期临床试验正在进行[57]。截至2022年1月12日,共有99例NRG1阳性患者(含NSCLC 41例)参与,其中71例可评估患者的ORR为34%(NSCLC ORR为35%)。Zenocutuzumab在晚期NRG1阳性患者中表现出优异且持久的疗效,具有良好的耐受性。
SI-B001是靶向EGFR和HER3的双特异性IgG1抗体,通过抑制配体诱导的EGFR同源二聚体和EGFR/HER3异源二聚体的形成及其下游信号通路的激活,同时诱导EGFR和HER3内吞,下调细胞表面EGFR和HER3的表达水平,从而起到抗肿瘤的作用[58]。在临床前研究中,SI-B001具有优异的肿瘤增殖抑制活性。其Ⅰ期临床试验显示了良好的安全性和初步疗效[59]。目前一项多中心、开放标签的Ⅱ期临床研究正在招募接受过抗PD-1单抗(部分患者同时接受铂类化疗)治疗进展的局部晚期或转移性EGFR/ALK WT NSCLC患者,探究SI-B001在最佳联合化疗剂量下对患者的安全性和有效性[60]。此外,评估SI-B001联合奥西替尼(osimertinib)治疗局部晚期或转移性NSCLC的安全性和有效性的Ⅱ/Ⅲ期临床研究正在进行[61]。
4.3 抗体药物偶联物
Patritumab Deruxtecan(U3-1402)是由靶向HER3的全人源化IgG1抗体(patritumab)通过稳定的四肽基可切割连接子连接拓扑异构酶Ⅰ抑制剂(DXd)组成的抗体偶联药物,具有饱和的药物-抗体比(drug to antibody ratio,DAR),DAR为8,能够特异性结合人HER3,阻断配体结合,减弱HER3介导的信号传导,同时可诱导HER3内化,并在内化后通过连接子裂解释放有效载荷,致使癌细胞因DNA损伤而发生凋亡[62]。研究表明,Patritumab Deruxtecan的抗肿瘤活性作用主要是依赖HER3内吞介导的杀伤,而HER3信号阻断效果有限[63]。Haratani等[64]发现Patritumab Deruxtecan与PD-1抑制剂能够表现出协同作用增强抗肿瘤效果,其能够提高分化决定族抗原8阳性(cluster of differentiation 8+,CD8+)肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TIL)和相关免疫细胞的功能,从而增强了对肿瘤增殖的抑制。临床前数据表明,Patritumab Deruxtecan单独或联合EGFR TKIs在体外生长抑制实验和体内异种移植瘤小鼠模型中对gefitinib(EGFR TKIs)耐药的HCC827GR5细胞显示了极强的抗癌功效,且联合使用相较单独治疗更为有效[65]。Ⅰ期临床数据显示,在Patritumab Deruxtecan 治疗下的EGFR突变的NSCLC患者,ORR为25%,DCR为70%,其毒性可耐受,未发生与治疗相关的TEAE[66]。Ⅰ期剂量递增/扩展研究结果表明,Patritumab Deruxtecan具有显著的抗肿瘤活性,该研究的患者群体为既往接受EGFR-TKIs治疗的局部晚期或转移性EGFR突变NSCLC患者,其ORR为39%,中位PFS为8.2个月,安全性可控[67]。目前,一项Ⅰ期临床研究正在开展,评估Patritumab Deruxtecan联合osimertinib治疗晚期EGFR突变的NSCLC患者(患者均经过一线药物osimertinib治疗后仍有进展)的疗效、安全性及耐受性[68]。同时,Ⅱ期研究(NCT04619004)将进一步评估Patritumab Deruxtecan在接受过EGFR TKIs治疗和铂基化疗后仍有进展的转移性或局部晚期的EGFR突变NSCLC患者中的疗效[69]。此外,一项Ⅲ期临床研究正在招募,在EGFR TKI治疗失败后的转移性或局部晚期EGFR突变的NSCLC患者中对比Patritumab Deruxtecan与铂基化疗的疗效[70]。
5 结语与展望
作为近年来较为热门的靶点之一,HER3与多种癌症有着密切的联系,其在癌症治疗和获得性耐药中的作用引起了相当大的关注。HER3靶向治疗已被证明是克服NSCLC获得性耐药的有效方法,并能显著增强化疗药物的抗肿瘤活性。虽然目前尚未有HER3靶向治疗药物上市,但是许多HER3靶向治疗药物的临床试验正在进行,并且部分试验显示出优异的效果。尽管阻断HER3能够解决部分NSCLC耐药问题,但未来的研究仍需考虑抗HER3药物耐药性的产生。靶向治疗正在改变NSCLC的治疗模式,为患者提供新的选择。相信随着对HER3研究的不断深入,靶向HER3的治疗方式将会为NSCLC的靶向治疗和逆转获得性耐药带来新的希望。

