MOFs 在高级氧化降解环境污染物中的应用进展
花雨薇,刘广洋,刘中笑,吕 军,徐东辉,张延国
(中国农业科学院蔬菜花卉研究所,农业农村部蔬菜质量安全控制重点实验室,农业农村部蔬菜产品质量安全风险评估实验室,北京 100081)
随着工业化的快速发展,环境污染问题日益严重,污染带来的一系列生态和安全危害不容忽视。环境中的污染物种类繁多且存在于水源、空气、土壤等各种地方,常见的环境污染物有重金属、染料、抗生素药物残留、农药残留、持久性有机污染物等,影响动植物生长发育,直接或间接影响人类的生存。因此,对环境污染物的处理已成为当今环境保护中的重要一环。已有的降解环境污染物的方法包括微生物降解、超声波、光催化、化学沉淀、吸附等〔1-2〕,但大多方法具有反应条件要求高、成本高、产生二次污染等缺陷。
高级氧化(AOPs)是指在催化剂、光、电等外界条件下,通过产生强氧化性自由基(如·OH、SO4·-等)来降解目标污染物的技术〔3-4〕。高级氧化降解效率高、适用范围广、操作简单、成本较低,可将多种污染物降解成危害更小的物质。高级氧化中最经典的方法是Fenton 法,但传统Fenton 体系具有成本较高、后续处理较复杂、pH 适用范围窄等问题〔5-6〕。为了解决这些问题,过硫酸盐体系、光催化体系等已逐渐成为研究热点。
MOFs 材料是由金属离子或金属簇作为次级建筑单元(SBUs),和有机桥联配体通过氢键、配位键、静电等相互作用组装成的具有复杂网络结构的周期性固体材料〔7-8〕。根据金属和有机分子能构成稳定且具有机械强度的框架这一特性,通过控制孔隙大小、形状可以对配体进行选择设计以达到不同目的〔9〕。MOFs 具有比表面积大、孔隙率高、成本低〔10〕等优点。现今,MOFs 材料已在环境保护〔11〕、电力工业〔12〕、生物医药〔13〕和传感〔14〕等多个领域表现出巨大优势和应用前景。
MOFs 中不同金属配体可在高级氧化中起到不同的催化作用,其催化机制类似于传统高级氧化中游离金属离子的催化作用。但由于与高级氧化的协同作用,MOFs 比游离金属离子更具催化优势。传统均相体系可能会导致金属部分严重损耗,造成环境污染,而结合了MOFs 的高级氧化属于非均相高级氧化体系,其可以一定程度解决该问题。笔者对MOFs 的分类、合成策略以及高级氧化的原理进行了介绍,并在此基础上总结了MOFs 及其复合物在高级氧化体系中的应用进展,最后提出了该体系的现有挑战及发展前景。
1 MOFs 的分类及制备方法
1.1 MOFs 的分类
MOFs 通常有ZIFs(Zeolitic imidazolate frameworks)、MILs(Matériaux institut lavoisier metal-organic framework)、IRMOFs(Isoreticular metal-organic frameworks)、PCN(Polymeric carbon nitride)等类型,这些类型的MOFs 均是由金属离子或金属簇和有机桥联配体组装而成,且各有特点。
ZIFs 通常是由Zn2+或Co2+作为金属配体,2-甲基咪唑作为有机配体的一类MOFs。常见的ZIFs 有ZIF-67、ZIF-8 等。ZIFs 不仅具有高孔隙率以及良好的热和化学稳定性等优点,还具有多种拓扑结构,为催化的选择优化提供了基础。此外,ZIFs 合成时不需使用其他MOFs 合成时常用的有毒有机溶剂N,N-二甲基甲酰胺(DMF),可在环境条件下快速合成。
MILs〔15〕通常是由Cr3+或Fe3+作为金属配体,对苯二甲酸作为有机配体的一类MOFs。常见的MILs 有MIL-101、MIL-53 等。虽然MILs 与其他MOFs 相比表面积较低,但其具有易合成、呼吸特性、高化学稳定性及无毒的金属中心等优势〔16〕。
IRMOFs 由芳香羧酸——2-氨基对苯二甲酸连接锌氧络合物组成。常见的IRMOFs 有IRMOF-1(即MOF-5)、IRMOF-3 等。IRMOFs 具有简单的孔道结构、较强的荧光特性〔17〕,可选配体种类也很丰富。
PCN(卟啉MOFs)是由卟啉或金属卟啉作为有机配体与金属簇连接形成。常见的PCN 有PCN-222、PCN-223 等。因具有优异的捕获光的能力,PCN 在光催化中具有广阔前景〔18〕。
MOFs 的分类见表1。
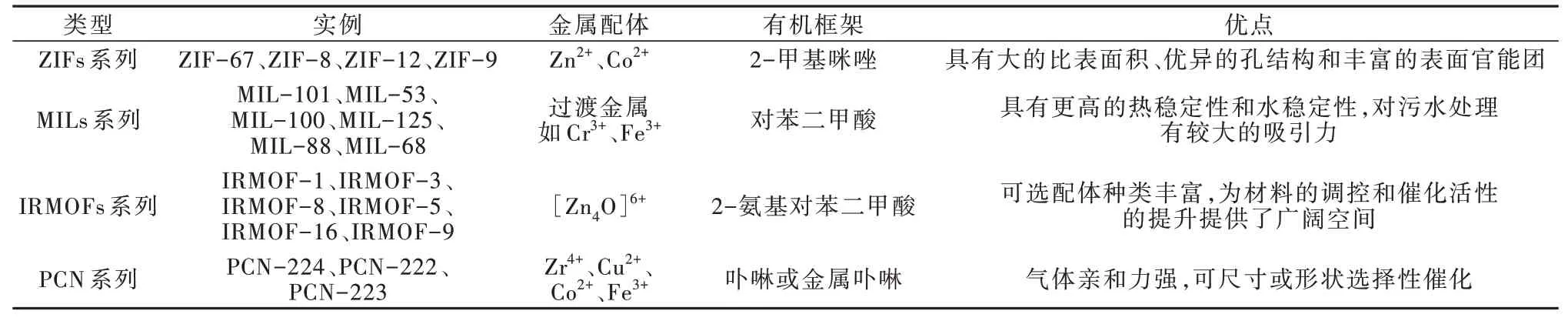
表1 MOFs 的分类Table 1 The classification of MOFs
1.2 MOFs 的制备方法
选择合适的有机配体是决定MOFs 性能和结构的关键〔19〕。即使加入相同反应物,由于合成方法的不同,也会在反应时间、产率、颗粒大小和形态等方面产生很大不同〔20〕。
1.2.1 传统合成方法
水热/溶剂热法是目前最常用的一种合成MOFs的方法,是将分散在水或有机溶剂中的金属盐和有机配体置于高压釜中进行热处理的方法〔20〕。水热法适用范围小,只限于水稳定性好的化合物的反应。溶剂热法是在水热法基础上发展而来,大多数MOFs 都可以采取这种方法。溶剂的极性和与水的亲和力显著影响合成过程〔8〕。S. MASOUMI 等〔15〕利用溶剂热法合成了MIL-53,首先将六水氯化铁、对苯二甲酸、DMF 搅拌混合后转移到高压釜中,150 ℃加热6 h,冷却后收集产物;随后将产物在蒸馏水中搅拌去除溶剂,最后离心干燥。溶剂热法会导致溶剂分子进入网络,后续去除溶剂又会导致网络崩溃〔21〕。
离子热法与溶剂热法的最大区别是可在常压下进行〔22〕。离子热法采用离子液体(Ionic liquids,ILs)替代分子溶剂,离子液体的手性与是否亲水对形成MOFs 骨架结构有巨大影响。离子液体在MOFs 结构形成过程中,不仅可以作为溶剂运输反应物,同时其中的阴离子还可以与金属离子配位作为反应物〔8〕。虽然离子热法有一些缺陷,如有机溶剂消耗量大、工艺耗能高等〔19〕,但由于用离子液体代替溶剂可以降低溶剂竞争,且离子液体可回收重复利用,因此具有一定优势。离子热法一般要在合成材料前先合成离子液体,然后在离子液体中加入反应物质,放入反应釜中加热,清洗干燥,后续步骤基本和溶剂热法一致。张利军〔23〕使用离子热法合成了MOFs,首先将脱气的丁基溴和重新蒸馏的N-甲基咪唑混合搅拌加热,回流得到离子液体;随后将离子液体和均苯三甲酸混合均匀后在反应釜中180 ℃反应3 d,洗涤、干燥后得到材料。
机械化学法是指通过机械力实现化学反应的方法,在反应过程中不需要添加溶剂,直接产生粉末状产物,且不需要复杂耗时的后续处理〔24〕。相较溶剂法,该方法可以解决溶剂分子残留在网络中的问题。机械化学法还具有反应时间短、反应条件温和、副产物易去除、环境污染减少、成本降低等优点〔25〕。机械化学法一般在球磨机中进行,将反应物粉末放入机器中研磨以合成所需材料,研磨过程中要避免加热反应物。机械化学法也可进行液体辅助研磨,一般使用甲醇、水、DMF 等液体〔26〕,使用不同辅助液体会导致MOFs 结构不同。N. K. SINGH 等〔27〕通过机械化学法合成了钇基MOFs,将质量比1∶1 的均苯三甲酸和氢化钇混合不锈钢球装入充氩气的不锈钢研磨瓶中球磨,使用强制空气冷却以避免研磨过程中升温,最后直接收集粉末即可得到产物。
溶剂热法、离子热法和机械化学法〔28〕的合成过程见图1。

图1 MOFs 的传统合成方法Fig. 1 Traditional synthesis methods of MOFs
1.2.2 高级氧化MOFs 复合材料的合成方法
可以直接采用合成的MOFs 催化高级氧化反应,也可以对现有MOFs 进行改性使MOFs 更贴合催化高级氧化的功能。 Xinxin YUE 等〔29〕合成的Fe3O4@MIL-101(Fe),使用的是以六水氯化铁和三水醋酸钠为原料,加入乙二醇中形成胶体混合物,然后将混合物置于高压釜中160~180 ℃反应10 h 的方案。
除直接合成外,还有分别合成不同复合部分的方案。Chaohai WANG 等〔30〕在合成ZIF-67/PAN 复合催化剂时,先合成常规ZIF-67,然后将其分散到DMF 中,65 ℃搅拌4 h 后加入聚丙烯腈(PAN)获得电纺前体,然后进行电纺丝过程。Longxing HU 等〔31〕合成的Mn3O4@ZIF-8,是先按常规方法合成ZIF-8,然后将ZIF-8 分散到乙醇中,再加入高锰酸钾搅拌至溶解,将混合物置于高压釜中120 ℃反应8 h,合成带有Mn3O4的复合物。以上方法均是先合成MOFs,再复合其他材料,还可调换两者的合成顺序。Lizhang HUANG 等〔32〕合成rGO@NH2-MIL-125 时,先制备氧化石墨烯(GO)并将其分散到甲醇中,再与钛酸四丁酯、氨基苯-1,4-二羧酸酯、DMF 混合均匀后置于高压釜中120 ℃反应,得到rGO 与NH2-MIL-125 的复合材料。
多金属MOFs 一般不涉及多个复合物的合成,只需在传统合成方法上稍做改进,一般是在单一金属盐基础上增添其他金属盐。Ruowen LIANG 等〔33〕利用3 种金属(Au、Pd、Pt)分别复合MIL-100(Fe),首先将金属前驱体溶于水,再将MIL-100(Fe)、金属离子溶液和乙醇混合物置于石英小瓶中除去溶解氧后,在可见光下照射60 min。He LIANG 等〔34〕制备的MIL-101(Fe,Co)只需在合成MIL-101(Fe)的六水氯化铁与对苯二甲酸的混合溶液中加入硝酸钴进行同样的反应即可。除普通双金属MOFs 外,还有对双金属MOFs 继续处理以获得更高效的催化剂的方案,He LIANG 等〔35〕制备了具有协同配位的不饱和金属位点(CUMSs)的CUMSs@MIL-101(Fe,Cu),首先将六水氯化铁、三水硝酸铜和对苯二甲酸溶解在DMF 中,再移入高压釜中110 ℃反应20 h;为了获得材料中的CUMSs,还需将合成好的粉末材料置于300 ℃的氩流管式炉中热处理1 h。
2 高级氧化的降解原理
均相高级氧化体系条件易实现,但均相Fenton存在pH 适用范围窄、后续处理复杂〔36〕等问题,均相过硫酸盐体系存在催化效率低等问题。发展其他高级氧化体系是促进该技术进一步完善发展的关键。引入MOFs 的高级氧化体系属于非均相体系,能够解决上述问题。
2.1 Fenton 降解原理
传统Fenton 体系是指以二价铁作为催化剂的体系,类Fenton 体系是指以铜、银、镍等其他金属离子代替二价铁的体系。MOFs 作为比表面积大的多孔材料,本身就对环境污染物有吸附作用,并且MOFs材料上的金属簇更有利于催化降解吸附在其上的污染物。MOFs 中分散的金属位点可作为类Fenton 反应中H2O2的活性位点,虽然一部分金属与有机配体成键,但仍有不饱和金属位(CUS)可起到和游离金属离子类似的催化效果。不仅如此,CUS 还可以显著促进MOFs 与可催化物质的相互作用,促进MOFs与目标物的氧化还原反应〔36〕,如Fenton 反应可由Fe-MOFs 中的Fe 催化H2O2产生·OH〔37〕,以降解目标物。在大多数MOFs 材料中,金属位通常与有机配体几乎完全配合,阻碍了对H2O2的吸附和活化,因此促进MOFs 中不饱和金属位点的产生以暴露更多活性位点成为主要研究方向。Qiangshun WU 等〔38〕利用MIL-101(Fe)作为Fenton 催化剂降解盐酸四环素,通过Fe(Ⅱ)/Fe(Ⅲ)循环实现对Fenton 体系的催化,有效解决了传统Fenton 体系的种种问题,主要涉及以下反应〔39〕:
Fenton 体系反应过程见图2。
除了作为传统Fenton 技术的催化剂,MOFs 也表现出无机半导体的特性,具有光稳定性,可以起到光催化作用,因此可以作为引发光Fenton 的催化剂。MOFs 材料中的有机配体可以吸光,金属配体具有类似半导体的特性,可以进行光激发;有机配体作为光子接收器采集光后,递送给金属离子进行光敏化,最终完成光催化〔39-40〕,因此MOFs 在光催化联合的高级氧化反应中尤为高效。相对于大多数无机材料只能在紫外光照射下降解有机污染物,MOFs 材料的有机配体因可以捕捉更广范围的光,而成为高效催化剂〔41〕。Qiangshun WU 等〔38〕对MIL-101(Fe)/H2O2在可见光下的协同效应进行了分析,该体系不仅具有MOFs 基催化剂的优势,同时光生载流子的有效分离和迁移有助于加速Fe(Ⅱ)/Fe(Ⅲ)的循环;作用机制为光催化剂被能量等于或大于其带隙的光子照射,激发电子从价带迁移到导带,在价带中产生空穴,具有强氧化能力的光生空穴可直接氧化吸附的有机分子或氧化H2O 和OH-生成·OH。
2.2 过硫酸盐体系的作用原理
MOFs 对过硫酸盐(PS)体系的基本催化原理与MOFs 对Fenton 体系的作用类似,即MOFs 中的不饱和金属位点起到催化作用。Xinxin YUE 等〔29〕合成的Fe3O4@MIL-101(Fe)在过硫酸盐体系中降解酸性橙7 的效率明显高于试验中的其他体系,其机制不仅是由于MOFs 较大的比表面积和孔径,还因为过硫酸盐体系可以释放出比·OH 活性更强的,且体系中同时存在·OH,二者协同氧化极大提升了体系的降解效率。在Xianghui LI 等〔41〕构建的醌改性NH2-MIL-101(Fe)复合物降解双酚A 体系中,和都是双酚A 降解的原因,因为的氧化还原电位高于·在接近中性的pH 环境中比·OH 更易发生高级氧化反应,因此是起主要作用的自由基。过硫酸盐的—O—O—键断裂可以产生氧化性更强的,从而实现对污染物的降解;过一硫酸盐(PMS)脱去一个OH-,形成过二硫酸盐(PDS)在金属催化时,生成一个和一个〔式(10)〕。
过硫酸盐体系反应过程〔42〕见图3。
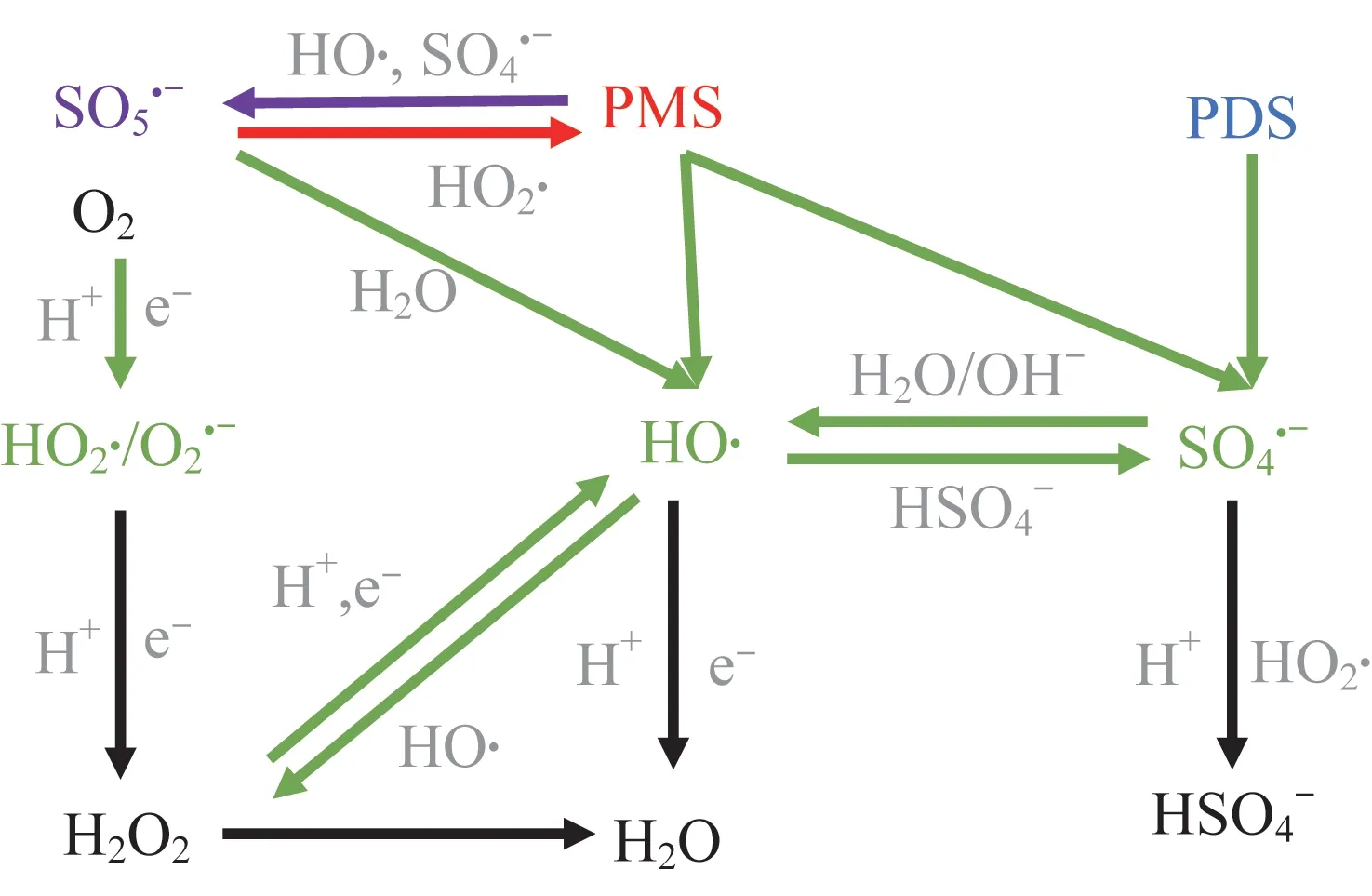
图3 过硫酸盐体系反应过程Fig. 3 Reaction process of persulfate system
3 MOFs 结合高级氧化的应用进展
MOFs 及其复合物已被广泛应用于催化降解污染物。现今的研究方向不仅可以从MOFs 的金属基种类出发,还可以将其他材料与MOFs 复合以提升催化性能,以及联合其他催化方法进行协同催化。
3.1 单金属MOFs
传统Fenton 反应是由铁离子催化,零价铁和铁氧化物已应用于催化Fenton 反应中,但是该反应存在材料易团聚、易被氧化等缺陷,铁基MOFs 的出现很大程度解决了此问题。铁基MOFs 是一类基础的MOFs 材料,已广泛应用于催化Fenton 反应,大多数铁基MOFs 是由三价铁与对苯二甲酸等有机羧酸形成的MILs〔43〕。Qiangshun WU 等〔38〕利用经典的MIL-101(Fe)通过类Fenton 反应催化降解盐酸四环素,由H2O2在铁活性位点产生的·OH 是主要活性成分,该体系具有较广的pH 适用范围,在pH 为4.1~10.2 时,20 min 内盐酸四环素的去除率均大于80%;与之前报道的非均相类Fenton 反应(3.0~6.0)相比,该体系向高pH 方向延伸明显扩大。铁基MOFs 不仅可以催化Fenton 体系,也可在过硫酸盐体系中充当催化剂。Mengjie PU 等〔44〕利用溶剂热法合成了MIL-53(Fe)并在过硫酸盐体系中降解橙黄G,虽然合成温度以及pH 对降解效果产生了影响,但是优化条件后该体系可将染料完全降解。
除Fe 基外,具有过渡金属元素的MOFs 也可参与高级氧化反应,典型的Cu、Co 基MOFs 被研究最多。一般来说催化能力:V(Ⅳ)>V(Ⅴ)>Ag(Ⅰ)>Cu(Ⅱ)≈Fe(Ⅱ)>Fe(Ⅲ)≈Mn(Ⅱ)。Cu 涉及的激活途径最为多样,可以通过激活PMS/PDS,诱导自由基、Cu(Ⅲ)、表面活化过硫酸盐、单线态氧等多种方式参与反应〔45〕。Lijuan HAN 等〔46〕合成了一种五配位的铜化物以降解甲基橙和刚果红,15 min 即可降解85%的目标物;该材料为催化氧化提供了不饱和配位点,仅需加入少量H2O2即可产生大量·OH,对试验染料具有优异的催化活性;该材料中的羧基基团中未配位的氧原子还可以与染料中的氨基基团发生氢键作用而更有效地降解染料。Co 在活化PDS 时产生活性氧的反应活性较低,大多是关于活化PMS的研究。Huanhuan LI 等〔47〕通过水热法合成了Co 基咪唑配体金属有机配合物,该材料具有1D 梯形链结构,在类Fenton 体系降解刚果红中表现优异。Xiaoxiao WANG 等〔48〕同样合成了基于二甲基苯并咪唑和联苯二羧酸的Co 基化合物并降解刚果红,刚果红降解率可达98%。
3.2 双金属MOFs
加入不止一种金属的MOFs 还可以有效解决MOFs 部分金属位与有机配体结合时由于存在空间阻挡而导致的金属位参与催化时效率降低的问题。He LIANG 等〔35〕采用改进的溶剂热法制备了CUMSs/MIL-101(Fe,Cu),并对其进行热处理;热处理可以在MOFs 中生成不饱和金属位(CUMSs),大大增强了材料对目标物H2O2的吸附,提升了催化效率;单一铁基MOFs 存在Fe(Ⅲ)向Fe(Ⅱ)还原过程缓慢的问题,该问题是影响催化效率的重要因素,而该材料中加入Cu 形成了双金属MOFs,通过Cu(Ⅰ)为Fe(Ⅲ)提供一个电子形成Fe(Ⅱ)而一定程度解决了上述问题;实验证明带有不饱和位点的双金属MOFs 的催化效率大于单一铁基MOFs 和只有不饱和金属位或只有双金属的MOFs。该研究者还合成了另一种双金属MOFs 材料——MIL-101(Fe,Co),其表现出对环丙沙星极高的降解率〔34〕;该实验引入密度泛函理论证明了Co 的引入有利于苯环周围缺电子中心和Fe/Co 周围富电子中心的形成,这种机制可以有效降低活化H2O2所需的能量。
3.3 复合MOFs 材料
虽然MOFs 非均相催化已经解决了传统高级氧化中的很多问题,但单一MOFs 本身也有一些不足,如某些MOFs 稳定性差、机械强度弱等问题,严重影响了MOFs 在高级氧化中催化潜力的发挥〔49〕。因而与MOFs 相关的复合材料相继出现。Longxing HU等〔31〕采用溶剂热法制备了环境友好的Mn3O4负载ZIF-8,并用于活化PMS 降解水中污染物罗丹明B,Mn3O4与ZIF-8 质量比为1∶2 时该材料对罗丹明B 的催化效率最高,最高降解率约为98%,高于单一材料的催化效果。Chaohai WANG 等〔30〕将ZIF-67 固定在静电纺丝PAN 上合成了ZIF-67/PAN 并用以催化降解酸性黄17,ZIF-67/PAN 对酸性黄17 的降解能力远高于实验中其他催化剂;因PAN 纤维的静电作用,该材料便于回收,且可保持较高的稳定性。磁性MOFs 不仅提高了MOFs 的分散程度,抑制了其聚集,而且控制了其内部结构、形态及尺寸,从而提高了材料的热稳定性,增强了物理化学性质〔50〕;磁性MOFs 还有利于材料的分离再利用〔51-52〕。Xinxin YUE 等〔29〕合成了磁性MIL-101(Fe)并用于催化去除酸性橙7,该材料对酸性橙7 的去除效率比单纯的Fe3O4和MIL-101(Fe)均显著提高,且重复利用性较好。还有一些价格更为低廉的材料,如石墨烯,其与MOF 的结合不仅可以提升催化效率,还可以降低成本。石墨烯光催化特性优良,可以延长光生电子-空穴对的持续时间,增强光吸收范围与光吸收强度〔32〕。Caihong ZHANG 等〔53〕同样使用溶剂热法合成了石墨烯(GR)复合MOFs——GR/MIL-53(Fe),并用于在H2O2体系中降解罗丹明B,该材料的光催化活性明显高于单MIL-53(Fe)-H2O2体系;这是由于GR 提高了有效界面的接触率,从而促进了电荷转移。Lizhang HUANG 等〔32〕采用溶剂热法合成了氨基化的rGO/NH2-MIL-125(Ti)(rGO/NMTi)杂化纳米复合物,由于rGO 与NMTi 的协同作用以及Ti3+和Ti4+的层间电子转移,该复合材料在光催化降解甲基蓝中表现得比单一物质更好。
3.4 联合活化方式
除了复合多个材料以提升体系的催化性能,还可以联合其他活化方式(如光催化)来提高体系对污染物的降解效率。Huifen FU 等〔54〕在室温下使用Fe3+与富马酸制备了MIL-88A 来催化降解罗丹明B以及双酚A,在可见光照射下MIL-88A 产生光生h+和e-,h+与H2O2反应生成·OH,e-与溶解氧反应生成O2·-,h+、·OH 和O2·-均可氧化有机污染物;然而在H2O2不存在的情况下,材料的催化效率受到限制。虽然关于MOFs 光催化的应用研究已经很广泛,但MOFs 材料仍存在光学性能低下、量子产率较低、太阳能转化率较低等问题〔55〕,为增强其光催化效率,已有利用贵金属作为共同催化剂的研究。Ruowen LIANG 等〔33〕分别将Au、Pd、Pt 固定在MIL-100(Fe)上以降解甲基橙及铬离子,相比单一MIL-100(Fe),复合材料在可见光照射下对甲基橙的光催化降解和铬离子的还原均表现出增强状态;同时,贵金属作为催化剂还提高了光照射下电荷分离的效率,从而增强了可见光的光驱动效力;在3 种金属中,Pt 对光活性的增强尤其显著。
目前对于多种方法联合的活化方式还有待研究。Hongying ZHAO 等〔56〕联合了光催化、电催化、双金属以及复合其他材料改性的四重方法,制备了光电Fenton 的新型(2Fe/Co)MOFs/碳气凝胶,该材料集合了光电催化的优点,可利用太阳能,且可在碳气凝胶阴极连续原位生成H2O2,可完全降解罗丹明B;即使在酸性介质中,该材料的Fe、Co 浸出率也非常低,且在pH 为3~9 的范围内均可保持有效降解率。
MOFs 在高级氧化中的应用总结见表2。
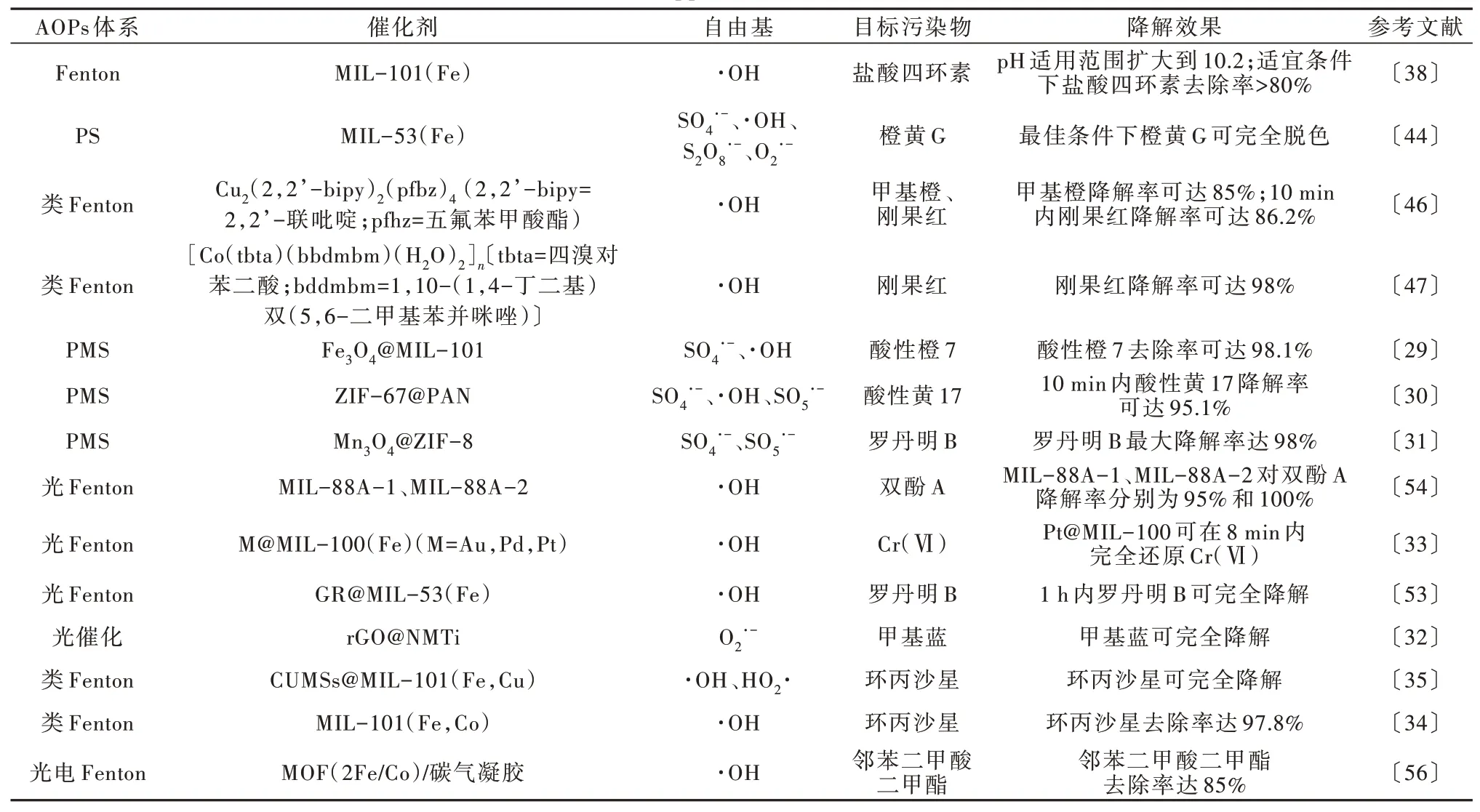
表2 MOFs 在高级氧化中的应用Table 2 The application of MOFs in AOPs
4 结语与展望
MOFs 作为金属基团和有机配体结合的产物可以拓宽高级氧化的应用范围,与其他化合物复合还可以为高级氧化体系带来其他优势。但是MOFs 在高级氧化中又引入了机械强度差、稳定性低、不饱和金属位数量少等问题。今后MOFs 材料在高级氧化中的发展趋势可以考虑以下几方面:
1)提升MOFs 性能。有机配体的存在使得MOFs 在热处理、化学稳定性等方面的性能不如沸石等无机多孔材料〔38〕,继续优化MOFs 的合成方案必不可少。
2)设计复合材料。已有很多关于添加其他化合物形成复合物以及增加金属位点的研究,但是不同化合物赋予了材料不同的性质,复合其他化合物提高MOF 材料性能还有广阔的研究空间。
3)在高级氧化中联合多种催化方式。目前针对光催化MOFs 的高级氧化体系已有大量研究,但是联合其他催化方式,以及联合多种提升催化性能的方法的高级氧化体系还尚待研究。

