广西某猪场猪伪狂犬病病毒的分离鉴定
莫红芳,何东贤,熊晓妍,覃振斌,石德顺,石宗承*
(1.广西农业职业技术大学,广西南宁 530007;2.广西大学,广西南宁 530004;3.中国农业科学院哈尔滨兽医研究所,黑龙江哈尔滨 150069)
猪伪狂犬病(Pseudorabies,PR)是由伪狂犬病病毒(Pseudorabies virus,PRV)引起多种家畜、野生动物感染的一种以发热、奇痒(猪除外)和脑脊髓炎为主要特征的急性、高度致死性传染病[1],我国将其列为二类动物传染病[2]。PRV属于疱疹病毒科,宿主范围广泛,可以感染并导致多种哺乳动物发病[3]。猪(包括家猪和野猪)是感染PRV后可以存活的唯一物种,成为该病毒的贮存宿主和传染源[4]。不同年龄阶段的猪感染PRV表现出不同的临床症状。新生仔猪易出现神经症状、呕吐、腹泻、生长不良甚至急性死亡,病死率高;架子猪和大猪感染后表现发热、呼吸道症状,但多能耐过,呈隐性感染并终生带毒、排毒;母猪和种公猪感染易引发繁殖障碍,导致母猪配种返情率上升,妊娠母猪流产,产木乃伊胎、死胎和病弱仔等[5]。患病猪可持续不断地向外界排毒,被PRV污染的器械和工具也是重要的传播媒介[5]。由于PRV能侵入仔猪的免疫系统引起免疫抑制,导致仔猪免疫力降低,易引发多种病毒、细菌的继发感染,给养猪企业造成了严重的经济损失,成为各国检疫和防疫的重点对象[6]。
猪伪狂犬病呈世界性流行,我国是PR高发、频发地区[3],PRV gE基因缺失疫苗(如Bartha株)有效控制了该病在我国的流行。但自2011年以来,出现了高致病性的PRV变异株,传统疫苗失去了防护作用,导致多地区的猪场陆续爆发了不同规模的猪伪狂犬病疫情[7]。研究发现,PRV变异株的病原特征与PRV传统株相同,但其某些基因(gB、gE和gD等)与PRV传统株对应的基因序列有很大差别[7]。此外,近几年开始陆续出现PRV感染人的案例报道,感染者发生急性脑炎和眼内炎,并伴随严重的神经系统后遗症,引起了国内外专家学者的广泛关注[3]。本研究从广西贵港某猪场病死仔猪的脑组织和扁桃体中分离到一株PRV,进行了组织半数感染量(50% tissue culture infective dose,TCID50)测定和动物回归试验,以期为今后广西地区猪伪狂犬病的流行病学调查及临床防治提供参考。
1 材料与方法
1.1 材料
1.1.1 病料、细胞株和试验动物 广西贵港某疑似发生猪伪狂犬病猪场的15日龄病死仔猪2头,无菌采集其脑组织、扁桃体共4份病料;PK-15细胞株由广西大学亚热带农业生物资源保护与利用国家重点实验室保存;6周龄昆明小鼠,购自广西医科大学实验动物中心。
1.1.2 主要试剂 2×rTaqMix、LATaq酶、DNA标准DL 2 000,宝生物工程(大连)有限公司产品;Super Red核酸染料,美国BIOTIUM公司产品;新生牛血清,杭州四季青生物工程材料有限公司产品;双抗(青链霉素溶液)、0.25% EDTA胰酶溶液、PBS缓冲液,美国GenView公司产品;DMEM培养基,美国GIBCO公司产品;琼脂糖,武汉擎科生物技术有限公司产品。
1.1.3 主要仪器 台式高速冷冻离心机(Eppendorf 5415R),德国艾本德公司产品;PCR仪(AB Veriti,Bio-Rad C1 000),美国伯乐公司产品;电泳仪(DYY-6C型),北京六一生物科技有限公司产品;二氧化碳培养箱(SANYO MCO-18AIC),美国赛默飞公司产品;倒置光学显微镜(OLYMPUS CKX31),日本奥林巴斯公司产品。
1.2 方法
1.2.1 病料处理 参照曾智勇[1]等报道的方法进行病料处理。将采集的4份病料分别置于组织研磨器内研磨至糊状,加入含1%双抗的无血清DMEM制成10%组织悬液。经反复冻融3次后,4℃ 12 000 r/min条件下离心20 min,弃沉淀取上清,0.22 μm滤器过滤,样品保存于-80 ℃冰箱备用。
1.2.2 引物合成 参考GenBank中猪繁殖与呼吸综合征病毒(PRRSV)(登录号:MZ219272.1)、猪圆环病毒2型(PCV2)(登录号:AY556475.1)、猪细小病毒(PPV)(登录号:JQ710897.1)、猪伪狂犬病病毒(PRV)(登录号:AY217094)、猪瘟病毒(CSFV)(登录号:AF531433.1)的基因序列,利用DNAMan软件分析保守序列设计并合成引物,引物信息见表1。

表1 引物信息Table 1 The primer information
1.2.3 PCR检测 参照吴旭锦[8]等报道的方法提取样品总DNA与总RNA,利用PCV2、PPV、PRV引物分别对样品总DNA进行PCR检测;将样品总RNA反转录成cDNA后,利用PRRSV、CSFV引物进行PCR检测。取PCR反应产物10 μL,使用DNA标准DL 2 000和8 g/L琼脂糖凝胶进行电泳检测,凝胶成像系统照图记录结果,产物送生工生物(南宁)有限公司进行测序。
1.2.4 病毒分离 将样品滤液接种于单层PK-15细胞中培养,37 ℃孵育1 h后倾去,用PBS洗涤1次,加细胞维持液继续培养,并设正常细胞对照。培养6 h后开始观察,待出现80%左右细胞病变(cytopathic effect,CPE)时收获,传代3次直至CPE出现时间稳定为止。选取每一代病毒液,经PCR鉴定为PRV核酸阳性方可继续下一步试验。
1.2.5 病毒TCID50测定 参照张建远[4]等报道的方法进行病毒组织半数感染量(TCID50)的测定。提前4 h将PK-15细胞悬液接种至96孔细胞培养板,使细胞量达2~3×105个/mL。将培养的F4代PRV病毒液用无血清DMEM作连续10倍倍比稀释(10-1~10-8),弃掉原细胞生长液,将病毒液按100 μL/孔的剂量接种到单层细胞中,每个稀释度接种8孔,同时在培养板最后2列加100 μL细胞维持液作细胞对照。逐日观察细胞病变情况并记录结果,根据Reed-Muench两氏法计算病毒的组织半数感染量(TCID50)。
1.2.6 动物回归试验 参照张建远[4]等报道的方法进行动物感染试验。将培养的F4代PRV病毒液用无血清DMEM作连续10倍倍比稀释(10-1~10-6),每个稀释度按100 μL/只的剂量脚掌接种6只昆明小鼠,同时设置接种等剂量DMEM的阴性对照组。逐日观察小鼠的发病症状和死亡情况,连续观察1周,根据Reed-Muench两氏法计算病毒的半数致死量(50% lethal dose,LD50)。
2 结果
2.1 发病猪场背景
2.1.1 临床症状 广西贵港某猪场存栏母猪800多头,主要是头胎母猪。自上个月免疫口蹄疫疫苗后,猪群开始出现发烧、3~4 d不吃料等症状;紧接着怀孕母猪流产(妊娠期多为30~60 d),仔猪出现神经症状并发生死亡(多为15~21日龄);随后猪场饲养的3只犬也突然失踪和死亡(图1)。

A.怀孕母猪流产; B.仔猪出现神经症状; C.感染仔猪死亡; D.感染犬死亡A.Abortion of pregnant sow; B.Nervous symptoms of piglet; C.Death of infected piglet; D.Death of infected dog图1 疑似感染PRV动物的临床症状Fig.1 The clinical symptoms of animals suspected of PRV infection
2.1.2 病理剖检 对疑似患猪伪狂犬病死亡的仔猪进行剖检,眼观可见明显的扁桃体坏死、化脓,颌下淋巴结肿大、出血,肝脏有散在米粒样黄白色坏死点,肺脏水肿、有片状出血,肾脏有针尖状出血点,呈典型“麻雀蛋”样肾。死前有神经症状的感染仔猪脑浆膜充血、出血,脑脊髓液增多(图2)。

A.扁桃体坏死、化脓; B.颌下淋巴结肿大、出血; C.肝脏有散在米粒样黄白色坏死点; D.肺脏水肿、有片状出血; E.肾脏有针尖状出血点; F.脑浆膜充血、出血,脑脊髓液增多A.Tonsillar necrosis and suppuration; B.Submaxillary lymph node enlargement and hemorrhage; C.Scattered rice like yellow white necrosis spots in the liver; D.Pulmonary edema,patchy bleeding; E.Needle like bleeding spots in the kidney; F.Cerebral plasma membrane congestion and hemorrhage,increased cerebrospinal fluid图2 疑似感染PRV仔猪的病理变化Fig.2 The pathological lesions of piglets suspected to be infected with PRV
2.2 PCR检测结果
针对PRRSV、PCV2、PPV、PRV和CSFV基因的保守序列设计并合成特异性引物,对样品进行PCR(RT-PCR)检测。结果显示,PRRSV、PCV2、PPV和CSFV核酸检测结果均为阴性,PRV核酸检测孔(13~16泳道)出现目的条带,条带大小约为217 bp(图3),与预期大小一致。将13~16泳道对应的样品送生工生物(南宁)公司进行测序,结果显示4个样品均为PRV的基因序列,且为当前广西地区流行的PRV变异毒株。
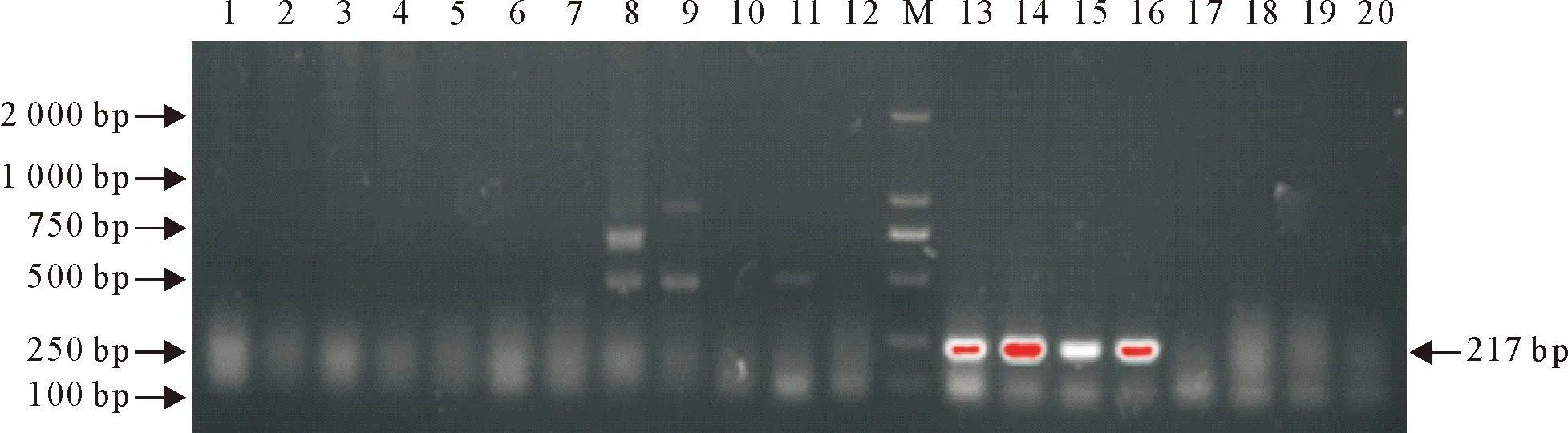
M.DNA标准DL 2 000; 1~4.PRRSV; 5~8.PCV2; 9~12.PPV; 13~16.PRV; 17~20.CSFVM.DNA Marker DL 2 000; 1-4.PRRSV; 5-8.PCV2; 9-12.PPV; 13-16.PRV; 17-20.CSFV图3 组织病料PCR检测结果Fig.3 The PCR detection result of diseased materials
2.3 病毒分离结果
将1份PCR检测为PRV核酸阳性的脑组织病料制成10%组织悬液的滤液接种单层PK-15细胞并培养,24 h时可见部分细胞开始固缩,边缘轮廓变清晰,42 h后细胞形态变圆、聚集、脱落,融合成小合胞体,形成折光性很强的小病灶,而不接种PRV病毒液的PK-15细胞无任何细胞病变(图4)。

A.病料感染的PK-15细胞; B.正常PK-15细胞A.PK-15 cells infected with diseased materials; B.Normal PK-15 cells图4 组织病料感染PK-15细胞42 h出现的细胞病变Fig.4 The cytopathy caused by infection of PK-15 cells with diseased materials for 42 hours
2.4 病毒TCID50测定结果
将培养的F4代PRV病毒液作连续10倍倍比稀释(10-1~10-8),接种单层PK-15细胞,根据3 d后观察到的细胞病变(CPE)情况(表2),采用Reed-Muench两氏法计算病毒的组织半数感染量(TCID50)为1×10-7.66/100 μL。
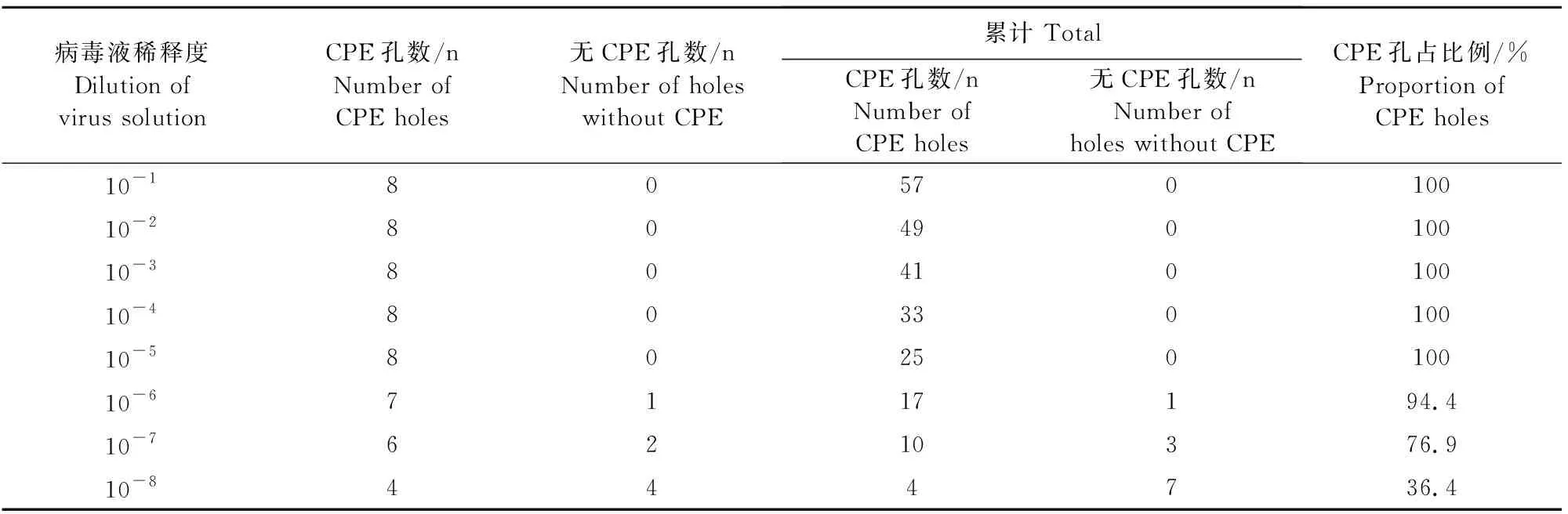
表2 F4代PRV分离株TCID50测定结果Table 2 The TCID50 determination results of F4 PRV isolate
2.5 病毒LD50测定结果
将培养的F4代PRV病毒液进行连续10倍倍比稀释(10-1~10-6),脚掌注射接种昆明小鼠,第3天小鼠表现奇痒症状,不断啃咬注射部位,皮肤出血、毛发蓬乱和脱落,第4天开始出现死亡,注射相同剂量DMEM培养液的阴性对照组小鼠无任何异常表现。记录昆明小鼠死亡的数量(表3),根据Reed-Muench两氏法计算病毒的半数致死量(LD50)为1×10-4.85/100 μL。
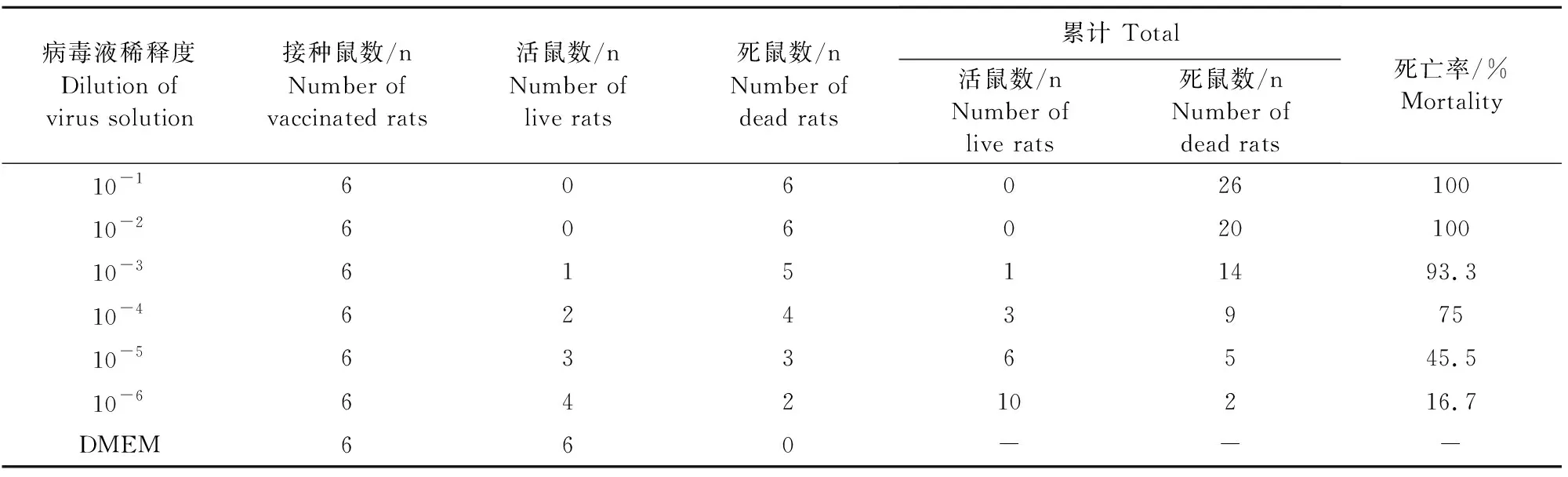
表3 F4代PRV分离株LD50测定结果Table 3 The LD50 determination results of F4 PRV isolate
3 讨论
猪伪狂犬病病毒是疱疹病毒科成员,呈近圆形,外壳包被有囊膜,病毒颗粒及核衣壳大小为150~180 nm,包涵体呈晶格状排列[1],其感染范围广泛、致病性较强,自然条件下可使多种家畜和野生动物感染发病。我国猪群普遍存在PRV野毒感染,并呈散发性流行[9],给养猪业造成了巨大的经济损失[4]。PRV Bartha k61弱毒疫苗在规模化猪场的广泛应用,使猪伪狂犬病得到了较好控制[4]。但随着2012年以来PRV在全国范围再次广泛流行,相关研究也证实了PRV变异毒株的出现[10]。广西地区流行的PRV毒株为我国主要流行的变异株,与国内近期分离的毒株同源性较高[11]。
对于新出现的PRV变异毒株的侵袭,传统的疫苗已不能提供完全的保护[12],现今主要通过接种基因缺失疫苗来进行防控[13]。美国等发达国家利用gE基因缺失疫苗及其配套的诊断方法对其进行控制和根除,但猪伪狂犬病仍在许多国家屡见不鲜[4]。目前,分子流行病学调查常用对PRV全基因组或某个特定区域核苷酸(如gE基因)进行测序和变异分析,绘制遗传进化树来追溯其起源[11]。张文通等[14]合成了1对gE基因的引物,扩增出PRV gE基因核酸片段,表明发病猪场存在PRV野毒株。赵鸿远等[15]通过对PRV变异株gE基因序列分析,均发现在其第48和第492位点存在1个天冬氨酸插入的分子特征。刘芳等[16]对广西5株PRV gE序列分析,得出了广西PRV流行毒株与当前我国主要流行的病毒株遗传关系较近的结论。本研究采样的病死仔猪共2头,分别采集其脑组织和扁桃体4份病料,PCR检测结果中7、8、9、11泳道扩增产物出现的条带为非特异性条带,经测序并非PCV2、PPV的基因序列。取1份PCR检测结果为PRV核酸阳性的样品进行病毒的分离,最终成功分离得到一株PRV,并对其gE基因序列进行分析,确定其为当前广西地区流行的PRV变异毒株。
PRV主要引起母猪流产、产木乃伊胎等症状,新生仔猪也常出现神经症状及腹泻等症状,同时也侵害仔猪的免疫系统[2],可以继发感染PRRSV、PCV2、PPV、CSFV等病毒,因此本研究对采集的病料进行了几种猪常见病毒病病原的PCR检测,但未见其他病毒混合感染。对于猪伪狂犬病,目前没有特效药物进行治疗和防控,唯一采取方式是紧急接种疫苗[2],隐性感染猪的存在会对整个猪群的健康造成严重威胁[17]。因此,要从根本上降低PRV变异株带来的风险,必须重点做好净化控制工作[18],还要从环境、管理、免疫、用药等多方面采取综合处理措施[19]。本研究从广西贵港某猪场病死仔猪的脑组织和扁桃体中分离得到一株PRV,并对该病毒株进行了鉴定和病原特性分析,为广西地区PRV流行病学调查、病原学研究及诊断鉴定等工作提供了参考依据。

