金黄色葡萄球菌性小鼠乳腺炎模型构建及其炎症损伤研究
王嘉欣,宋 雨,李银辉,童德文,黄 勇
(西北农林科技大学动物医学院,陕西杨凌 712100)
乳腺炎是一种与哺乳有关的乳腺实质炎症,以乳腺组织红肿热痛、乳汁性状改变、乳汁体细胞数升高等炎症反应为主要病理特征,是临床奶牛最常见的疾病之一,不仅影响牛奶产量及品质,而且严重的会导致奶牛败血症甚至死亡,制约奶牛养殖业发展[1]。奶牛乳腺炎主要由病原体感染引起,金黄色葡萄球菌是临床引起奶牛乳腺炎的最常见病原体之一,而且传播速度快、可以长期感染乳腺并具有传染性,是奶牛乳房炎中最难治疗和控制的病原菌。然而,用奶牛做实验动物不易操作、价格昂贵,近年来,由于小鼠和奶牛的乳腺结构相似,并且还显示出与自然获得性乳腺炎小鼠相同的病理状况和细胞因子水平,小鼠乳腺炎模型常用于奶牛乳腺炎的病理机制研究和药物筛选[2-3]。本研究目的是通过小鼠乳头管注射金黄色葡萄球菌,探索金黄色葡萄球菌诱发乳房炎病理模型的方法,检测乳腺炎小鼠炎性损伤情况,揭示攻菌前后乳腺组织炎性病理变化,为建立金黄色葡萄球菌诱发的奶牛乳腺炎相关研究提供病理模型。
1 材料和方法
1.1 材料
1.1.1 实验动物 C57BL/6J小鼠,8周龄,所有小鼠均在SPF环境下繁殖与饲养,温度20~26 ℃,湿度40%~70%,每天采用12 h昼夜间断照明。所有动物实验流程及处理均按西北农林科技大学动物管理使用条例进行。
1.1.2 菌种 致病菌金黄色葡萄球菌(Sau-XJ-21)由西北农林科技大学病理实验室从周边牛场乳腺炎病牛乳汁样本中分离、纯化、保存。
1.1.3 主要试剂 石蜡(20180406),天津博迪化工股份有限公司产品;中性树胶(20200217),苏木素染液(20220917),伊红染液(20220923),10%中性福尔马林固定液(G2162),北京索莱宝科技有限公司产品;MPO试剂盒(ER0320T05664),武汉Elabscience公司产品。
1.1.4 主要仪器 移液器(3123000217),德国Eppendorf公司产品;超净工作台(YT-CJ-IND),北京亚泰科隆仪器技术有限公司产品;高速冷冻离心机(Sorvall Legend Micro 17R),美国Thermo scientific公司产品;石蜡切片机(EICA RM2126),德国Leica公司产品;Infinite 200 PRO NanoQuant微孔酶标仪(M200pro NaNoQuant),瑞士TECAN公司产品;正置荧光显微镜(Ni-U),日本尼康有限公司产品;生物组织自动包埋机(HY-BM1160),中国金华惠友仪器设备有限公司产品;病理切片扫描仪(Leica Aperio LV1),德国Leica公司产品;PCR仪(EA),美国Thermo scientific公司产品;自动恒温摊烤烘片机(GTK-2002),西安瑞丰仪器设备有限公司产品。
1.2 方法
1.2.1 金黄色葡萄球菌的浓度测定 将保存的从乳腺炎牛中分离到的金黄色葡萄球菌10 μL接种到10 mL LB培养基中,37 ℃过夜振荡培养,1∶200转接于新的10 mL LB液体培养基中,用酶标仪测定菌液不同时间点的吸光度OD600,用平板计数法测定样品中CFU的确切数量,绘制生长曲线。使用时,选取对数期金黄色葡萄球菌,测定其浓度,并调整菌液浓度为2×104CFU/mL~2×108CFU/mL,离心生理盐水重悬备用。
1.2.2 动物分组与处理 C57BL/6J小鼠按雌雄1∶1的比例合笼,怀孕后移出雄鼠。母鼠分娩后即不再更换垫料,使其自然哺乳10 d左右。试验前1~3 h分离仔鼠,异氟醚麻醉,将第4对乳头(L4&R4)用75%乙醇消毒,在体式显微镜下用剪刀剪掉乳头末端1 mm左右,之后用钝化的微量进样器从乳导管处缓慢插入2 mm左右乳腺导管注射金黄色葡萄球菌菌悬液或生理盐水,建立小鼠乳腺炎模型。这种方法可以减少对乳腺的物理刺激,且确保细菌细胞在乳腺内更好的分布。
将30只产后雌鼠分为Ⅰ-Ⅵ组,每组6只:Ⅰ组为阴性对照组(注射50 μL生理盐水),Ⅱ-Ⅵ组分别为1×103CFU~1×107CFU试验组(注射50 μL 2×104CFU/mL~2×108CFU/mL牛相关性金黄色葡萄球菌)。感染48 h后处死,取乳腺组织样本进行检测。
1.2.3 小鼠病理检测 观察并记录小鼠金黄色葡萄球菌感染前后毛发、采食饮水情况、是否死亡、乳区是否出现红肿等。细菌感染后48 h,颈椎脱臼处死小鼠,将小鼠于腹部朝上固定于泡沫板上。用酒精消毒皮肤,剖开腹部皮肤,注意不要破损小鼠内脏及血管。暴露小鼠两侧乳腺组织,观察被皮下乳腺组织大体颜色变化、质地软硬、是否有明显的出血等,拍照并记录。将乳腺组织在4%中性甲醛中固定24 h以上,之后依次在梯度酒精和二甲苯中脱水透明,将乳腺组织用石蜡包埋并切成5 μm厚的切片。经苏木精和伊红(H&E)染色后,光镜下观察组织病理学变化。主要的组织病理学指标以组织损伤和中性粒细胞浸润程度评价。
1.2.4 乳腺组织细菌负荷测定 感染48 h后,颈椎脱臼处死小鼠,无菌解剖L4和R4乳腺,在10倍体积PBS中匀浆,梯度稀释并在LB琼脂平板上涂布,病原菌读数,根据稀释倍数计算乳腺组织中的细菌负荷。
1.2.5 乳腺组织中IL-1β、IL-6、TNF-α含量测定 称取500 mg左右乳腺组织,在10倍体积PBS中匀浆。离心取上清液,按照说明书使用ELISA试剂盒检测检测肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)和白细胞介素6(interleukin-6,IL-6)的含量。每个ELISA反应重复3次。在450 nm处使用Infinite 200 PRO NanoQuant 微孔酶标仪测定。
1.2.6 髓过氧化物酶活性测定 髓过氧化物酶(myeloperoxidase,MPO)活性是中性粒细胞功能和激活的标志物。收集乳腺组织并在冰上将组织研磨成组织匀浆(重量∶体积为1∶19)。MPO活性的检测方法按照制造商的说明进行,最后通过测量在460nm处的OD值,计算酶活力。
1.2.7 乳腺组织中中性粒细胞和巨噬细胞数目测定 被皮下摘取乳腺组织,称取500 mg左右乳腺组织,用4 ℃预冷含2%血清的PBS冲洗,在5 mL PBS中将其剪碎至约1 mm3的小块,加入2.5 mg/mL胶原酶 Ⅱ、0.2%胶原酶 Ⅳ和50 U/mL DNaseⅠ,在37℃水浴摇床中消化30 min。经红细胞裂解缓冲液裂红后,清洗重悬获得单细胞悬液。进行细胞计数,计数后吸取100 μL细胞悬液(2×106个细胞)于1.5 mL离心管中,加入标记细胞表面特异性抗原的抗体(巨噬细胞:CD45-APC、CD11b-PeCy7、F4/80-FITC;中性粒细胞:CD45-APC、CD11b-PeCy7、Ly6G-PE),4 ℃避光放置30 min,洗涤重悬后流式细胞术检测巨噬细胞和中性粒细胞比。
1.2.8 统计分析 所有结果以mean±SEM表示。采用SPSS 23.0对数据进行单因素方差分析,然后采用Tukey事后检验。统计学意义设为P<0.05或P<0.01。
2 结果
2.1 小鼠临床症状
注射生理盐水或不同浓度菌悬液后,Ⅰ组小鼠精神状态良好,活泼好动,采食正常,毛发光亮;与Ⅰ组相比,Ⅱ、Ⅲ组小鼠饮水采食轻微减少,未见其它异常;Ⅳ组小鼠饮食和饮水量明显减少,被毛粗糙;Ⅴ组小鼠饮食和饮水量明显减少,被毛粗糙,且在28 h和32 h各死亡1只;Ⅵ 组小鼠采食饮水明显减少、被毛粗糙、嗜睡蜷缩、乳区红肿,眼角有明显分泌物,分别于20 h、24 h、36 h死亡3只。提示构建乳腺炎模型时攻菌浓度应低于2×107CFU/mL,保证小鼠存活。
2.2 乳腺组织大体病变
攻菌后48 h,剖检观察小鼠乳腺组织,如图2所示,Ⅰ组小鼠乳腺组织乳汁充盈,呈乳白色;Ⅱ、Ⅲ组小鼠乳腺组织略微变暗;Ⅳ组小鼠乳腺组织伴有轻微出血;Ⅴ组乳腺组织弥散性出血、组织颜色发暗;Ⅵ组小鼠乳腺组织颜色暗沉、质地变硬(图2)。

Ⅰ.对照组;Ⅱ.2×104 CFU/mL;Ⅲ.2×105 CFU/mL;Ⅳ.2×106 CFU/mL;Ⅴ.2×107 CFU/mL;Ⅵ.2×108 CFU/mLⅠ.Control group; Ⅱ.2×104 CFU/mL; Ⅲ.2×105 CFU/mL; Ⅳ.2×106 CFU/mL; Ⅴ.2×107 CFU/mL; Ⅵ.2×108 CFU/mL图1 不同浓度金黄色葡萄球菌诱导的乳腺炎小鼠生存情况Fig.1 Survival of mastitis mice induced by S.aureus at different concentrations
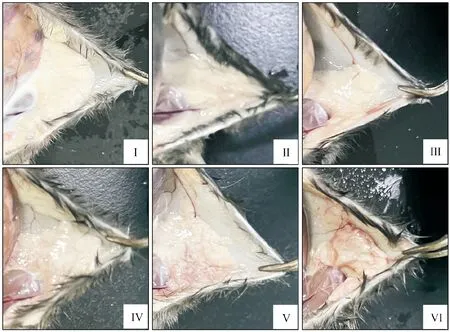
Ⅰ.对照组;Ⅱ.2×104 CFU/mL;Ⅲ.2×105 CFU/mL;Ⅳ.2×106 CFU/mL;Ⅴ.2×107 CFU/mL;Ⅵ.2×108 CFU/mL。Ⅰ.Control group; Ⅱ.2×104 CFU/mL; Ⅲ.2×105 CFU/mL; Ⅳ.2×106 CFU/mL; Ⅴ.2×107 CFU/mL; Ⅵ.2×108 CFU/mL图2 乳腺导管注射不同浓度的金黄色葡萄球菌48 h后乳腺组织眼观病理变化Fig.2 Ocular pathological lesions of mammary gland 48 h after breast ductal injection with different concentrations of S.aureus
2.3 乳腺组织病理变化
病理切片结果显示,Ⅰ组小鼠乳腺组织腺泡腔结构完整、排列整齐,乳腺上皮细胞未见明显脱落,腺泡间隔未见增厚,腺泡腔内未见明显炎性细胞浸润;Ⅱ、Ⅲ组小鼠乳腺组织乳腺小叶结构清晰,伴有个别乳腺上皮细胞脱落;Ⅳ组小鼠乳腺组织腺泡腔中出现大量中性粒细胞及淋巴细胞浸润;Ⅴ、Ⅵ组小鼠乳腺组织中腺泡结构更加不完整,乳腺上皮细胞坏死脱落崩解,炎性细胞密集浸润,腺泡间隙内有渗出及出血点(图3)。
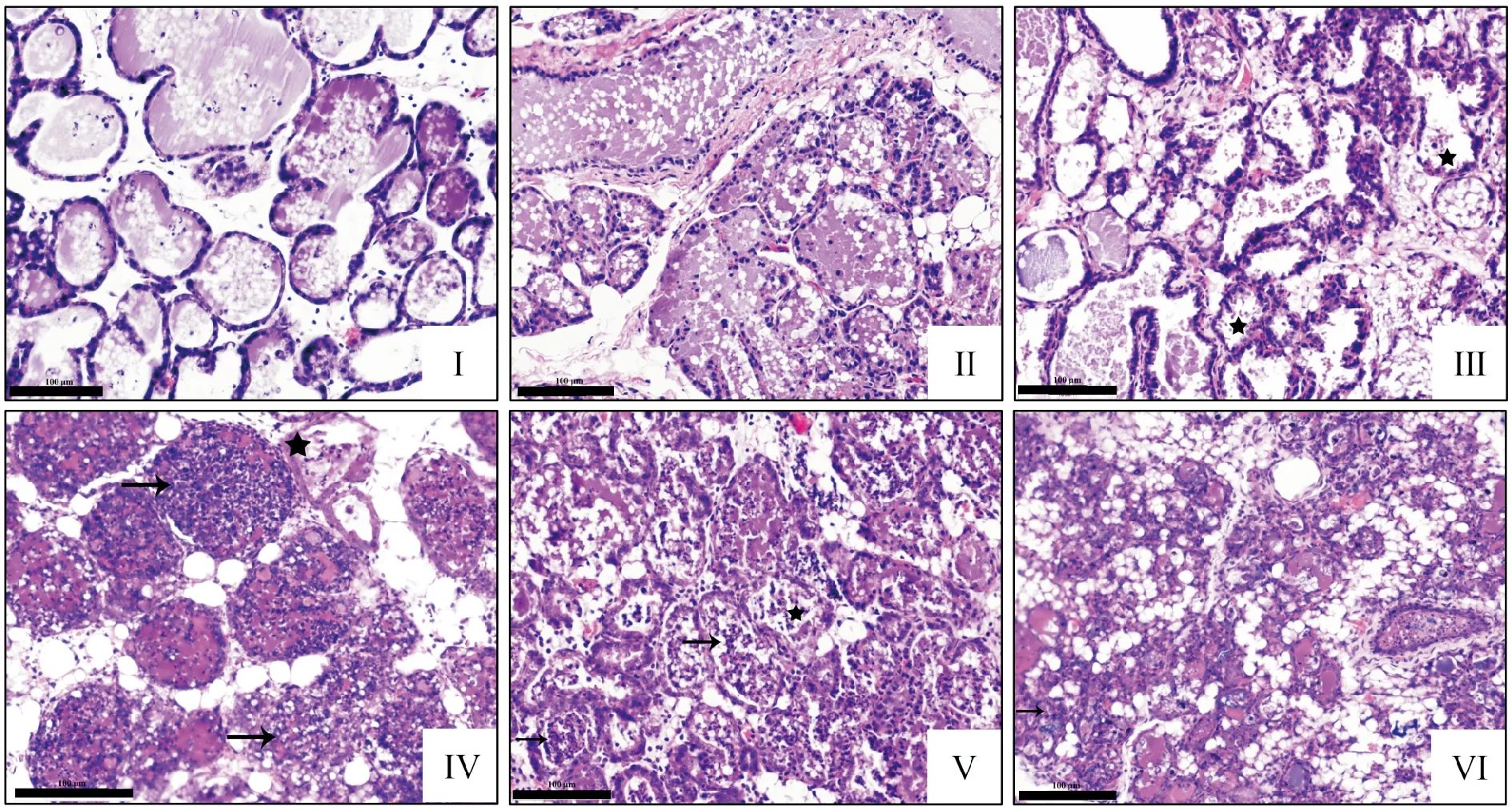
Ⅰ.对照组;Ⅱ.2×104 CFU/mL;Ⅲ.2×105 CFU/mL;Ⅳ.2×106 CFU/mL;Ⅴ.2×107 CFU/mL;Ⅵ.2×108 CFU/mL。箭头标记炎性细胞浸润,星号标记乳腺上皮细胞脱落。Ⅰ.Control group; Ⅱ.2×104 CFU/mL; Ⅲ.2×105 CFU/mL; Ⅳ.2×106 CFU/mL; Ⅴ.2×107 CFU/mL; Ⅵ.2×108 CFU/mL.Arrows mark inflammatory cell infiltration,and asterisks mark breast epithelial cell shedding.图3 乳腺导管注射不同浓度的金黄色葡萄球菌48 h后乳腺组织的病理变化(200×)Fig.3 Histopathological lesions of mammary gland 48 h after breast ductal injection with different concentrations of S.aureus(200×)

Ⅰ.对照组;Ⅱ.2×104 CFU/mL;Ⅲ.2×105 CFU/mL;Ⅳ.2×106 CFU/mL;Ⅴ.2×107 CFU/mL;Ⅵ.2×108 CFU/mLⅠ.Control group; Ⅱ.2×104 CFU/mL; Ⅲ.2×105 CFU/mL; Ⅳ.2×106 CFU/mL; Ⅴ.2×107 CFU/mL; Ⅵ.2×108 CFU/mL图4 乳腺导管注射不同浓度的金黄色葡萄球菌48 h后乳腺组织的细菌负荷Fig.4 Bacterial loads of mammary gland 48 h after breast ductal injection with different concentrations of S.aureus
2.4 乳腺组织细菌负荷
通过计数小鼠乳腺组织中的细菌数量可以评估机体的抗感染能力。检测攻菌后48 h小鼠乳腺组织中细菌含量变化,结果显示:Ⅰ组没有检测到菌落。与Ⅰ组相比,Ⅱ-Ⅵ组差异极显著(P<0.01),乳腺组织中菌落数随注菌浓度呈剂量依赖性增加,且Ⅲ-Ⅵ组小鼠乳腺组织中细菌载量高于攻菌量。
2.5 乳腺组织炎性因子分泌
如表1所示,随攻菌浓度的升高,乳腺组织中炎性细胞因子IL-6、TNF-α和IL-1β含量也相应升高。与Ⅰ组相比,Ⅲ组小鼠组织中IL-6、TNF-α分泌水平显著升高(P<0.05),Ⅳ组中IL-6、TNF-α分泌水平极显著升高(P<0.01)。与Ⅰ组相比,Ⅲ组小鼠组织中IL-1β分泌水平极显著升高(P<0.01)。而炎性细胞因子的过度分泌是引起乳腺损伤、削弱乳腺功能主要因素之一。

表1 小鼠乳腺组织IL-6、TNF-α及IL-1β表达水平Table 1 Expression levels of IL-6,TNF-α and IL-1β in mammary gland pg/mg

表2 小鼠乳腺组织MPO活性水平Table 2 MPO activity in mammary gland U/g
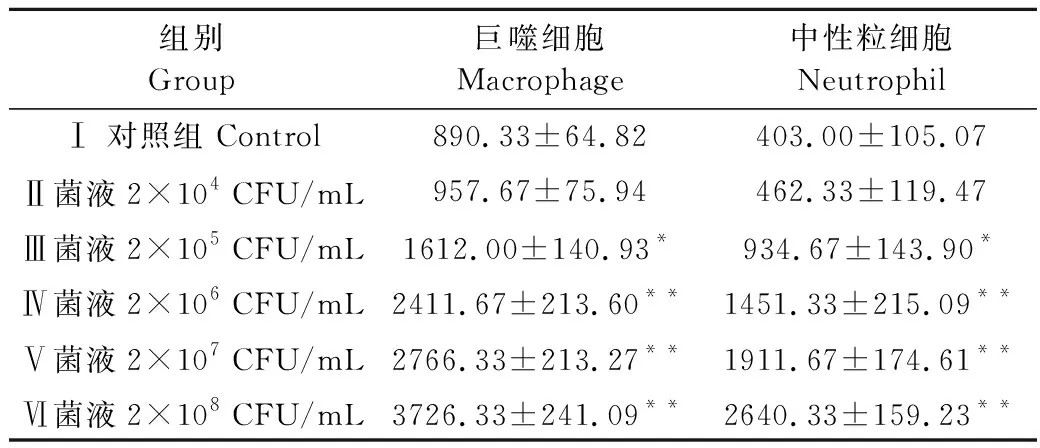
表3 小鼠乳腺组织巨噬细胞及中性粒细胞浸润检测Table 3 Detection of macrophage and neutrophil infiltration in mammary gland 个/mg
2.6 MPO活性
在感染期间大量炎性因子主要由巨噬细胞和中性粒细胞释放,MPO活性可评价中性粒细胞的积聚。结果显示,金葡菌刺激后48 h,随攻菌浓度的增高,MPO活性逐渐升高。与Ⅰ组相比,Ⅲ组小鼠组织中MPO活性显著升高(P<0.05),Ⅳ组极显著升高(P<0.01),提示中性粒细胞的募集。
2.7 乳腺组织免疫细胞浸润
进一步检测小鼠乳腺组织中中性粒细胞及巨噬细胞浸润情况,结果显示:金葡菌刺激后48 h,与Ⅰ组相比,Ⅲ组小鼠组织中中性粒细胞数目和巨噬细胞数目显著升高(P<0.05),Ⅳ组小鼠组织中中性粒细胞数目和巨噬细胞数目极显著升高(P<0.01)。
3 讨论
在奶牛中,乳腺炎会导致乳房肿胀和疼痛以及全身炎症损伤,严重影响动物健康,降低牛奶产量和质量,在全球范围内造成重大经济损失。据报道,金黄色葡萄球菌感染占奶牛乳腺炎的很大比例[4-5]。金黄色葡萄球菌通过奶牛的乳导管进入到乳腺内,躲避奶牛机体的细胞免疫和体液免疫反应,黏附和侵入到乳腺细胞中,破坏奶牛乳腺的防御机制,此后细菌借助乳腺的营养环境不断繁殖,从而引起机体产生炎症反应,形成亚临床或慢性感染[4-7]。尽管许多国家改进了农场管理措施并降低了发病率,但金黄色葡萄球菌引起的乳腺炎仍难以解决[8]。一方面金黄色葡萄球菌内化入上皮细胞、巨噬细胞中,躲避抗生素,抗生素难以控制和清除,还伴随严重的残留问题[9-10];另一方面金黄色葡萄球菌生物膜形成和兼性细胞内寄生可能导致持续、慢性和反复感染[11-14]。因此,迫切需要利用合适的动物模型辅助开发安全有效的奶牛乳腺炎临床治疗药物。
小鼠腹部第4对和第5对乳腺组织与奶牛的乳腺组织非常相近,可有效使用其进行奶牛乳腺方面疾病的间接研究[15]。1970年,Chandler R等[16]给小鼠接种了通常与自然发生的牛乳腺炎相关的生物,观察到小鼠宏观和组织学反应与牛非常相似。此外,Fournier B等[17]发现,金黄色葡萄球菌感染后,依靠脂磷壁酸、脂蛋白、肽聚糖等多种活性蛋白和毒素激活免疫系统,引起小鼠与牛相类似的细胞因子变化,导致乳腺组织损伤。应用小鼠进行乳腺炎模型的构建,不但能够解决了大型动物难以管理和实施操作的问题,同时排除了环境因素影响以及个体间差异干扰,而且成本低廉、可操作性强。现已有大量研究成果显示可以通过不同的致病菌诱导不同品系的小鼠建立乳房炎模型。
本研究选用从患有乳腺炎的病牛乳汁中分离得到的金黄色葡萄球菌进行小鼠乳腺炎的造模,采用微量注射器直接通过乳头管将菌液注入乳池,模拟自然发病状态,分别注射50 μL浓度为2×104CFU/mL~2×108CFU/mL的金黄色葡萄球菌,以确定造成小鼠乳腺炎的最佳造模浓度。通过观察小鼠的临床特征、乳腺大体、乳腺组织的病理变化、炎性因子、乳腺组织中细菌负荷及MPO活性,对小鼠乳腺炎模型构建情况进行综合分析评价[18]。通常,患有乳腺炎的小鼠会发生乳腺肿胀充血,小鼠不时舔舐乳腺,乳腺组织出现出血点、间质增宽、炎性浸润、组织结构崩解、上皮细胞损伤等明显病理症状。将金黄色葡萄球菌注入小鼠乳腺后,乳腺发生局部炎症,导致中性粒细胞、单核巨噬细胞等炎性细胞增多,MPO是中性粒细胞的功能标志和激活标志,其水平及活性变化代表着中性粒细胞的功能和活性状态,可直接用于显示炎症反应的严重程度[19-20]。随后TNF-α、IL-1β和IL-6等典型促炎细胞因子释放,IL-1β在感染早期产生,被认为是关键的炎症介质,可以募集更多小吞噬细胞,还能与TNF-α产生协同作用,促进黏附分子表达、加速中性粒细胞迁徙、脱颗粒,增加活性氧的释放量;TNF-α是一种由活化巨噬细胞分泌的多功能促炎细胞因子,可在炎症反应过程中诱导其他促炎因子的产生,如IL-6;IL-6由急性炎症期的中性粒细胞产生[21-22]。适当水平的促炎细胞因子对于抵抗病原体的免疫反应很重要,但过量的细胞因子产生可能会导致严重的细胞损伤,因此,它们也常用于评估小鼠乳腺的炎症程度[23-24]。此外,小鼠乳腺炎的定量标准通常通过乳腺细菌负荷量来评估[25]。当然,模型构建要求小鼠保持一定的活动度,没有出现死亡或者拒绝采食饮水等后续实验的情况,才能表明成功构建了小鼠乳腺炎模型。
本研究中发现当攻菌浓度为2×106CFU/mL,攻菌量为1×105CFU时,既能保证小鼠发生适当的乳腺炎症,又能不引起小鼠死亡,所以本次试验结果确立1×105CFU是建立C57BL/6J小鼠金黄色葡萄球菌隐性乳腺炎的最佳攻菌剂量,此外,金黄色葡萄球菌感染能够引起小鼠乳腺组织免疫细胞募集、释放大量炎性因子,从而造成组织炎性损伤。本试验通过建立小鼠乳腺炎模型,为间接研究奶牛乳腺方面疾病提供病理模型,为探索奶牛乳腺炎的体内机制、明确药物治疗效果提供数据支撑。

