玉米大斑病胁迫下球孢白僵菌对玉米植株的影响及定殖规律
隋 丽,路 杨,迟瑞凯,赵 宇,张正坤*,李启云*
(1.吉林省农业科学院植物保护研究所/吉林省农业微生物重点实验室/农业农村部东北作物有害生物综合治理重点实验室,公主岭 136100;2.吉林农业大学植物保护学院,长春 130118)
球孢白僵菌Beauveriabassiana是一种重要的虫生真菌,在自然环境中普遍存在,能够通过人工培养实现大量增殖,并广泛用于农林害虫的生物防治[1]。近年来,大量研究表明,球孢白僵菌具有植物内生性,可以通过接种叶片、种子或土壤处理,在多种单子叶和双子叶植物中定殖[2,3]。球孢白僵菌可以为植物提供碳、氮等营养元素,对植物生长过程中的多种生理生化指标产生积极影响,包括提高种子发芽率、促进生物量积累和提升产量等[4,5]。球孢白僵菌在植物内定殖,不仅对植物生长有促进作用,还能提高植物对多种植物病害的抗性,主要表现为发病率降低、延缓发病时期和病情指数下降[6,7]。以上研究表明,球孢白僵菌在植株内的分布和宿存对植物生长及抗病性有直接影响,但其作用机制还有待于进一步探讨。
前期有研究证明球孢白僵菌在植株内并非呈静止状态,而是受到环境影响会不断发生移动。费泓强等[8]研究发现球孢白僵菌能够被植物根部吸收,随着水分运输向茎、叶中传导扩散,且球孢白僵菌在植株各部位具有一定的定殖偏好性,叶片比茎部和根部有着更高的定殖率。McKinnon 等[9]研究了非生物因素对球孢白僵菌在植物内定殖规律的影响,发现当玉米叶片受到模拟草食动物机械伤害胁迫时,接种30 d 后球孢白僵菌在根际的定殖率较对照组显著升高,表明在伤害胁迫下,植物自身的防御反应可能发生了改变,引起球孢白僵菌在根际宿存量增加。以上研究均表明球孢白僵菌在植物组织内是动态存在的,其分布规律会随自身或外界环境条件发生改变。但目前鲜有关于植物受到病原菌胁迫情况下,球孢白僵菌在植株内分布规律的相关研究的报道。
本研究以球孢白僵菌、玉米和由玉米大斑病菌Exserohilumturcicum引起的玉米主要叶部病害——玉米大斑病为研究对象,利用球孢白僵菌灌根处理玉米幼苗,预期明确球孢白僵菌对玉米植株生长和抗病性的影响,并进一步探讨玉米大斑病胁迫下球孢白僵菌在玉米植株内的定殖扩散规律,本研究将为球孢白僵菌内生定殖防治植物病害机理研究奠定理论基础,也为玉米大斑病生物防治提供参考依据。
1 材料与方法
1.1 试验材料
供试玉米品种为先玉335,该品种为大斑病易感品种[10]。
本研究使用的球孢白僵菌为BbOFDH1-5 菌株,该菌株是吉林省农业科学院植物保护研究所生防微生物研究与利用团队于2008 年从吉林省德惠市(44˚34′37′′ N,126˚18′59′′ E)采集的亚洲玉米螟Ostrinia furnacalis僵虫中分离得到的,并保存于中国农业微生物菌种保藏中心,菌种保存号为ACCC No.32726(GenBank 登录号:PRJNA178080)。
玉米大斑病病原菌B22 菌株由吉林大学植物科学学院植物保护系提供。以上两种供试的菌株孢子均保存在15%(v/v)甘油溶液中,试验前需将菌株保存液涂于马铃薯葡萄糖琼脂(PDA)培养基中,26 ℃培养5 d 以对菌株进行活化。
1.2 试验设计
本研究在吉林省农业科学院植物保护研究所人工气候室(43˚30′56′′ N,124˚48′26′′ E)中开展,采取随机区组设计,盆栽控制试验。本试验设置4 个处理,分别为对照组(Control)、球孢白僵菌处理组(Bb)、玉米大斑病菌处理组(Et)和球孢白僵菌+玉米大斑病菌处理组(Bb+Et)。每个处理10 株玉米,3 次重复,共计120 株。
1.3 玉米植株的培养
玉米种植采用的花盆尺寸为直径14 cm,高16 cm,底部有直径1 cm 的通气孔,每盆装入泥炭土450 g(Pindstrup,丹麦),浇入200 mL 无菌水使盆中泥炭土充分润湿。选取1000 粒大小均一、籽粒饱满的玉米种子,按照Sui 等[11]描述的方法对其进行表面消毒。将经表面消毒处理的种子放入无菌培养皿中,加入无菌水在26 ℃培养箱中进行催芽处理,共3 d,期间每天更换一次无菌水。选取发芽程度均一的玉米种子进行播种,每盆播种3 粒。各处理随机排列,定期浇水,出苗后每盆留苗两株。培养条件为(25±2)℃,湿度为(70±5)%,光周期为16 L : 8 D。
1.4 球孢白僵菌接种方法及定殖率检测
采用无菌药匙将球孢白僵菌气生孢子从PDA 平板中刮下,将适量球孢白僵菌孢子加入0.1%(v/v)吐温-80 溶液中配制浓度为1×108个孢子/mL 的球孢白僵菌孢子悬液。待玉米苗生长至4~5 叶期时,采用灌根法将配制的球孢白僵菌孢子悬液接种到玉米植株中,接种量为20 mL/株,每隔24 h 灌根1 次,共灌根3 次。
按照Sui 等[11]描述的方法对球孢白僵菌处理的玉米叶片进行定殖检测。在最后一次灌根处理48 h 后选取第3 个完全展开的叶片。白僵菌在玉米叶片定殖率的计算公式如下:
定殖率(%)=白僵菌定殖的玉米株数/处理组总株数×100。
1.5 玉米大斑病菌接种方法
采用无菌药匙将玉米大斑病菌孢子从PDA 平板中刮下,加入到0.1%(v/v)吐温-80 溶液中配制浓度为1×105个孢子/mL 的玉米大斑病菌孢子悬液。在球孢白僵菌接种后24 h,将配制的玉米大斑病菌孢子悬液接种至玉米叶心,每株玉米接种玉米大斑病菌分生孢子悬浮液200 µL[12]。
1.6 球孢白僵菌对玉米植株生长、生理指标的测定
在进行球孢白僵菌处理后的第7 d、14 d、21 d 分别测定植株叶片叶绿素、氮含量及株高。玉米株高为栽培基质表面至植株叶片最顶端之间的长度;玉米叶片叶绿素和氮含量利用手持TYS-B 型叶绿素测量仪(浙江托普云农科技股份有限公司)进行测定,测量部位为完全展开的第3 片叶片中心位置。
1.7 玉米大斑病发病率统计
在玉米大斑病菌孢子悬浮液接种后约4~5 d,玉米叶片开始出现边缘暗褐色、中央淡褐色的斑块时,此后每隔7 d 观察记录每个处理组中玉米叶片的发病情况,玉米大斑病发病率的计算公式如下:
玉米大斑病发病率(%)=每个处理玉米植株发病总数/调查玉米植株总数×100。
1.8 玉米叶片及玉米根际土壤取样方法
玉米大斑病发病3 d 后取样,每隔7 d 取一次样品,共取样3 次。叶片的取样部位为完全展开的第三片叶片,每株截取相同长度叶片中心部位,用锡纸包裹后迅速放入液氮速冻后-80 ℃保存。同时采集玉米根际土样品,每个处理随机选取5 株玉米,获取每株玉米取根际土壤,-80 ℃保存。
1.9 玉米植株根际土壤球孢白僵菌分离及鉴定
将不同处理的根际土壤样品分别混合,每个处理取1 g 根际土壤样品,装入盛有20 颗直径3 mm 95%氧化锆珠和10 mL 0.05%(v/v)吐温-80 溶液的锥形瓶,每个处理5 次重复,共20 瓶。160 r/min 震荡1 h,将土壤溶液稀释100 倍,取100 µL 土壤悬浮液均匀涂在PDA 平板上,2 d 后统计球孢白僵菌的菌落数量。
采用平板菌落计数法[13],计算球孢白僵菌菌落数量,公式如下:菌落数量(cfu/g)=MD/W,其中M为菌落平均数;D 为稀释倍数;W 为土壤烘干质量(g)。
为验证所计算菌落是否为球孢白僵菌,每个处理随机选取疑似球孢白僵菌菌落,利用光学显微镜进行形态学鉴定,并进行PDA 平板培养,在26 ℃暗培养条件下培养14 d,刮取分生孢子,提取总DNA,利用真菌通用ITS 引物ITS1:5′-TCCGTAGGTGAACCTGCGG-3′,ITS4:5′-TCCTCCGCTTATTGATATGC-3′进行分子鉴定。
1.10 玉米叶片中球孢白僵菌与大斑病菌的荧光定量检测
将不同处理的各重复收集的玉米叶片样品分别混合,利用CTAB 法提取基因组DNA。将提取的基因组DNA 通过Nanodrop Lite (ThermoFisher Scientific, Waltham, MA, USA)进行浓度测定后,将所有玉米叶片基因组DNA 稀释至浓度为1000 ng/µL 作为qPCR 反应的模板。以球孢白僵菌18S rDNA[14]、玉米大斑病菌管家基因EF-1ɑ[15]和玉米管家基因Etcpr1作为相对定量参考基因设计特异性引物(表1)。
反应体系为:2×ChamQ Universal SYBR qPCR Master Mix 10 μL,引物各0.5 μL,总DNA 1 μL,ddH2O 补足20 μL,利用QuantStudio 6 Flex 荧光定量PCR 仪(ThermoFisher Scientific, Waltham, MA, USA)进行检测。PCR 程序设置为95 ℃预变性反应30 s;95 ℃变性10 s,60 ℃退火30 s,40 个反应循环;熔解曲线为赛默飞世尔科技QuantStudio 6 默认采集程序。采用2-ΔΔCT相对定量法[16]分别检测玉米大斑病菌EF-1ɑ、球孢白僵菌18S rDNA 基因在样品中的表达情况。
1.11 数据统计与分析
采用SPSS 26 软件(IBM,USA)对数据进行描述性统计及方差齐性检测,并通过Duncan’s 方法进行多重比较及显著性分析,利用GraphPad 8.0.2 进行绘图。
2 结果与分析
2.1 球孢白僵菌在玉米中定殖情况
将球孢白僵菌处理后的玉米叶片样品进行表面消毒,然后放置在PDA 培养基中检测叶片中球孢白僵菌内生定殖率。培养第5 d 时,玉米叶片边缘由内而外长出白色可见的球孢白僵菌菌丝;培养第7 d,玉米叶片周边已形成明显的球孢白僵菌菌落(图1)。结果表明,采用灌根方式接种的球孢白僵菌能够成功定殖到玉米植株中并从玉米叶片中分离出来,定殖率达到68.18%。
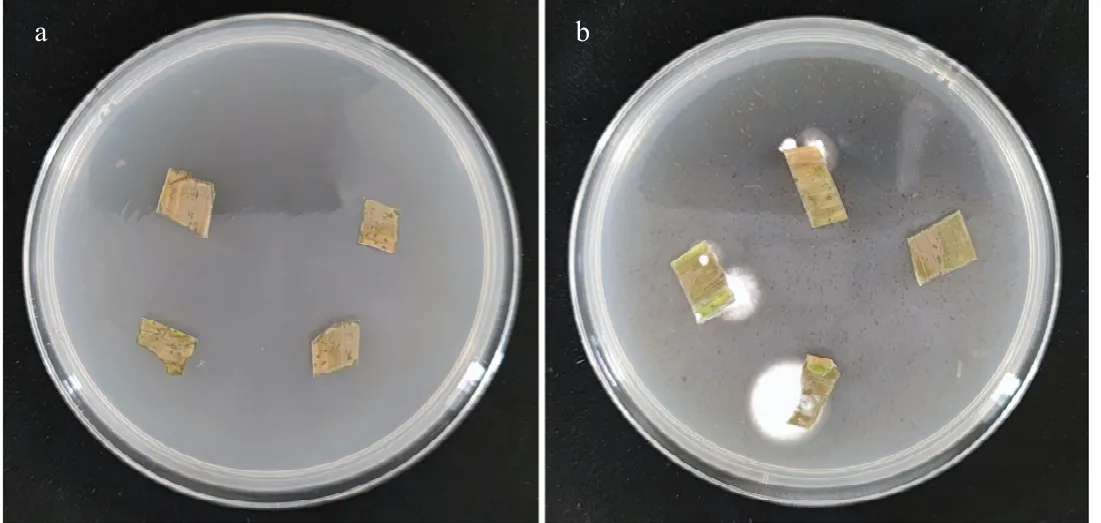
图1 球孢白僵菌在玉米叶片内生定殖的代表性结果Fig.1 Representative results of endophytic colonization of maize leaves by B.bassiana
2.2 球孢白僵菌和玉米大斑病菌在玉米植株内的分布规律
玉米根际土壤中球孢白僵菌分离鉴定结果表明,PDA 选择培养基筛选到的菌落为球孢白僵菌(图2)。随机选取PDA 平板上长出的球孢白僵菌菌落,通过光学显微镜观察发现,菌落孢子形态为卵圆形,直径3~5 μm,与球孢白僵菌气生孢子一致(图2a);1%琼脂糖凝胶电泳显示菌液PCR 结果为单一的目的条带,经测序显示与球孢白僵菌菌株ITS 序列同源性为100%,确定为球孢白僵菌(图2b)。
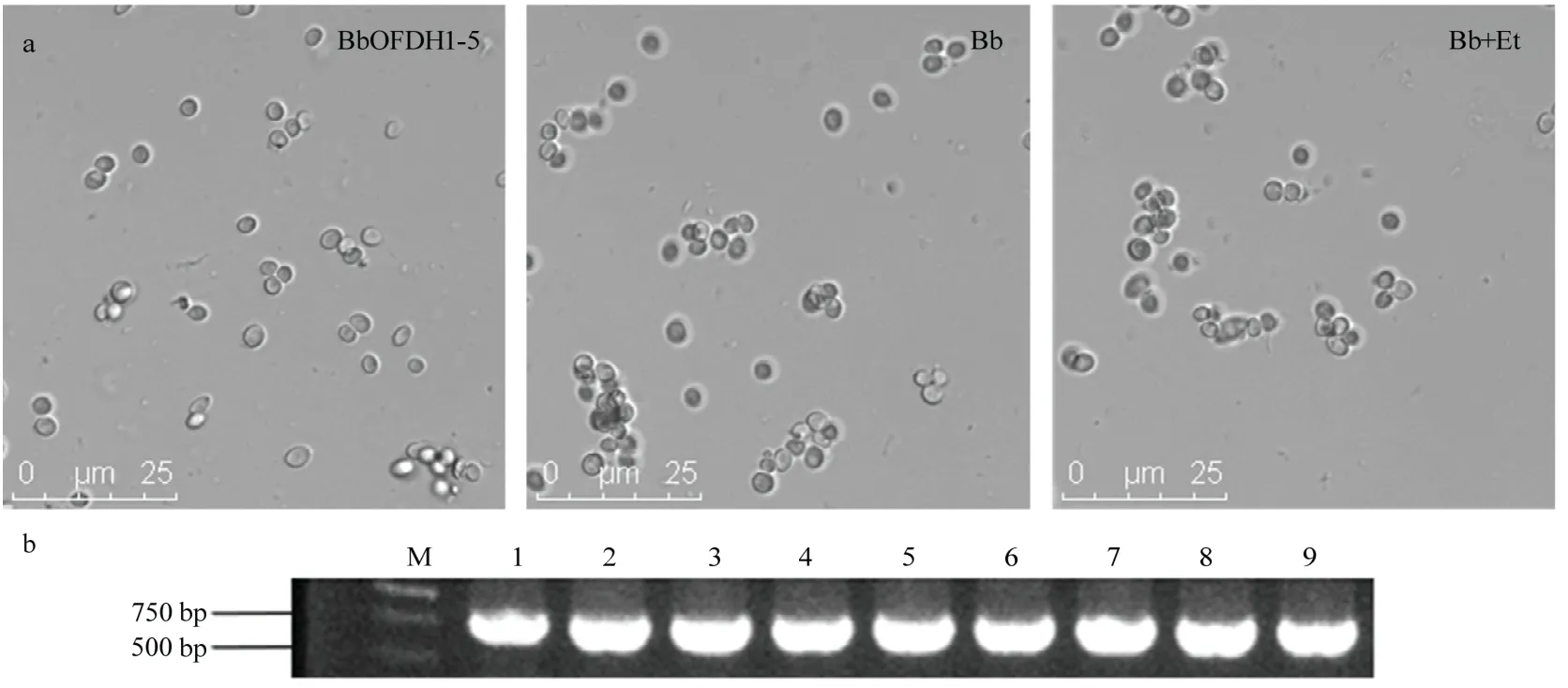
图2 玉米根际土壤球孢白僵菌鉴定Fig.2 Identification of B.bassiana in maize rhizosphere soil
球孢白僵菌灌根和接种大斑病菌对玉米植株根际土壤中球孢白僵菌含量具有显著影响(图3)。玉米大斑病发病第7 d、第14 d 和第21 d,Bb 处理组中玉米植株根际土壤球孢白僵菌含量均显著高于Control 处理组;同时,Bb+Et 处理组中玉米植株根际土壤球孢白僵菌含量均显著低于Bb 处理组,且随着时间增加Bb+Et 处理组中球孢白僵菌含量逐渐减少,分别降低17.44%、75.96%和94.92%。结果显示当植株受到病害胁迫时,根际土壤中球孢白僵菌含量呈逐渐降低的趋势。

图3 玉米根际土壤球孢白僵菌含量Fig.3 Content of B.bassiana in maize rhizosphere soil
利用荧光定量PCR 技术采用相对定量的方法,分析了处理组和对照组叶片中球孢白僵菌和玉米大斑病菌的表达量。在玉米大斑病发病第7 d、14 d 和21 d,Bb+Et 处理组玉米叶片中球孢白僵菌的相对表达量比Bb 处理高(图4a),同时,Bb+Et 处理组在7 d、14 d 以及21 d 叶片中玉米大斑病菌的相对表达量比Et 处理组低(图4b),表明球孢白僵菌在玉米植株内定殖,能够降低玉米大斑病菌含量,抑制玉米大斑病菌增殖。
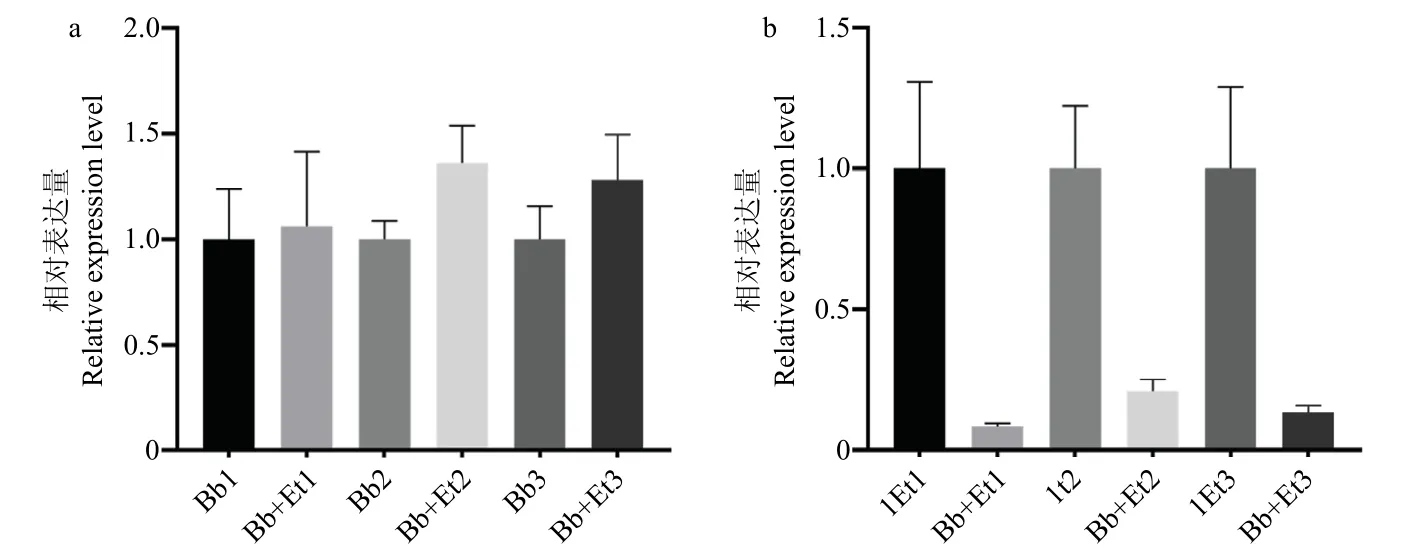
图4 玉米叶片中球孢白僵菌和大斑病菌相对表达量Fig.4 Relative expression level of B.bassiana and E.turcicum in maize leaves
2.3 球孢白僵菌定殖对玉米植株生长指标的影响
玉米植株接种球孢白僵菌后,叶片中叶绿素含量随着时间变化会发生一定的改变。当接种球孢白僵菌7 d后,经球孢白僵菌灌根处理后玉米植株(Bb)的叶绿素含量显著高于Control 组(图5a);球孢白僵菌接种第14 d,各处理组叶绿素含量变化不显著(图5b);球孢白僵菌接种第21 d,Bb 和Bb+Et 处理组的叶绿素含量显著高于Control 组和玉米大斑病菌处理组(Et)(图5c)。然而各处理组间玉米叶片样品中氮含量无显著差异(图6)。
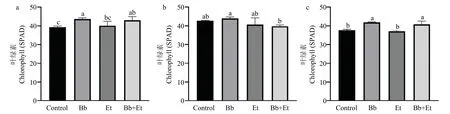
图5 球孢白僵菌定殖对玉米叶片中叶绿素含量的影响Fig.5 Effects of B.bassiana on chlorophyll content in maize leaves

图6 球孢白僵菌定殖对玉米叶片中氮含量的影响Fig.6 Effects of B.bassiana on nitrogen content in maize leaves
球孢白僵菌接种处理后第7 d,Bb 处理组的株高显著高于其他处理组(图7a)。球孢白僵菌接种第14 d,Bb 处理的株高显著高于其他处理组,Et 处理组的植株高度则显著低于对照组,Bb+Et 处理组株高比Et 处理组有升高趋势,升高9.32%(图7b)。球孢白僵菌接种第21 d,Bb 处理组的植株高度显著高于其他处理组,Bb+Et 处理组植株高度显著高于Et 处理组(图7c)。
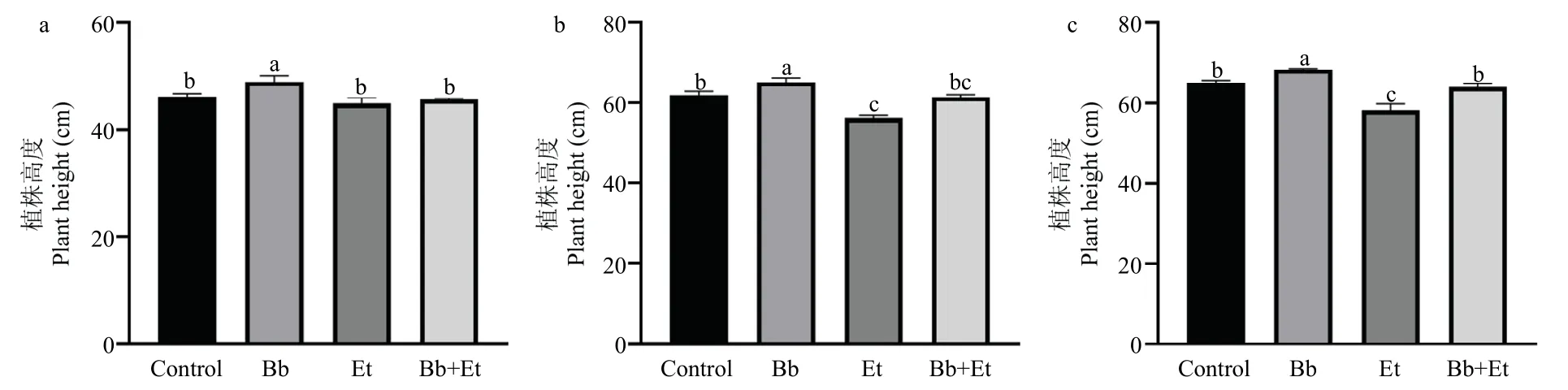
图7 球孢白僵菌定殖对玉米植株高度的影响Fig.7 Effects of B.bassiana on maize height
2.4 球孢白僵菌定殖对玉米大斑病的影响
球孢白僵菌定殖对玉米大斑病的发病率有显著影响。玉米植株接种玉米大斑病菌第7 d,Et 处理组发病率为56.67%,Bb+Et 处理组发病率相对于Et 处理组显著降低,仅为26.67%(图8a);玉米植株接种玉米大斑病菌第14 d 和第21 d,Et 处理组玉米大斑病的发病率均为83.33%,而Bb+Et 处理组发病率仅为36.67%(图8b,8c)。3 次调查结果显示,经过球孢白僵菌定殖处理的玉米植株发病率相比于只接种玉米大斑病菌侵染的玉米植株发病率均显著降低,接菌7 d 后Bb+Et 处理组比Et 处理降低30.00%,第14 d 和第21 d 后降低46.67%。结果表明球孢白僵菌内生定殖可有效提高玉米植株对玉米大斑病的抗性。
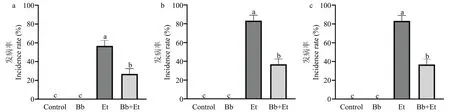
图8 球孢白僵菌定殖对玉米大斑病发病率的影响Fig.8 Effects of B.bassiana on the incidence rate of corn leaf blight
3 讨论
本研究采用灌根方式将球孢白僵菌接种到玉米植株内,球孢白僵菌定殖能够对植株生长产生积极影响,同时能显著降低玉米大斑病菌引起的玉米大斑病的发病率。通过对玉米植株根际白僵菌含量和叶片中白僵菌、大斑病菌含量调查分析,发现了球孢白僵菌在玉米大斑病菌诱导下的动态分布规律,即受到大斑病菌侵染时,玉米植株能够从根际土壤中“招募”球孢白僵菌,使球孢白僵菌在叶片聚集,进而提高自身对病原微生物的抗性,降低发病率。
近年来,国内外已有大量研究证明球孢白僵菌能够在多种植物中定殖,并且能够提高植物的多项生长参数[17,18]。例如,Castillo López 和Sword[19]发现球孢白僵菌定殖能够增加陆地棉Gossypiumhirsutum的植物高度,并能增大果实的尺寸;Sánchez-Rodríguez 等[20]利用浸种法和灌根法将球孢白僵菌接种到小麦中,能够增加小麦株高、穗重量和根长度;在前期研究中,我们也发现球孢白僵菌在玉米中定殖能够使玉米植株高度增加并增加玉米叶面积[21]。在本研究中,我们不仅再次验证了球孢白僵菌定殖能够促进玉米植物高度增加,还发现白僵菌定殖能够提高玉米叶片中叶绿素含量,但对氮含量无显著影响。该结果与Qin 等[22]研究结果类似,他们发现球孢白僵菌内生定殖能够提高烟草植株的叶绿素含量以及净光合速率,但对植物氮元素的积累不产生影响。以上研究从植物生长角度证明了球孢白僵菌定殖对植物产生的积极作用。除了促进植物生长,球孢白僵菌定殖还能够提高宿主植物对生物胁迫(病害、虫害)的抗性[23,24]。本研究中,我们发现球孢白僵菌在玉米植株中内生定殖,能够降低玉米大斑病的侵染,即球孢白僵菌的定殖显著降低了玉米大斑病的发病率。
当植物受到外界因素胁迫时,植物体内与植物共生的微生物群落会产生响应,与植物共同抵御外来侵害。植物不仅利用自身内生定殖的微生物群体来抑制病原体,而且还可以从环境中吸引有益的微生物来应对外界不同的侵染,这被称为“呼救”策略,这种植物与微生物的相互作用被认为是维持植物健康的关键因素[25,26]。本团队前期研究结果表明,球孢白僵菌在玉米植株内呈现自下而上的定殖扩散规律,并且偏好于定殖在植物叶片[8,21]。本研究中,我们发现玉米大斑病菌能够对球孢白僵菌在玉米植株内的分布产生影响,作为重要的叶部病害病原菌,玉米大斑病菌侵染后,玉米叶片中球孢白僵菌含量显著增加,而根际土壤中球孢白僵菌数量则下降,说明玉米植株在受到病原菌胁迫的情况下,球孢白僵菌能够在寄主植株内定向迁移。这一现象同国外的一些研究相似,例如,微杆菌属Microbacteriumsp.、假单胞菌属Pseudomonassp.、寡养单胞菌属Stenotrophomonassp.和黄单胞菌属Xanthomonassp.的菌株,经常被发现在植物中受害部位富集,以协助宿主植株抵御不同病原体或者害虫的侵染[27]。Chang 等[12]研究表明,当球孢白僵菌内生定殖于玉米植株时,会改变玉米叶片细菌和真菌的相对丰度,主要提高了玉米叶片中假单胞菌属和伯克霍尔德菌属Burkholderiasp.的相对丰度。已有研究表明,假单胞菌属和伯克霍尔德菌属在体外对峙培养中能够有效抑制玉米大斑病菌菌丝的生长[28],在本研究中,在玉米大斑病胁迫下,招募球孢白僵菌至发病部位,通过提高对玉米大斑病菌有抑制作用的假单胞菌属和伯克霍尔德菌,实现抗病作用。此外,有益微生物对病原菌的抑制作用很大程度上取决于二者对宿主植物中有限营养源的获取和生态位竞争,虫生真菌成功定殖后就会占据生态位并且从寄主体内获得养分,引起病原菌可利用的资源不足以维持生长,从而抑制病原菌增殖,使植物病情指数下降,发病率降低[29]。本文中球孢白僵菌和玉米大斑病之间的互作结果也符合这一规律,说明球孢白僵菌通过植株的招募作用,与病原菌产生互作进而降低植株发病率,对植物产生积极影响。
综上所述,本研究明确了球孢白僵菌定殖能够促进玉米植株生长并提高其抗病性,证明了在玉米大斑病胁迫下,玉米植株能够招募球孢白僵菌向发病部位募集,增强自身的防御能力。本研究加深了对虫生真菌内生定殖提高植物抗病性作用机制的理解,能够为虫生真菌的抗病性研究奠定理论基础。

