合成大麻素及其代谢物的检测方法研究进展
宗兴森,何丹丹,王媛媛,柯 星,范一雷
(1.浙江警察学院 浙江省毒品防控技术研究重点实验室,浙江 杭州 310051;2.浙江工业大学 化工学院,浙江 杭州 310012)
1 合成大麻素的发展历史及现状
近10年,全世界地下非法市场上出现大量的新精神活性药物,这些药物大多被不法分子滥用于“娱乐”消遣。为规避当地政府的法律,地下非法药物制造者大多采用科学文献报告和大型医药公司合成的精神活性物质,通过化学结构的略微修饰,生产出新的精神活性化合物。在化学类别中,被称为“合成大麻素”的合成大麻素受体调节剂一直处于最前沿[1]。合成大麻素是一类对人体作用机理与天然大麻素四氢大麻酚(THC)相似的新精神性物质,主要通过和人体内的大麻素受体CB1和CB2结合而发挥作用结合。相比于天然大麻素,合成大麻素在人体内发挥的药效作用更强,对人体的危害更大[2]。合成大麻素的药效作用是通过与细胞膜的特异性相互结合而产生的[3]。在 1980 年,大麻素受体经过鉴定,用 CB 缩写来表示,并根据发现的顺序分别编号为 CB1、CB2[4]。CB1、CB2都是G蛋白偶联受体家族[5],它们之间的区别主要在氨基酸序列、信号传导机制和组织分布等方面[6]。绝大多数的CB1受体在中枢神经系统(Cns)中表达[7],在某些情况下,也存在于神经元的树突和胞体上[8]。大麻素可能通过表达CB1受体的偶联和细胞类型来调节不同的细胞功能[9]。在神经元胞体上表达的CB1受体的激活增加Erk活性,并诱导脑源性神经营养因子(BDNF)表达。大麻素类化合物的神经保护作用,可能部分是通过这一机制介导的[10]。小鼠实验证明,与CB2受体结合的大麻素,导致免疫应答的变化,特别是在巨噬细胞诱导的辅助T细胞活化水平上[11]。新合成的大麻素类化合物继续出现在市场上,而这些新化合物大多是作用于CB1受体。研究表明,大麻素可以抑制多种神经递质的释放:当CB1受体被大麻素激活后,经过G蛋白传导,抑制腺苷酸环化酶,使cAMP含量减少,进而抑制了cAMP依赖的蛋白激酶,蛋白激酶被抑制后使外向性K+流兴奋;同时,CB1受体还与Ca2+通道偶联,大麻素作用后,使Ca2+内流减少,进而使突触前膜神经元内神经递质释放减少,最后影响突触后膜分别产生兴奋性或抑制性作用[12]。
从1960 年开始,已经开始出现Δ9-THC 的类似物,如HU-210、大麻隆、屈大麻酚等。10 年后,Pfizer[13-14]开发了环己基苯酚(CP)系列的化合物,样品包括合成大麻素CP-59、CP-47和它们的n-烷基同系物。1994 年,美国化学家 Huffman等[3]研制了以萘甲酰基吲哚类为主的系列化合物,主要包括萘甲基吲哚类、萘甲酰基吡咯类、萘甲基茚类和苯乙酰吲哚类等,即最早的合成大麻素。后来被命名为 JWH 系列化合物,包括 JWH-018、JWH-073 和 JWH-200等。合成大麻素从萘甲酰吲哚开始(JWH-018),逐渐发展为萘甲酰基唑(THJ),然后为吲唑(AKB-48),直至吲哚甲酰胺(MDMB-CHMINACA)[15]。根据合成大麻素出现的时间,可以简单的将合成大麻素分成两代,JWH-018、JWH-250属于第一代,AM-2201属于第二代[16]。从结构上来说,很多合成大麻素与经典大麻素无关。按照结构来分,合成大麻素大致可分为七类,即:萘甲酰基吲哚类(JWH-018)、萘甲基吲哚类、萘甲酰基吡咯类、萘甲基茚类、苯乙酰基吲哚类(JWH-250)、环乙基苯酚类(CP47,497)和传统大麻素[17]。多数传统的大麻素类化合物,是以部分还原的二苯吡喃结构为基础合成的[18]。合成大麻素的主体结构见图1。
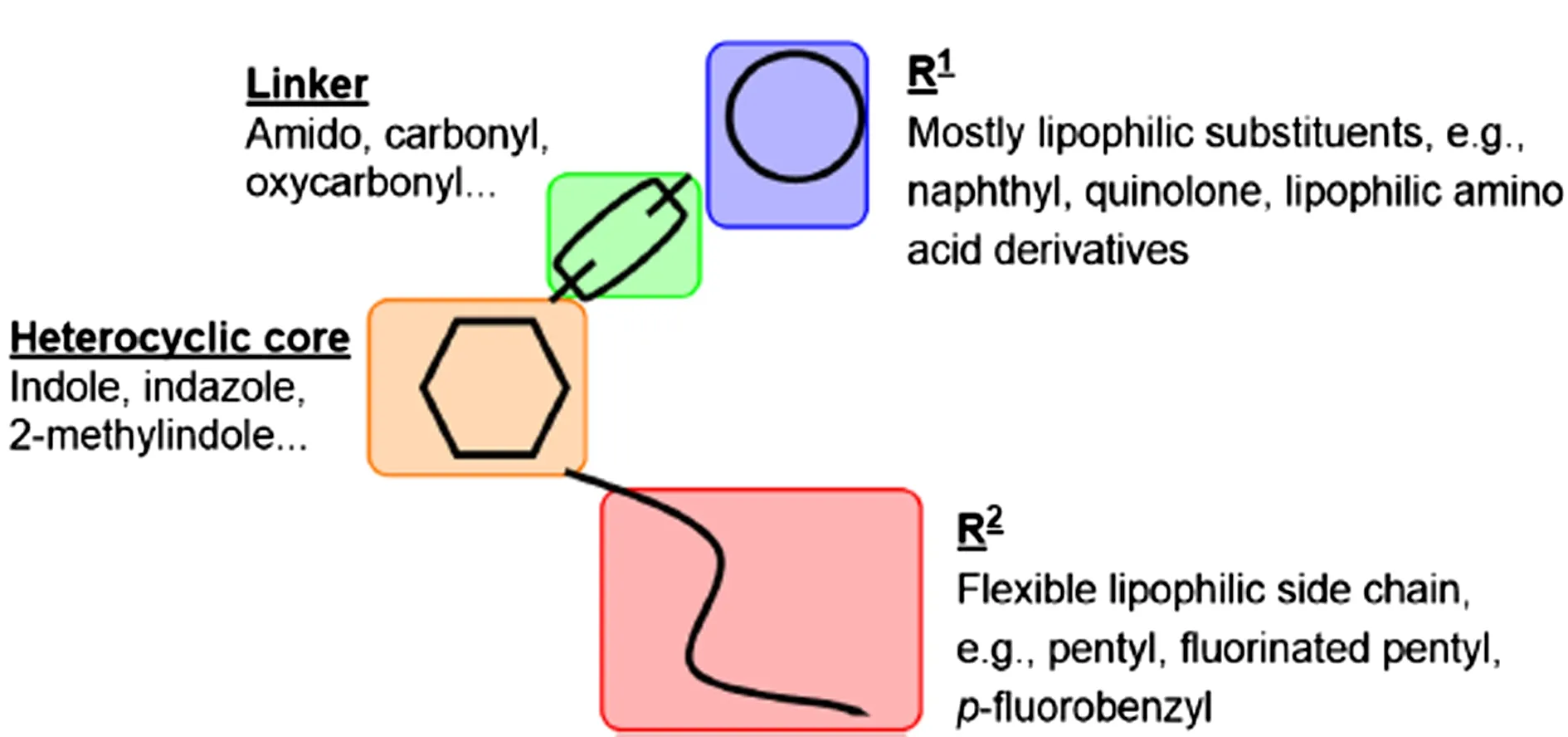
图1 合成大麻素的主体结构
主体结构包含一个杂环核心结构、一个取代基、一个连接杂环核心结构和取代基的基团和一个侧链。杂环核心结构一般为吲哚、吲唑、2-甲基吲哚结构等;取代基主要是亲脂性取代基,包括萘基、氨基酸衍生物等;连接基团一般为酰胺基、羰基等;侧链主要是亲脂侧链,如戊基、氟化戊基、对氟苄基等。大部分合成大麻素的结构都是由主体部分发展而来的。
每年都有数十种新的精神活性物质出现在欧洲的毒品市场上。这些化合物中最丰富的是合成大麻素。最初几年,在吸毒人群中,JWH化合物尤其流行。然而,随着新化合物的产生,合成大麻素的基团也不断增加[19]。2012年,在美国运动员的血液样本中发现JWH-018和JWH-073;2014年,在因受影响驾驶而被罚款的人的血液样本中,检出多种合成大麻素,包括AM-2201和JWH-018[20];2014年,在俄罗斯,MDMB-FUBINACA引起了60多起的中毒事件,其中包括15人死亡。2015 年,波兰大规模爆发了几百起中毒事件,包括至少3起致命事件,均由使用一种名为“运动员”的新型精神活性物质产品造成。这种产品中含有合成大麻素混合物,其中还有MDMB-CHMICA[21]。对于大多数合成大麻素类化合物,我们了解的药理学和毒理学知识不多,但这些化合物会对人类健康造成严重危害是必然的。
在2000年,合成大麻素第一次以草药的形式在市面上出现,并作为一种新型的精神活性物质在全球的范围内有着非常广泛的使用。在2008年以前,在“娱乐”毒品市场上很少或根本没有观察到合成大麻素类药物,但目前它们已成为“娱乐”性精神活性物质中应用最广泛的一类,占设计药物市场的28%,超过合成卡西酮(25%)或色胺致幻剂(4%)[22]。自2008年以来,新的精神活性物质的数量迅速增加[23 ],2014年达到101种。自2015年以来,新物质的数量略有减少,但是仍处于较高水平[24 ]。“香料(Spice)”毒品是一类添加合成大麻素的植物制品,制毒者通常将合成大麻素用有机溶剂溶解,喷涂于香料或药草上并加入添加剂,晾干后即制得成品。这类毒品在国外最早出现于 2006 年,2008 年开始流行[25]。最近几年,随着对新型香料产品研究的深入,以及对潜在健康问题的关注,世界上不少国家都采取了立法行动来禁止或者用别的方式来管制“香料”产品和其相关的化合物。在中国,除了2013年对第12个物质的第一次管制外,2015年10月1日对116种非医疗用麻醉药品和精神药物进行了控制,其中包括40种合成大麻素。世界卫生组织估计,2013年,年龄在15~64岁之间的1.818亿人使用大麻用于非医疗用途(世界卫生组织,2016年)。联合国毒品和犯罪问题办公室2015年的世界毒品报告指出,合成大麻素占所有新型精神活性物质的39%(美国,2016年)[26]。2016年7月之后,又增加22种合成大麻素。如AB-CHMINACA和MAB-CHIMINACA,UR-144和XLR-11,PB-22和5F-PB-22[27]。目前,已有600多种合成大麻素已被报道[28]。
2 合成大麻素的检测
合成大麻素的种类较多,不同种类的合成大麻素结构相差较大;这给合成大麻素的检测带来了一定的难度。近几年,我国对合成大麻素的分析主要是对“香料”产品中主要成分的检测以及对新型成分的结构鉴定[29]。目前,对合成大麻素类药物的检测分析主要有以下几种:薄层色谱法、核磁共振(NMR)和红外光谱分析法(IR)、色质联用技术(包括气质联用(GC-MS)和液质联用(LC-MS))。
薄层色谱法是一种简单快速的检测方法,目前有关于薄层色谱法检测合成大麻素的报道相对较少。在很多实验室中,GC和HPLC已经代替了这种方法,但是对于安非他明、天然大麻素、阿片类药等滥用药物,薄层色谱法仍然在使用[30]。Logan等[31]人在2012年曾用薄层色谱法检测美国草本香料混合物中的合成大麻素,结合GC-MS等其他检测分析方法,最终测定了JWH-018、JWH-019、JWH-073、JWH-081、JWH-200、JWH-210、JWH-250、49RCS-4、RCS-8,AM-2201和AM-694等各种合成大麻素,还发现了其他非大麻素类药物。
NMR和 IR对 LC-MS 和 GC-MS 中的未知峰有很重要的补充作用。Ji Hyun等[32]人对吲唑-3-甲酰胺类合成大麻素进行鉴定和表征,以DMSO-d6为溶剂进行NMR实验,通过NMR和IR实验,进一步确定DMBA-CHMINACA为MDMB-CHMINACA的水解形式,并确定了DMBA-CHMINACA的结构。2012年,Simolka等[33]人对德国市场上的七种商业“香料”产品进行了分析,它们都含有大量的合成大麻素,实验通过核磁共振波谱确定所有化合物的结构,并进一步用紫外、质谱等方法对其进行了表征。
GC-MS是一种常用的分离技术,在大多数实验室中,被用于鉴别和定量检测生物样品中的药物成分[34]。然而,GC-MS也有一些不足之处,如高保留率和对分析物质量的限制,且不适用于一些热不稳定的化合物,所以在对某些化合物前处理时通常需要进行衍生化处理。Akira等[35]人总结了关于草药中合成大麻素的GC-MS检测方法:将草药样品放入顶空小瓶,盖上聚四氟乙烯/硅酮隔板;样品在 200 ℃ 下孵育,脉冲搅拌转速为 250 r/min;将羧基/聚二甲基硅氧烷纤维插入顶空 5 min 进行萃取;然后将纤维注入气相色谱入口 15 min,解吸分析物;最后得到合成大麻素在样品中的LOD值至少为 20 μg。Ojanpera[36]采用GC-APCI-QTOFMS鉴别血液中的新型精神活性物质,对绵阳血中的5中精神活性进行了分析鉴定。
国内对合成大麻素的检测一般较多采用高效液相色谱法,而LC-MS /MS具有灵敏度高,准确度高等优势,且相比较液相色谱而言具有分析时间短等优点。2014年,张春水等[37]人检测常见10种合成大麻素的高效液相色谱-三重四极杆质谱(HPLC-MS /MS)定性、定量分析方法,并依据质谱特征推测了其碎裂途径。
3 对合成大麻素代谢物的研究
大多数的合成大麻素都具有亲脂性,并且在人体中快速代谢,在常规的生物样品中很难检测到母体药物,所以找到和合成大麻素的生物标记物就至关重要。对合成大麻素代谢物的研究主要分为体内代谢和体外代谢,体外代谢方法主要有人肝细胞培养和肝微粒体孵育实验。体内代谢主要有大鼠模型和斑马鱼模型。 Wohlfarth等[38]人通过实验比较了体内、体外代谢的优缺点。对于体内代谢,主要的检测途径有尿液中代谢物的检测和血浆中代谢物的检测。而对于体内实验获得的样品要进行前处理,通常使用的前处理方法有液液萃取、固相萃取等。Per Ole M[39]用UHPLC-QTOF-MS对尿液中合成大麻素代谢物进行定量,进样之前对样品进行前处理,采用的前处理方法为固相萃取,比较了不同的固相萃取柱最终选择了HLB固相萃取柱,HLB固相由亲水性和亲脂性相结合而成,该吸附剂不需要调节和平衡步骤,且回收率较高。GC-MS和LC-MS是检测合成大麻素最常用的仪器。GC-MS由于其极性高、挥发性低,在检测合成大麻素代谢物方面有其局限性。相比之下,LC-MS是分析非挥发性化合物、极性化合物、热不稳定化合物和大分子化合物的首选仪器。
现在购买得到的人肝细胞保留了大多数Ⅰ相和Ⅱ相酶的活性,通过实验可得到高质量的代谢数据,但是人肝细胞价格比肝微粒体昂贵的多,且一旦解冻必须充分利用,不可再次冷冻。Karl[40]通过FUBIMINA在人肝细胞中的代谢来识别FUBIMINA与其异构体THJ-2201;为了区分FUBIMINA和THJ-2201,实验通过采用相同的采集和处理方法对同一程序孵育的THJ-2201肝细胞样本进行了分析。在人肝细胞中孵育FUBIMINA异构体,通过HPLC-HR-MS分析孵育样品,表征独特的主要代谢物保留时间和碎片分布,并与病例尿液样本进行比较。Diao[41]通过高分辨质谱研究EG-018在人肝细胞中的代谢情况,找到适宜的尿标志物代谢物记录EG-018的消耗情况,并用Compound Discoverer软件对其原始数据进行分析处理。
HLM体外孵育实验具有操作简单,成本低等优点,但该实验不能定量的估计体内的生物转化,Lukas等[42]人通过人肝微粒体体外实验孵育CUMYL-PEGACLONE,检测其Ⅰ相代谢物以及对30份真实尿液样本进行了检测,尿液用ACN和NH4+HCOO-进行液液萃取;CUMYL-PEGACLONE是一种新型的合成大麻素;实验通过采用液相色谱串联质谱和液相色谱串联高分辨质谱技术在体内检测到这种新物质的Ⅰ期代谢产物。最终共检测到22种不同的Ⅰ期代谢产物,其中包括羟基化、脱氢等常见的代谢方式。Claudio等[43]人研究了合成大麻素AB-CHMINACA的体外和体内人体代谢,体外代谢研究为体外肝微粒体孵育实验,体内实验则用一名AB-CHMINACA使用者的尿液,50 μL 尿液用 150 μL 乙腈稀释乙腈并涡旋30秒。然后将样品用 10000 r/min 的转速旋转,持续 2 min。 然后将上清液转移到用于分析的进样小瓶。采用液相色谱-飞行时间质谱联用技术对AB-CHMINACA代谢产物的形成进行监测,检测到26种AB-CHMINACA的代谢产物,包括7种单羟基化代谢物和6种二羟基化代谢物,以及AB-CHMINACA脱烷基化产物,全部由细胞色素P450(CYP)酶产生,两种羧化代谢物,可能由酰胺酶产生;其中羟基化和羧化可能为其主要的代谢方式。Shimpei[44]研究了高效液相色谱-高分辨质谱联用测定用人肝微粒体孵育合成大麻素AM 1220的体外代谢,并将实验所得数据与文献中人体的数据进行比较。Ariane Wohlfarth等[45]人研究研究了戊环吲哚/戊环咪唑合成大麻素AB-PINACA和5F-AB-PINACA的代谢产物。
大鼠体内实验容易操作,动物的血浆和尿液的收集相对容易,但是大鼠代谢模型相较于人体代谢来说还是存在物种差异。APINAC是一种新型的合成大麻素;Jungjoong等[46]人采用大鼠模型,研究了APINAC在体内和体外的代谢,体外采用鼠肝微粒体模型,体内实验给大鼠静脉注射APINAC 5 mg/kg,特定的时间点采集血样,并且在给药一天内采集尿样,然后由液相色谱串联高分辨质谱和液相串联低分辨质谱进行检测。总共在RLMS和大鼠尿液中可检出22种APINAC代谢产物。APINAC主要通过酯水解生成羧酸,是APINAC摄入的典型标志。Sabina等[47]人研究了四种合成大麻素的代谢反应,使用MetaSite软件自动分配代谢物结构来执行代谢物的鉴定,使用MetaSite软件进行的计算机代谢预测显示了实验和计算机数据之间的良好一致性。
斑马鱼生长迅速,且斑马鱼与人类基因组同源性高[48],可产生与人体相似的Ⅰ相氧化和还原代谢物。但目前为止,国内外做合成大麻素斑马鱼代谢实验的较少。 Xu等[49]人采用人肝微粒体和斑马鱼模型研究了新的非法药物AMB-FUBINACA的代谢特征。
4 结语
本文对合成大麻素的发展历史和现状进行了介绍,总结了合成大麻素的检测方法及其代谢物的研究方法,列举了近几年来对合成大麻素及其代谢物的研究一些常见的检测方法和研究手段,为能建立一个能快速、准确检测合成大麻素及其代谢物的新方法奠定基础,为进一步研究合成大麻素代谢物的结构给予方法指导。

