参杞强精颗粒对H2O2诱导小鼠睾丸间质细胞氧化应激损伤的作用*
唐爱存, 马家宝, 赖克道, 刘金花, 卢秋玉
(1.广西中医药大学第一附属医院, 广西 南宁 530023; 2.广西壮族自治区中医药研究院,广西 南宁 530022; 3.广西壮族自治区人民医院 药学部, 广西 南宁 530021)
目前,随着我国生育政策的变化,越来越多的家庭选择二胎或三胎,但受环境污染、工作压力、生活方式改变等因素的影响,男性的生育能力逐渐下降,这一矛盾严重影响了社会稳定和家庭和睦,同时也影响国家人口政策的实施。其中少弱精子症是男性不育最常见的原因之一,目前其机制尚未完全阐明。睾丸间质细胞是维持雄性动物正常生殖生理的重要生殖细胞之一,具有营养和支持生殖细胞、合成分泌雄性激素、促进精子的发生和男性生殖器官发育等作用。研究表明,氧化应激损伤是导致睾丸间质细胞受损的重要原因之一,因此,抑制损伤细胞的氧化应激作用,保护氧化损伤睾丸间质细胞的功能,对提高生育率具有重要的临床意义[1]。睾丸间质细胞是分泌和产生睾酮的主要细胞。研究表明,氧化应激能引起睾丸间质细胞损伤,从而引起睾酮等雄性激素分泌减少,影响精子发育[2]。另外,睾酮合成受睾酮合成酶的调控。研究表明,类固醇合成快速调节蛋白(steroidogenic acute regulatory protein, StAR)、P450 胆固醇侧链裂解酶(cholesterol side-chain cleavage enzyme, P450scc)、17β - 羟基固醇脱氢酶(17β -hydroxysteroid dehydrogenase, 17β-HSD)是睾酮合成与分泌的关键酶[3]。参杞强精颗粒由党参、枸杞子、黄芪、菟丝子、五味子、当归等组成,具有补肾健脾、活血养血、清热利湿、增强免疫作用,其传统汤剂已在临床应用10 年以上,是治疗少弱精症的有效方剂。前期研究发现,参杞强精传统汤剂对少弱精子症有较好的疗效,能显著提高少弱精子症患者的精子密度、活力及活率[4-5]。能够降低环磷酰胺所致脾肾两虚型睾丸生精障碍模型小鼠的生精细胞凋亡率,修复睾丸的病理损伤,恢复其生精功能[6]。但其在H2O2诱导睾丸间质细胞氧化应激损伤保护作用方面未见报道,因此,本研究采用H2O2诱导损伤睾丸间质细胞构建氧化应激损伤模型,探讨参杞强精颗粒对H2O2诱导睾丸间质细胞氧化应激损伤的保护作用。
1 材料与方法
1.1 细胞株与药物
小鼠睾丸间质细胞TM3 购自中国科学院细胞库,本研究室自行传代培养,维生素E 软胶囊由浙江医药股份有限公司新昌制药厂生产(批号:H33020187),参杞强精颗粒由广西中医药大学第一附属医院制剂中心提供(批号:20210915,中药民族药制剂备案号:桂药制备字Z20200023000,每1 g 颗粒相当于原生药2 g),实验时采用纯化蒸馏水超声溶解,经0.22 µm 孔径滤膜过滤除菌,再用细胞培养液稀释成所需浓度,4 ℃保存备用。
1.2 试剂
DMEM 培养基和胎牛血清(fetal bovine serum,FBS)购自美国Gibco 公司,胰蛋白酶和四甲基偶氮唑盐(MTT)购自美国Amersco 公司,CCK-8 试剂盒购自上海碧云天生物技术有限公司,TRIzol 试剂购自美国Invitrogen 公司,逆转录试剂购自德国Thermo 公司,磷酸盐缓冲液(phosphate buffer saline, PBS)购自福州迈新生物技术开发有限公司,SYBR 荧光定量聚合酶链反应试剂盒购自日本TaKaRa 公司,RIPA裂解液(含1 %蛋白酶抑制剂)购自上海碧云天生物技术有限公司,过氧化氢H2O2购于广东南国药业有限公司,睾酮、一氧化氮NO、乳酸脱氢酶(lactate dehydrogenase, LDH)、8- 羟基脱氧鸟苷(8-hydroxy-deoxyguanosine, 8-OHdG)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽-S 转移酶(glutathione-S-transferase, GST)、活性氧(reactive oxygen species, ROS)、丙二醛(Malondialdehyde, MDA)、过氧化氢酶(Catalase, CAT)及总抗氧化能力(total antioxidant capacity, TAOC)试剂盒均购自南京建成生物工程研究所。其他试剂均为分析纯。
1.3 仪器
Model 311 型二氧化碳孵箱(美国Thermo Forma公司),XD-101 型倒置光学显微镜(日本Olympus 公司),SW-CJ-1F 型超净工作台(苏净安泰生物科技有限公司),722S 型可见分光光度计(上海精密科学仪器有限公司),ABI 9700 型聚合酶链反应(PCR)扩增仪,Model 450 型自动酶标仪(美国Bio-Rad 公司),Tanon 5200 型全自动化学发光图像分析系统(上海天能科技有限公司),TGL-16G-A 型高速冷冻离心机(上海安亭科学仪器厂)。
1.4 方法
1.4.1 TM3 细胞培养 用含10% FBS 的DMEM 作为培养液,将TM3 细胞置于37 ℃,5%二氧化碳培养箱中静置培养,每天观察细胞生长情况,每两天更换1 次细胞培养液,采用0.25%胰酶对长满细胞进行消化传代,取对数生长期的细胞进行后续试验。
1.4.2 MTT 法检测参杞强精颗粒对TM3 细胞的毒性作用 采用0.25%胰酶将对数生长期TM3 细胞消化制成浓度为1×105/mL 的细胞悬液,并接种到96 孔培养板中,每孔200 µL,置于37 ℃,5%二氧化碳孵箱中继续培养24 h 贴壁后,丢弃培养液,加入含参杞强精颗粒的给药组,终浓度分别为0.05、0.50、2.50、5.00 和10.00 mg/mL,继续培养24 h,然后每孔加入MTT 20 µL,继续在37 ℃,5%二氧化碳孵箱中培养4 h,吸弃全部上清液,再在每孔加入二甲亚砜(Dimethylsulphoxide, DMSO)200 µL,在微量振荡器上振荡5 min,最后在酶标仪450 nm 波长处测定吸光度值,测定各组细胞活力。
1.4.3 H2O2损伤模型的构建及药物浓度筛选 参照参考文献[7]和前期预实验,采用0.25 %胰酶将对数生长期TM3 细胞消化制成浓度为1×105/mL 的细胞悬液,并接种到96 孔培养板中,每孔200 µL,分为8 组,每组6 个复孔,分别为正常组、H2O2损伤模型组、阳性对照组(10 µg/mL 维生素E)、参杞强精颗粒组(0.05、0.40、0.80、1.60、5.00 mg/mL),置于37 ℃,5%二氧化碳孵箱中继续培养24 h 贴壁后,丢弃培养液,正常组换用含10%胎牛血清的DMEM 培养液,其余各组加入终浓度为500 µmol/L H2O2完全培养液诱导建立氧化应激损伤模型,继续培养4 h 后,吸弃全部上清液,正常组和模型组加入200 µL 完全培养液,阳性对照组加入终浓度10 µg/mL 维生素E 的培养液,其余给药组加入等体积终浓度分别为0.05、0.40、0.80、1.60 和5.00 mg/mL 的参杞强精颗粒药液,继续培养24 h 后,每孔加入10 µL CCK-8,混匀后置37 ℃,5%二氧化碳培养箱中孵育2 h,最后采用自动酶标仪(检测波长为450 nm)检测各组OD 值,筛选最佳给药浓度。
1.4.4 分组给药 采用0.25%胰酶将对数生长期TM3 细胞消化制成浓度为1×105/mL 的细胞悬液,并接种到96 孔培养板中,每孔200 µL,分为5 组,分别为正常组、H2O2损伤模型组、参杞强精颗粒低中高剂量组(0.4、0.8 和1.6 mg/mL),每组6 个复孔,置于37 ℃,5%二氧化碳孵箱中继续培养24 h 贴壁后,丢弃培养液,正常组换用含10 %胎牛血清的DMEM 培养液,模型组和参杞强精颗粒给药组加入终浓度为500 µmol/L H2O2完全培养液诱导建立氧化应激损伤模型,继续培养4 h 后,吸弃全部上清液,正常组和模型组加入200 µL 完全培养液,其余给药组加入等体积终浓度分别为0.4,0.8 和1.6 mg/mL 的参杞强精颗粒药液,继续培养24 h 后,收集各组细胞上清液和细胞,待后续进一步检测。
1.4.5 酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)检测细胞上清液中睾酮、NO、LDH、8-OHdG、GST 的活性 按照1.4.4 复制H2O2损伤模型并分组给药,收集各组细胞上清液,同时根据睾酮、NO、LDH、8-OHdG、GST试剂盒说明书配置好相关工作液,向稀释后的标准品中加入各组细胞上清液50 µL,混匀后于恒温水浴锅中温育0.5 h,分别加入50 µL 酶标志物、显色剂A 和显色剂B 各50 µL,混匀后,37 ℃避光显色15 min,最后加入50 µL终止液,用酶标仪检测各孔450 nm波长处吸光度值。
1.4.6 ELISA 检测细胞内ROS、MDA、CAT、SOD、TAOC 的含量 按照1.4.4 复制H2O2损伤模型并分组给药,连续培养24 h 后,去上清液,胰蛋白酶消化后制成细胞悬液,4 000 r /min 离心5 min 收集细胞,采用超声破碎法收集各组细胞裂解液,2 500 r /min离心10 min,取上清液,严格按ELISA 试剂盒说明书方法(同1.4.5 ELISA 操作方法),分别检测细胞内ROS、MDA、CAT、SOD、TAOC 的含量。
1.4.7 实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction, qRT-PCR)检测睾酮合成酶StAR、P450scc、17β-HSD mRNA 表达 按照1.4.4 复制H2O2损伤模型并分组给药,连续培养24 h后,去上清液,胰蛋白酶消化后制成细胞悬液,4 000 r/min 离心5 min 收集细胞,严格按照TRIzol试剂盒说明书提取细胞总RNA,测定总RNA 纯度及浓度,并将RNA 逆转录成cDNA,然后以cDNA 为模板进行qRT-PCR 反应,反应体系:SYBR Premix Ex Taq(2×)10 µL,正向引物(10 µmol/L)0.2 µL,反向引物(10 µmol/L)0.2 µL,cDNA 模板1 µL,ROX reference dye(50×)0.4 µL,ddH2O 补足体系至20 µL。反应条件:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火15s,72 ℃延伸30 s,共40 个循环。本实验中StAR、P450scc、17β-HSD 基因的引物设计合成及验证均由大连宝生生物工程有限公司完成。以β-actin 为内参基因,采用2-ΔΔCt法分析各基因在细胞中的相对表达量。各引物序列见表1。

表1 qRT-PCR引物序列
1.5 统计学方法
数据分析采用SPSS 20.0 统计软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 参杞强精颗粒对正常TM3细胞毒性作用
MTT 结果显示,各组细胞存活率的比较,经方差分析,差异有统计学意义(P<0.05)。与正常组比较,参杞强精颗粒在浓度为0.05~2.50 mg/mL 时对正常TM3 细胞增殖活性无明显毒性作用(P>0.05);当参杞强精颗粒浓度为5.00~10.00 mg/mL 时对正常TM3 细胞增殖活性有一定的毒性作用(P<0.05)。见表2。
表2 不同浓度参杞强精颗粒对正常TM3细胞毒性的影响(±s)
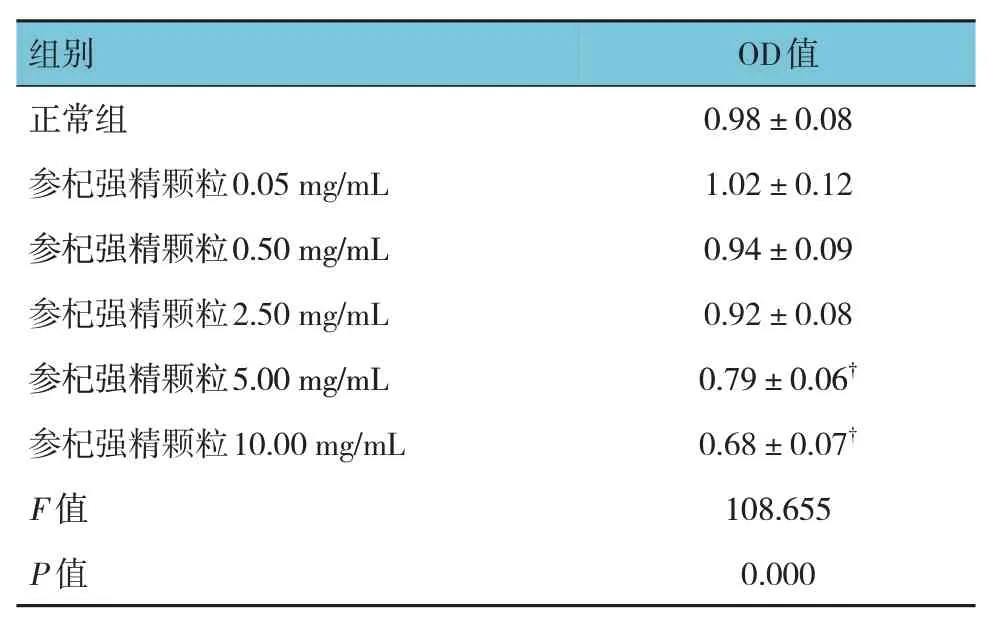
表2 不同浓度参杞强精颗粒对正常TM3细胞毒性的影响(±s)
注 : †与正常组比较,P <0.05。
组别正常组参杞强精颗粒0.05 mg/mL参杞强精颗粒0.50 mg/mL参杞强精颗粒2.50 mg/mL参杞强精颗粒5.00 mg/mL参杞强精颗粒10.00 mg/mL F 值P 值OD值0.98±0.08 1.02±0.12 0.94±0.09 0.92±0.08 0.79±0.06†0.68±0.07†108.655 0.000
2.2 参杞强精颗粒对H2O2损伤的TM3细胞增殖活力的影响
MTT 实验结果显示,各组细胞存活率比较,经方差分析,差异有统计学意义(P<0.05)。与正常组比较,H2O2损伤模型组中TM3 细胞增殖活力下降(P<0.05),与H2O2损伤模型组比较,参杞强精颗粒在浓度为0.05~5.00 mg/mL 时能提高TM3 细胞的增殖活力(P<0.05),且在0.05~1.60 mg/mL 范围内,TM3 细胞的增殖活力随药物浓度的升高而增强(见表3)。后续药效试验选择0.40、0.80 和1.60 mg/mL作为参杞强精颗粒低剂量组、中剂量组和高剂量组。
表3 参杞强精颗粒对H2O2损伤的TM3细胞增殖活力的影响 (±s)
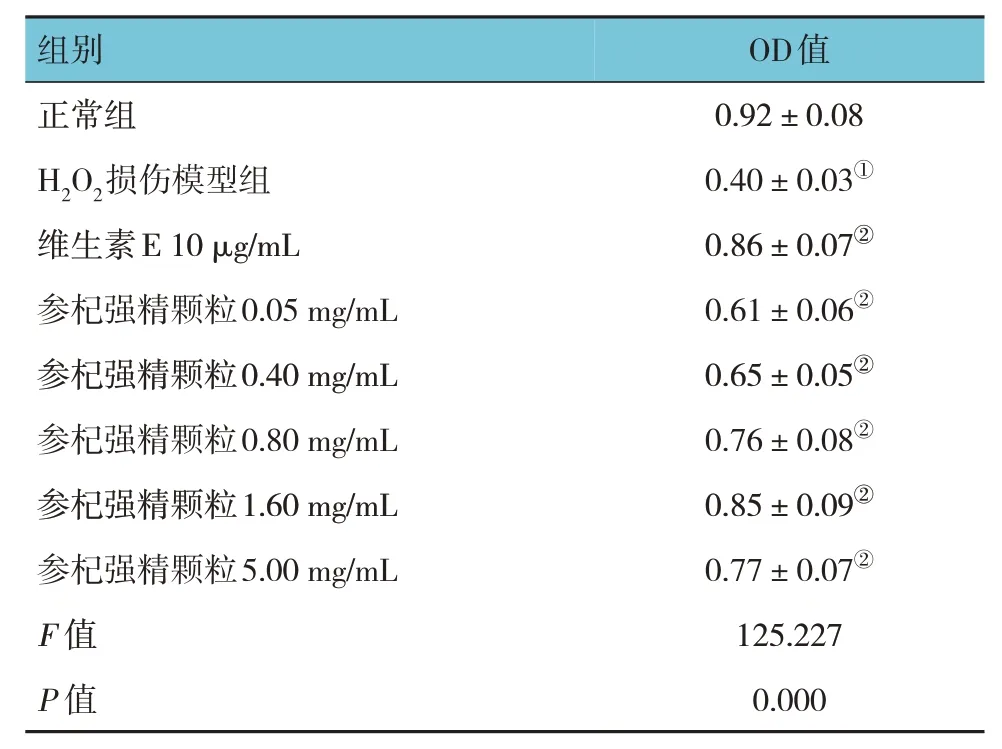
表3 参杞强精颗粒对H2O2损伤的TM3细胞增殖活力的影响 (±s)
注 : ①与正常组比较,P <0.05; ②与H2O2损伤模型组比较,P <0.05。
OD值0.92±0.08 0.40±0.03①0.86±0.07②0.61±0.06②0.65±0.05②0.76±0.08②0.85±0.09②0.77±0.07②125.227 0.000组别正常组H2O2损伤模型组维生素E 10 µg/mL参杞强精颗粒0.05 mg/mL参杞强精颗粒0.40 mg/mL参杞强精颗粒0.80 mg/mL参杞强精颗粒1.60 mg/mL参杞强精颗粒5.00 mg/mL F 值P 值
2.3 参杞强精颗粒对细胞上清液中睾酮、NO、LDH、8-OHdG、GST活性影响
ELISA 结果显示,各组细胞上清液中睾酮、NO、LDH、8-OHdG、GST 活性比较,经方差分析,差异均有统计学意义(P<0.05)。与正常组比较,H2O2损伤模型组睾酮水平、NO 含量、GST 活性降低(P<0.05),LDH 和8-OHdG 含量升高(P<0.05);与H2O2损伤模型组比较,参杞强精颗粒各剂量组均能提高睾酮水平、NO 含量(P<0.05),增加GST 活性(P<0.05),同时降低LDH 和8-OHdG 含量(P<0.05);参杞强精颗粒低、中、高剂量组(0.40、0.80 和1.60 mg/mL)两两比较,差异均有统计学意义(P<0.05)。见表4。
表4 参杞强精颗粒对上清液中睾酮、NO、LDH、8-OHdG、GST活性影响 (±s)

表4 参杞强精颗粒对上清液中睾酮、NO、LDH、8-OHdG、GST活性影响 (±s)
注 : ①与正常组比较,P <0.05; ②与H2O2损伤模型组比较,P <0.05; ③与参杞强精颗粒0.40 mg/mL 组比较,P <0.05; ④与参杞强精颗粒0.80 mg/mL组比较,P <0.05。
组别正常组H2O2损伤模型组参杞强精颗粒0.40 mg/mL参杞强精颗粒0.80 mg/mL参杞强精颗粒1.60 mg/mL F 值P 值NO/(µmol/mL)8.22±0.79 4.79±0.50①5.26±0.46①②6.63±0.61①②③7.94±0.80①②③④104.854 0.000 LDH/(u/mL)50.13±5.07 136.77±15.01①91.09±9.38①②80.04±9.05①②③65.33±5.82①②③④174.338 0.000 GST/(u/mL)45.66±4.73 20.71±2.11①29.56±3.06①②35.88±4.13①②③40.05±4.46①②③④155.219 0.000睾酮/(ng/mL)4.85±0.54 2.06±0.16①2.99±0.31①②3.81±0.35①②③4.07±0.39①②③④91.006 0.000 8-OHdG/(ng/mL)5.25±0.49 12.17±1.63①9.01±0.88①②7.83±0.74①②③6.14±0.65①②③④115.960 0.000
2.4 参杞强精颗粒对细胞内ROS、MDA、CAT、SOD、TAOC含量的影响
ELISA 结果显示,各组细胞内ROS、MDA、CAT、SOD、TAOC 含量比较,经方差分析,差异均有统计学意义(P<0.05)。与正常组比较,H2O2损伤模型组细胞内ROS、MDA 含量均升高(P<0.05),CAT、SOD 和总抗TAOC 的活性均下降(P<0.05);与H2O2损伤模型组比较,参杞强精颗粒各剂量组均降低细胞内ROS 和MDA 含量(P<0.05),均增强CAT、SOD 和TAOC 的活性(P<0.05);参杞强精颗粒低剂量组、中剂量组、高剂量组(0.40、0.80 和1.60 mg/mL)两两比较,差异均有统计学意义(P<0.05)。见表5。
表5 参杞强精颗粒对细胞内ROS、MDA、CAT、SOD、TAOC含量的影响 (±s)
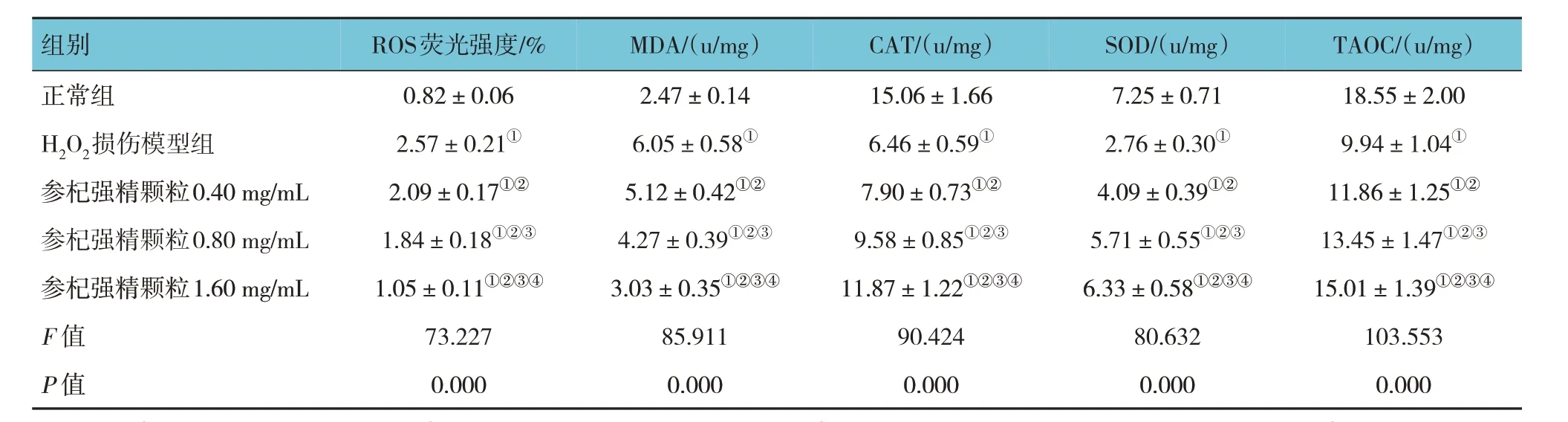
表5 参杞强精颗粒对细胞内ROS、MDA、CAT、SOD、TAOC含量的影响 (±s)
注 : ①与正常组比较,P <0.05; ②与H2O2损伤模型组比较,P <0.05; ③与参杞强精颗粒0.40 mg/mL 组比较,P <0.05; ④与参杞强精颗粒0.80 mg/mL组比较,P <0.05。
组别正常组H2O2损伤模型组参杞强精颗粒0.40 mg/mL参杞强精颗粒0.80 mg/mL参杞强精颗粒1.60 mg/mL F 值P 值MDA/(u/mg)2.47±0.14 6.05±0.58①5.12±0.42①②4.27±0.39①②③3.03±0.35①②③④85.911 0.000 CAT/(u/mg)15.06±1.66 6.46±0.59①7.90±0.73①②9.58±0.85①②③11.87±1.22①②③④90.424 0.000 TAOC/(u/mg)18.55±2.00 9.94±1.04①11.86±1.25①②13.45±1.47①②③15.01±1.39①②③④103.553 0.000 ROS荧光强度/%0.82±0.06 2.57±0.21①2.09±0.17①②1.84±0.18①②③1.05±0.11①②③④73.227 0.000 SOD/(u/mg)7.25±0.71 2.76±0.30①4.09±0.39①②5.71±0.55①②③6.33±0.58①②③④80.632 0.000
2.5 参杞强精颗粒对睾酮合成酶StAR、P450scc、17β-HSD mRNA表达的影响
qRT-PCR 结果显示,各组细胞内睾酮合成酶StAR、P450scc、17β-HSD mRNA 相对表达量比较,经方差分析,差异均有统计学意义(P<0.05)。与正常组比较,H2O2损伤模型组中睾酮合成酶StAR、P450scc、17β-HSD mRNA 相对表达量下降(P<0.05);与H2O2损伤模型组比较,参杞强精颗粒各剂量组能提高睾酮合成酶StAR、P450scc、17β-HSD mRNA 相对表达量(P<0.05);参杞强精颗粒低、中、高剂量组(0.40、0.80 和1.60 mg/mL)两两比较,差异均有统计学意义(P<0.05)。见表6。
表6 参杞强精颗粒对睾酮合成酶StAR、P450scc、17β-HSD mRNA相对表达量的影响 (±s)
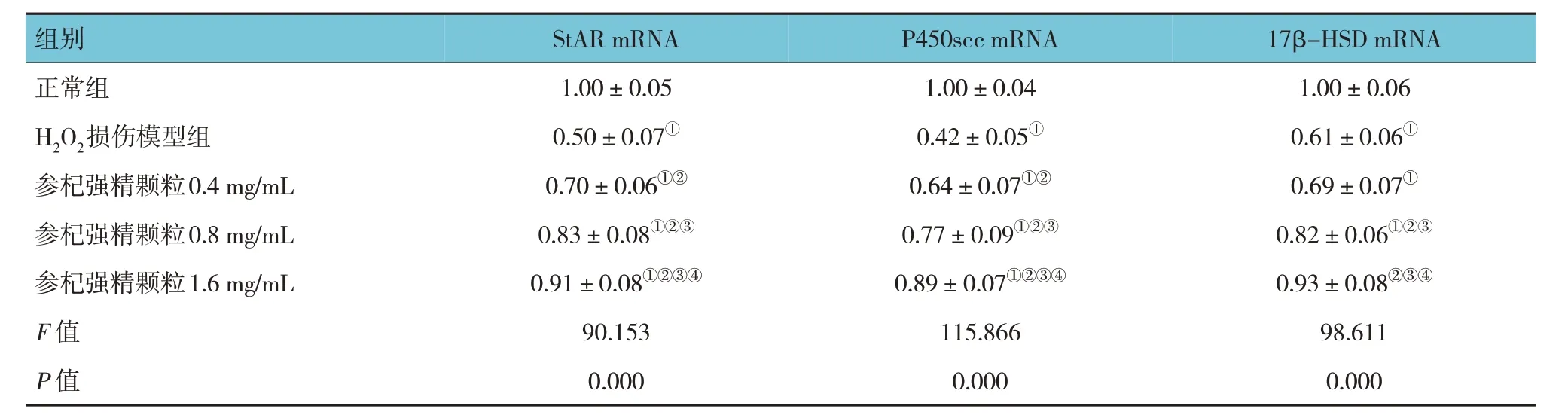
表6 参杞强精颗粒对睾酮合成酶StAR、P450scc、17β-HSD mRNA相对表达量的影响 (±s)
注 : ①与正常组比较,P <0.05; ②与H2O2损伤模型组比较,P <0.05; ③与参杞强精颗粒0.40 mg/mL 组比较,P <0.05; ④与参杞强精颗粒0.80 mg/mL组比较,P <0.05。
17β-HSD mRNA 1.00±0.06 0.61±0.06①0.69±0.07①0.82±0.06①②③0.93±0.08②③④98.611 0.000组别正常组H2O2损伤模型组参杞强精颗粒0.4 mg/mL参杞强精颗粒0.8 mg/mL参杞强精颗粒1.6 mg/mL F 值P 值StAR mRNA 1.00±0.05 0.50±0.07①0.70±0.06①②0.83±0.08①②③0.91±0.08①②③④90.153 0.000 P450scc mRNA 1.00±0.04 0.42±0.05①0.64±0.07①②0.77±0.09①②③0.89±0.07①②③④115.866 0.000
3 讨论
睾丸间质细胞是睾丸中一种能特异性产生男性雄激素的细胞,受垂体前叶嗜碱性细胞分泌的间质细胞刺激素的作用,可促进精子的发生和男性生殖器官发育,并维持第二性征和性功能[8]。氧化应激是细胞暴露于高浓度氧分子或氧的化学衍生物而引起的细胞损伤,导致炎症细胞浸润,蛋白酶分泌增加,产生大量氧化中间产物。研究表明,睾丸间质细胞氧化应激损伤是导致男性不育的重要原因之一[9]。因此,通过抑制氧化应激损伤及清除睾丸间质细胞内活性氧,对保护睾丸间质细胞具有重要意义。
H2O2是机体内代谢产生的一种ROS,是机体自由基产生的重要环节,在正常的生理条件下,机体内ROS 的产生和清除维持正常生理平衡,当在病理条件下,这种正常平衡被打破,导致大量ROS 的产生,引发细胞膜中不饱和脂肪酸发生过氧化,使机体长期处于氧化应激状态,进而氧化细胞DNA、脂类、蛋白质等,诱导细胞凋亡,导致某些酶失活,从而导致细胞功能损伤[10]。目前TM3 细胞氧化应激损伤的模型主要有H2O2诱导、重金属诱导、偶氮二异丁脒盐酸盐(AAPH)诱导等,其中,H2O2诱导是最为常见且成熟的模型,其作为一种ROS,能抑制细胞增殖,造成细胞内大分子氧化损伤,最终导致细胞衰老、死亡、突变等严重后果。因此,H2O2诱导的氧化应激细胞模型普遍用于探究自由基介导的细胞损伤机制及抗氧化剂对氧化损伤的保护和修复机制。因此,本实验研究表明在给予500 µmol/L H2O2诱导损伤睾丸间质细胞4 h 后,TM3 细胞分泌睾酮的功能逐渐下降,细胞内ROS 增加,引起氧化应激和过氧化损伤。
睾酮又称睾丸素,是男性最重要的雄激素,男性睾酮全部在睾丸间质细胞线粒体内合成,具有促进生殖器官发育和生长,维持男性第二性征发育,同时维持前列腺和精囊生精功能的作用,能促进蛋白质合成和骨骼生长。研究表明,睾丸间质细胞合成睾酮是一系列酶促反应的结果[11]。睾酮合成酶主要包括StAR、P450scc、17β-HSD,其中P450scc 在线粒体是睾酮合成的关键限速酶,而StAR 主要将睾酮的前体胆固醇从线粒体膜外转运至膜内[12],17β-HSD 在靶组织中起着甾体类激素受体前调节的分子开关作用,其能催化睾酮的类固醇激素生物合成,促进睾酮合成。本研究结果表明,参杞强精颗粒能明显提高TM3 细胞存活率,提高细胞上清液睾酮水平,且能提高睾酮合成酶StAR、P450scc、17β-HSD mRNA 相对表达量。8-OHdG 是ROS 自由基如羟自由基、单线态氧等攻击DNA 分子中的鸟嘌呤碱基第8 位碳原子而产生的一种氧化性加合物,其作为内源性及外源性因素对DNA 氧化损伤作用的生物标志物,其含量的高低是评估体内氧化损伤程度,以及氧化应激与DNA损伤相互关系的重要指标之一[13]。本研究结果显示参杞强精颗粒能显著降低8-OHdG 含量,表明其能改善TM3 细胞氧化应激及过氧化损伤。
以上研究结果表明,参杞强精颗粒对正常TM3细胞无毒性作用,参杞强精颗粒对H2O2诱导睾丸间质细胞氧化应激损伤具有保护作用,其机制可能与清除氧自由基、抗氧化应激损伤及促进睾酮合成有关。本研究为睾丸间质细胞氧化应激损伤导致男性不育的临床治疗提供了新思路,为参杞强精颗粒在临床的开发应用提供可靠的科学依据,但其作用机制仍需进一步深入研究。

