新型炎症评分系统与胃癌延迟性术后肠麻痹的关系及预测模型构建*
方亮, 李欣, 肖丹, 余发珍, 陈伟琴, 虞黎明, 邹镇洪
(南昌大学第二附属医院, 江西 南昌 330006)
术后肠麻痹(postoperative ileus, POI)是腹部手术常见并发症,定义为术后胃肠动力暂时性障碍,表现出恶心、呕吐、无法进食、腹胀、疼痛,以及无排气、排便[1]。正常或不复杂的POI 是术后不可避免的生理反应,通常在3 d 内消失,当超出预期时间时,则定义为延迟性术后肠麻痹(prolonged postoperative ileus, PPOI)[2-3], 其发生率为3%~32%。腹部手术部位之间存在一定差异[4],可进一步引进相关并发症,包括持续胃肠道不适、疼痛,营养不良需要肠外营养,以及术后其他并发症风险,致使患者术后恢复延迟。此外,PPOI 是导致术后住院时间延长和住院费用增加的重要原因[5]。一些研究试图描述PPOI 的生理病理机制,但其是一个复杂、多因素综合结果,如对手术反应、交感神经系统过度激活、全身内分泌和炎症反应、细胞因子作用及围手术期护理似乎均参与了PPOI机制[6-7]。因PPOI 治疗策略有限,识别PPOI 危险因素能早期预警其发生风险已成为临床诊疗的重点。此外,了解可能的危险因素有助于向患者提供咨询,并提高医护人员的PPOI 预防意识。
胃癌是癌症相关死亡的第3 大常见原因,也是中国最普遍、常见的癌症类型。临床观察到胃癌根治术患者PPOI 的发生率高达31.1%[8]。目前已有研究强调炎症反应标志物在胃癌生存[9]及术后并发症[10]中的临床意义。然而,炎症反应标志物与PPOI 之间的关系尚不明确。本研究旨在探讨PPOI与临床中常见易获得的几种炎症反应标志物的关系。此外,本研究试图整合炎症反应标志物并构建一种新型炎症评分系统,旨在更能反映机体炎症的反应特点,提高预测PPOI 能力。
1 资料与方法
1.1 一般资料
选取2019 年1 月—2021 年8 月在南昌大学第二附属医院行根治术的299 例胃癌患者。纳入标准:①术前均经腹部CT、食管胃十二指肠镜及活检标本诊断为胃腺癌并符合根治术适应证[11];②年龄>18 岁;③未接受新辅助放化疗和免疫治疗;④肝肾功能正常。排除标准:①合并其他部位癌症;②自身免疫性疾病、急性炎症、慢性炎症或感染炎症及血液病;③不可控糖尿病或高血压;④3 个月内有激素治疗史;⑤精神药物依赖或成瘾;⑥临床资料不全。最终纳入胃癌患者299 例,分为训练集199 例与验证集100 例。本研究经医院医学伦理委员会审核批准,患者均签署知情同意书。
1.2 方法
1.2.1 数据收集 收集患者一般临床资料,包括年龄、性别、体质量指数(body mass index, BMI)、美 国 麻 醉 师 协 会(American Society of Anesthesiologists, ASA)分级、 Charlson 共病指数(Charlson comorbidity index, CCI)、肿瘤大小、TNM分期、手术方式(腹腔镜、开放)、重建方式(胃十二指肠吻合术、胃空肠吻合术、Roux-en-Y 吻合术)。炎症反应标志物:中性粒细胞与淋巴细胞比值(neutrophil-lymphocyte ratio, NLR)、血小板与淋巴细胞比值(platelet-lymphocyte ratio, PLR)、淋巴细胞与单核细胞比值(lymphocyte-monocyte ratio, LMR)及C 反应蛋白与白蛋白比值(C-reactive protein-toalbumin ratio, CAR)。
1.2.2 PPOI 定义 患者在术后第4 天或更长时间内满足以下≥2 项标准则诊断为PPOI[12]:①恶心或呕吐持续12 h 或更长时间无缓解;②对固体或半固体口服饮食不耐受;③持续腹胀;④24 h 或更长时间无大便和排气;⑤腹部平片或CT 显示肠梗阻。
1.3 统计学方法
数据分析采用SPSS 22.0 和R 4.0.2 统计学软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以构成比或率(%)表示,比较用χ2检验;用MedCalc 软件绘制受试者工作特征(receiver operating characteristic, ROC)曲线;影响因素的分析采用多因素Logistic 回归模型;采用“Hmisc”及“rms”等包构建Nomogram 模型并进行内部数据集校正分析、ROC 曲线分析及决策曲线分析。在验证集中,对Nomogram 模型进行校正分析、ROC 曲线分析及决策曲线分析。P<0.05 为差异有统计学意义。
2 结果
2.1 训练集、验证集不同因素间的比较
训练集与验证集无PPOI 和PPOI 患者的年龄、ASA 分级、CCI、肿瘤大小、TNM 分期、手术方式、NLR、PLR、LMR 及CAR 比较,差异均有统计学意义(P<0.05)。见表1。
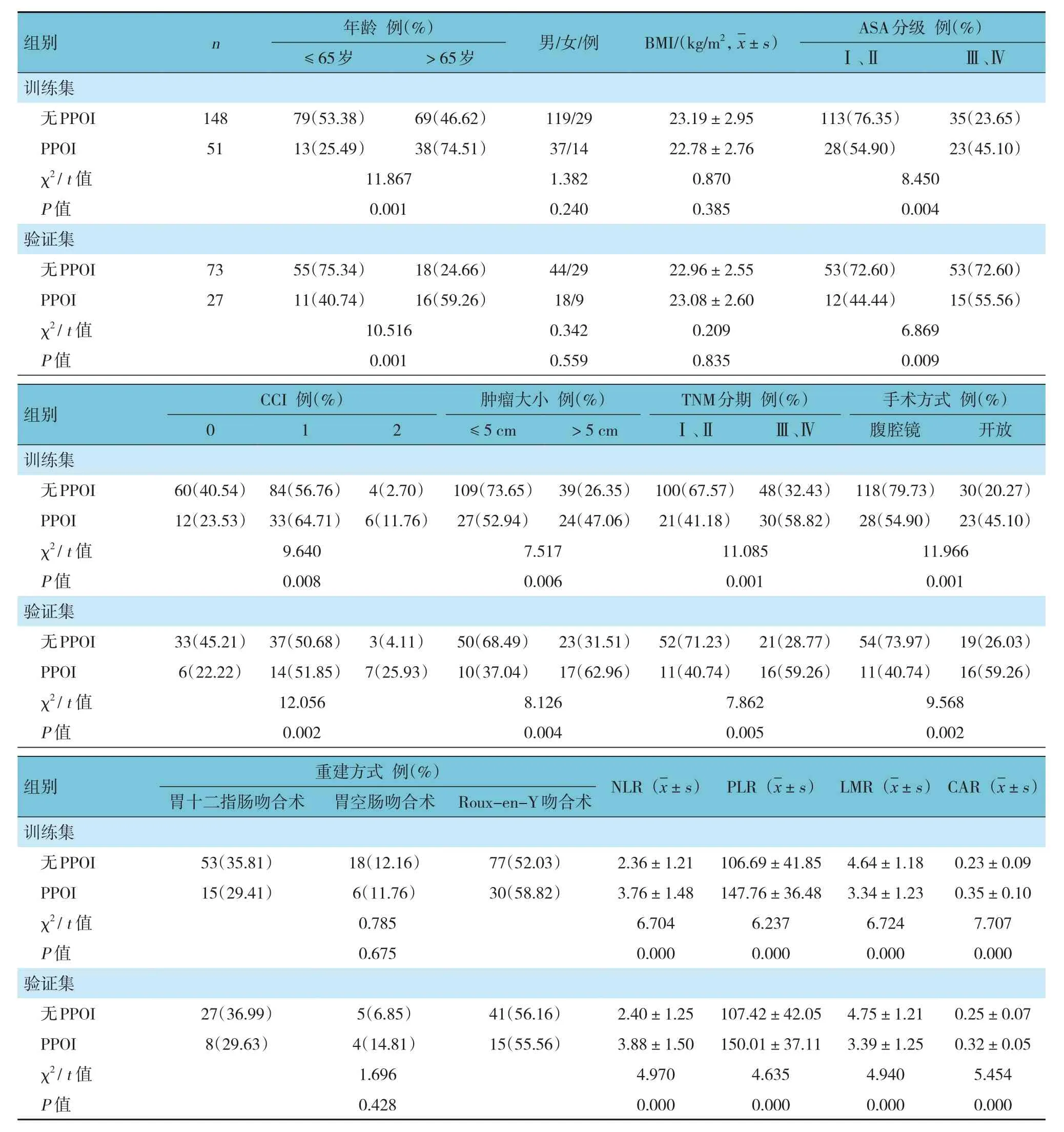
表1 训练集、验证集不同因素间的比较
2.2 训练集NLR、PLR、LMR 及CAR 的ROC 曲线分析
将表1 中训练集数据用MedCalc 软件绘制ROC曲线,分析结果显示,NLR、PLR、LMR 及CAR 的敏感性分别为78.43%、86.27%、68.63%和76.47%;特异性分别为69.59%、61.49%、79.73%和73.65%。ROC 曲线下面积(area under curve, AUC)分别为0.775、0.776、0.778 和0.808;最佳截断值分别为> 2.8、> 113.71、≤ 3.68 和> 0.28。见表2 和图1。
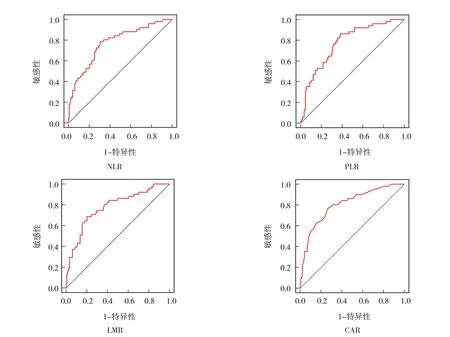
图1 4种炎症反应标志物的ROC曲线
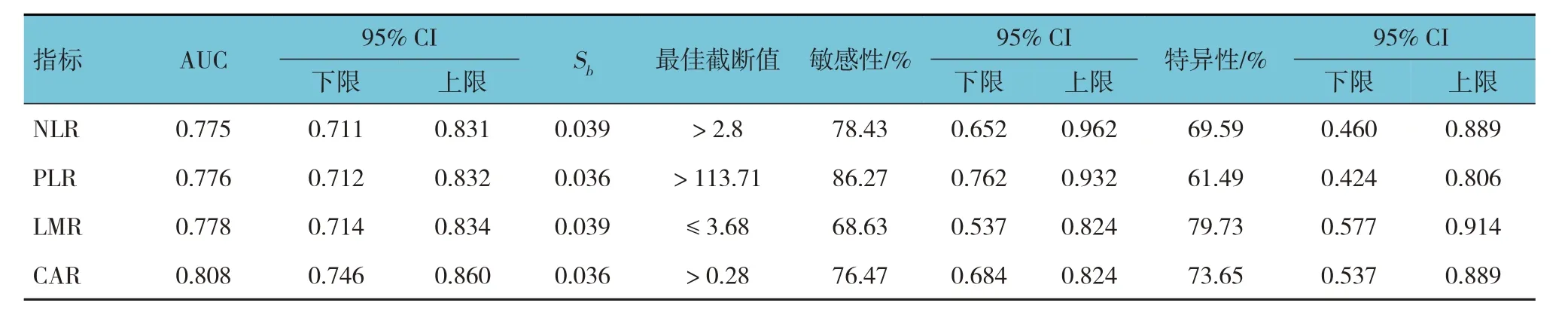
表2 训练集NLR、PLR、LMR及CAR对胃癌患者术后发生PPOI的效能分析
2.3 胃癌患者术后PPOI发生的危险因素分析
将表1 中年龄(≤ 65 岁= 0,> 65 岁= 1)、ASA 分级(Ⅰ、Ⅱ = 0,Ⅲ、Ⅳ = 1)、CCI(0 = 0,1 = 1,2 = 2)、肿瘤大小(≤ 5 cm = 0,> 5 cm = 1)、TNM 分期(Ⅰ、Ⅱ =0, Ⅲ、Ⅳ = 1)、手术方式(腹腔镜= 0,开放= 1)、NLR(≤ 2.8 = 0,> 2.8 = 1)、PLR(≤ 113.71 =0, >113.71 = 1)、LMR(> 3.68 = 0,≤ 3.68 = 1)及CAR(≤ 0.28 = 0,> 0.28 = 1)作为自变量,以胃癌患者术后PPOI 为因变量,进行多因素Logistic 回归分析(α入=0.05,α出=0.10)。结果显示:年龄≥ 65 岁[=4.102(95% CI:1.042,16.149)]、ASA 分级Ⅲ、Ⅳ级[=3.061(95% CI:0.885,10.586)]、TNM 分期Ⅲ、Ⅳ期[=3.825(95% CI:2.698,6.033)]、开放式手术[=4.063(95% CI:3.263,8.268)]、NLR≥2.67[=2.171(95% CI:1.368,3.445)]及CAR≥0.28[=1.028(95% CI:1.011,1.046)]是胃癌患者术后PPOI 发生的独立危险因素(P<0.05)。见表3。
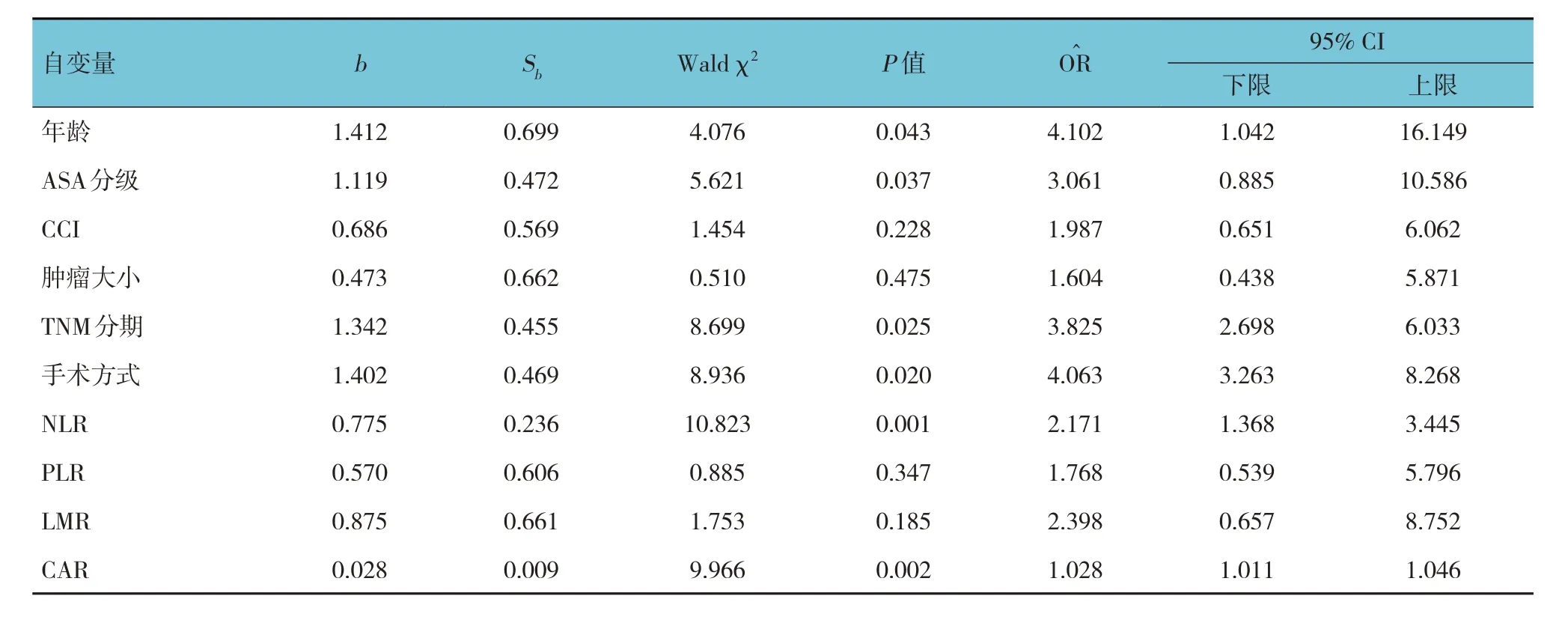
表3 影响胃癌患者术后PPOI发生的多因素Logistic回归分析参数
2.4 新型炎症评分系统构建及危险因素分析
根据NLR 及CAR 的截断值,构建NLR-CAR 评分(NLR-CAR score, NLR-CARs),评分标准:0分,不满足NLR > 2.8、CAR > 0.28;1 分,满足NLR > 2.8、CAR >0.28 其中的1 个标准;2 分,同时满足NLR >2.8、CAR > 0.28。Logistic 回归分析结果显示,NLR-CARs是胃癌患者PPOI 发生的独立危险因素(P<0.05)。见表4。
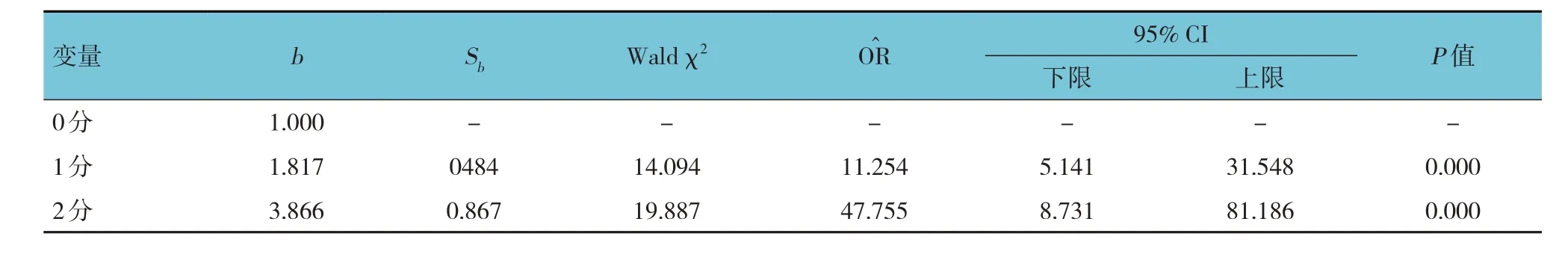
表4 基于NLR-CARs的多因素Logistic回归分析参数
2.5 基于NGS 构建胃癌患者PPOI 的Nomogram预测模型
根据表3结果,基于每个变量回归系数,构建胃癌患者PPOI发生风险的Nomogram预测模型。见图2。
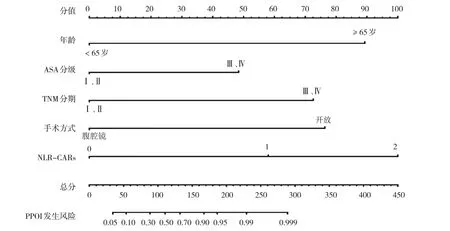
图2 基于NLR-CARs构建胃癌患者发生PPOI发生风险的Nomogram模型
2.6 Nomogram模型校正曲线及决策曲线分析
训练组校正曲线分析显示一致性指数(concordance index, C-index)为0.892,ROC 曲线分析结果显示AUC 为0.889,当预测PPOI 发生风险阈值> 0.185 时,Nomogram 预测模型提供显著的临床净收益且收益程度均高于其他临床指标。验证组校正曲线分析显示C-index 为0.817,ROC 曲线分析结果显示AUC 为0.806,当预测PPOI 发生风险阈值>0.056 时,Nomogram 预测模型提供显著的临床净收益且收益程度均高于其他临床指标。见图3~5。
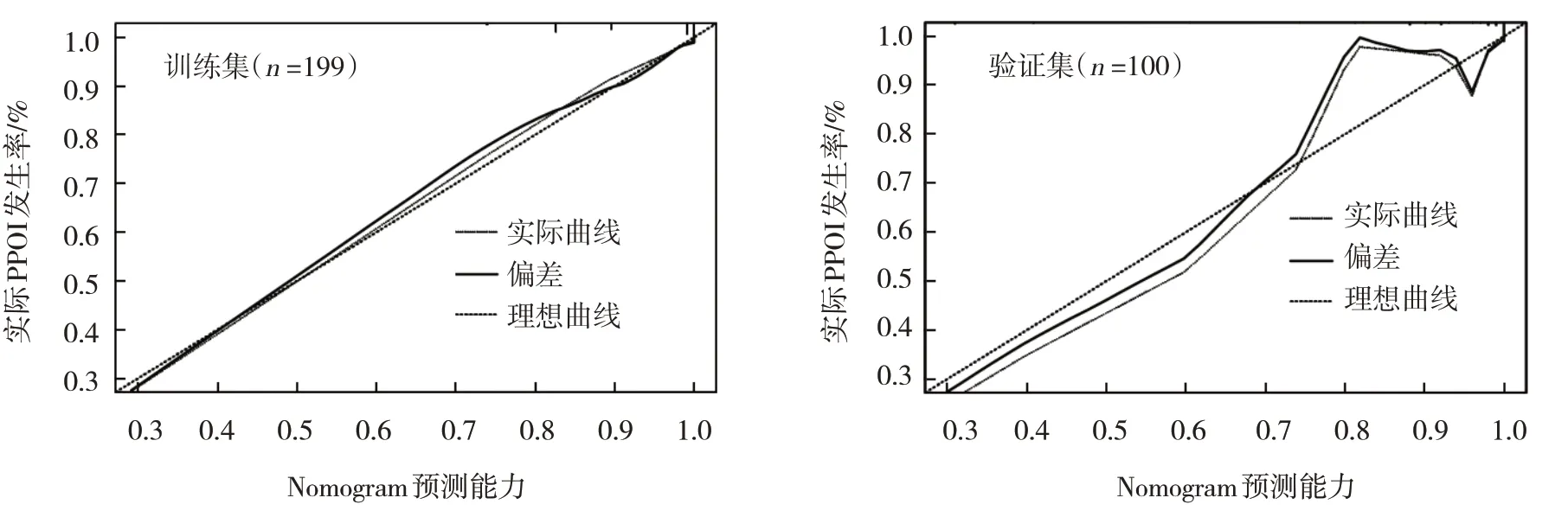
图3 基于内外部数据集的Nomogram模型校正曲线
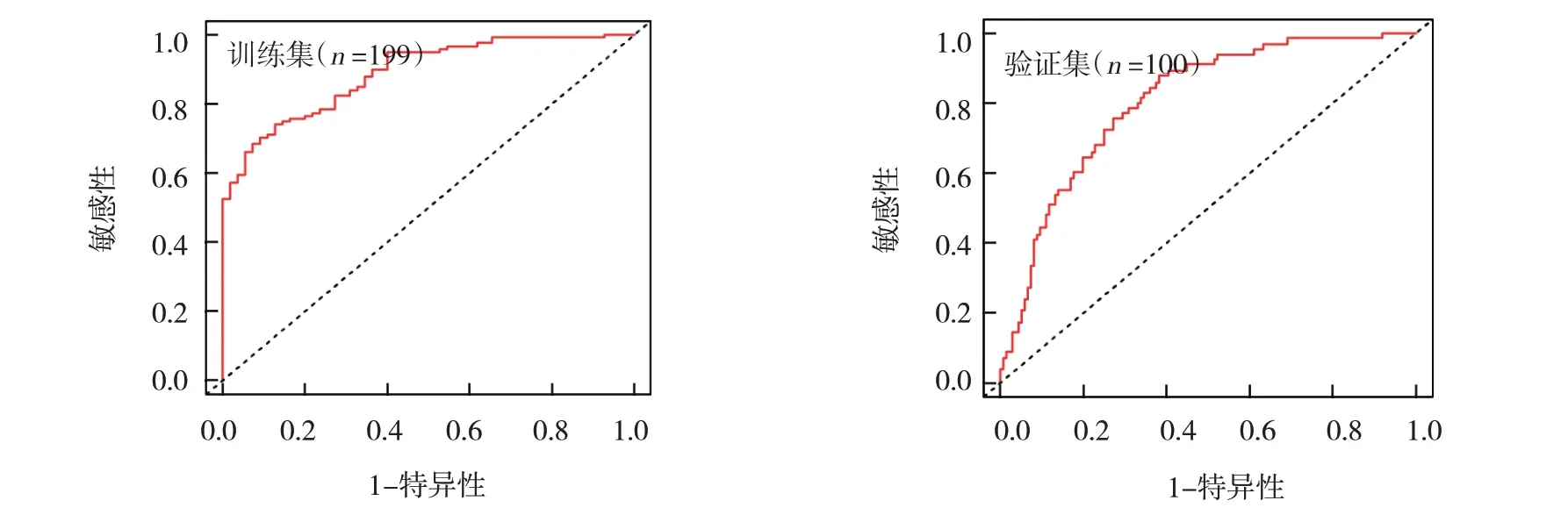
图4 基于内外部数据集的Nomogram模型ROC曲线
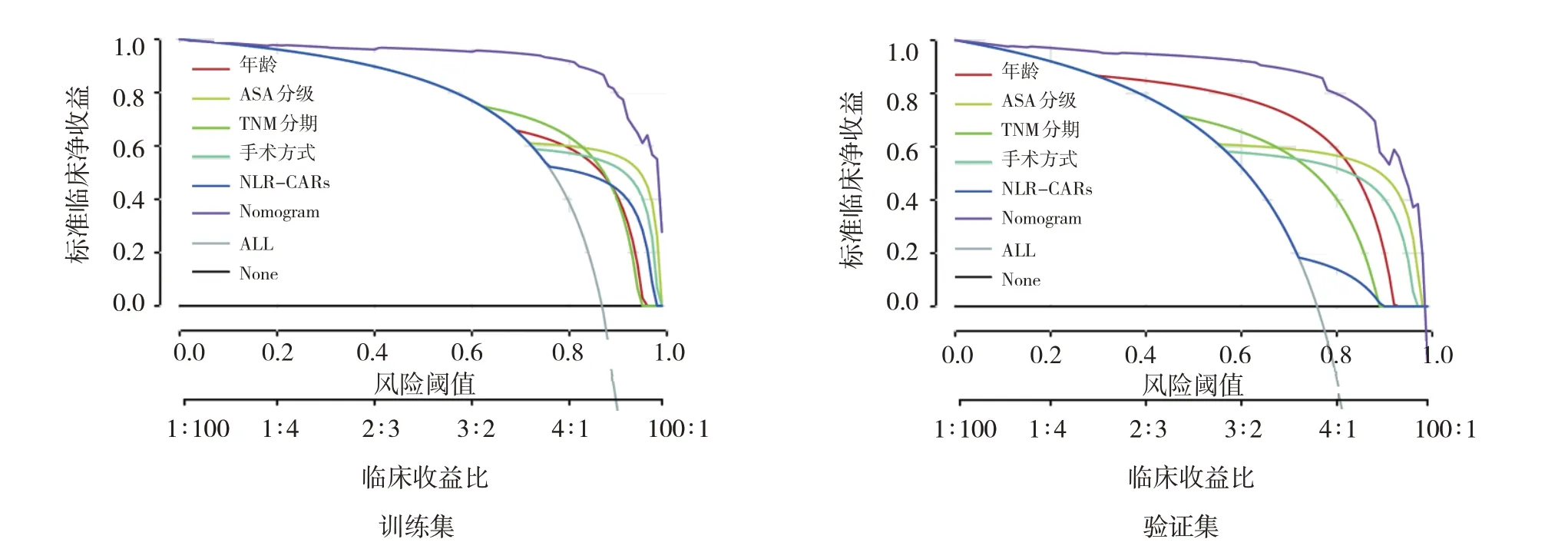
图5 基于内外部数据集的Nomogram模型DCA曲线
3 讨论
本研究共诊断83 例(27.8%)PPOI,与既往报道结果相似[4,8]。临床研究强调常用的炎症反应标志物可以准确预测术后并发症,在临床中具有独特预后价值[9-10]。本研究首次探讨胃癌PPOI 发生风险与NLR、PLR、LMR 及CAR 4 种炎症反应标志物之间关系。首先,本研究证实术前NLR、CAR 是胃癌PPOI 发生的独立危险因素;随后,将NLR、CAR进行整合,创建一种新型炎症评分NLR-CARs 并证实与胃癌PPOI 发生风险独立相关。据所知,这是第一个关于NLR-CARs 在胃癌患者PPOI 中的临床价值研究。由于PPOI 治疗策略有限,预防是临床重点。因此,这项研究基于NLR-CARs 构建一种Nomogram 模型,通过内部数据集及外部数据集证实该预测模型能有效预测PPOI 发生风险。因此,这项研究为医护在评估胃癌根治术患者PPOI 风险时提供了切实可行的工具,并有助于识别高危患者。
肿瘤组织中存在大量的炎症细胞,至今,在对慢性萎缩性胃炎和幽门螺杆菌感染的研究中发现,胃癌是由慢性炎症引起的癌症之一[13]。因此,很多学者观察到胃癌患者机体炎症反应程度越高,表现出的预后越差,强调机体炎症反应在临床具有重要意义[10,14]。机体促炎机制和抗炎机制间的失衡会增加PPOI 易感性及严重程度和持续时间。已初步观察到机体炎症反应对其起着关键作用,过程包括多种免疫、炎症细胞(巨噬细胞、树突状细胞、肥大细胞、单核细胞、中性粒细胞)参与,以及肠道内微生物群变化并伴有细菌过度生长和移位,由此产生炎症反应导致胃肠道功能障碍[15]。因此,术前高炎症反应患者可能属于PPOI 高发群体。与预期结果一致,本研究发现NLR ≥ 2.67 及CAR ≥0.28 是胃癌患者术后PPOI 发生的独立危险因素,术前高炎症反应水平,预示高PPOI 发生风险。以NLR 升高为特征的癌症相关炎症,通过调节性T 细胞和趋化因子分泌导致机体免疫功能下降;此外,肌层巨噬细胞会对肠腔细菌感染会做出一定调节,并与肠神经元相互作用调节胃肠运动[16]。当巨噬细胞被激活,会大量释放中性粒细胞,导致肌层收缩减少和肠道传输延迟;而且为应对手术创伤应激反应,中性粒细胞会释放超氧阴离子,导致胃黏膜损伤[17]。淋巴细胞作为非特异性和适应性免疫反应的重要组成部分,大量富集在胃屏障表面,作为抵御潜在入侵微生物的第一道防线,并建立宿主-微生物相互平衡作用,若平衡失调则会损害胃肠道蠕动功能[18]。CRP 是与炎症反应、感染和组织坏死相关的血浆蛋白之一,由肝脏产生,并由细胞因子白细胞介素-6、肿瘤坏死因子-α 及白细胞介素-1 刺激产生。这些细胞因子在POI 的发生机制中起着重要促进作用[19-21]。其中,中性粒细胞也可以通过激活促IL-1 来加重机体炎症反应[22]。血清白蛋白反应机体营养状况,由于食欲降低、肝功能减弱和胃肠道出血,常在胃癌患者中观察到低白蛋白血症。此外,术前白蛋白水平低常与较高术后并发症发生率相关[23],也导致细胞外液充满组织间隙,引起胃壁水肿[24]。重要的是,以术前NLR 及CAR 升高为特征的癌症相关炎症患者可能会对手术创伤及胃肠道操作诱导的免疫产生异常反应,可能导致免疫系统受损,这些患者PPOI 风险显著升高[25]。因此,本研究结果强调NLR 和CAR在识别胃癌PPOI 发生风险上具有重要临床价值。本研究中也发现年龄> 65 岁、ASA 分级Ⅲ、Ⅳ级、TNM 分期Ⅲ、Ⅳ期及开放式手术与胃癌PPOI 发生相关。这与HUANG 等[26]及LIANG 等[27]报道一致。老年及ASA 分级越高患者通常肠道蠕动功能减弱,术后恢复需要更多时间。肿瘤晚期患者全身炎症反应较重且对手术诱导的炎症反应敏感性增强,同时伴随手术难度高、时间长,PPOI 发生风险升高。较小手术切口和温和的肠道操作与减少手术创伤、炎症和胃肠道功能障碍之间存在关联。
本研究构建一种新型炎症评分系统NLRNLRs,结果证实该评分与PPOI 发生风险显著相关。NLR-NLRs 的整合可以充分反映术前NLR 及CAR 升高为特征的癌症相关炎症患者机体炎症反应水平,从多种免疫反应途径,也包括营养状态来揭示患者免疫受损程度。近年来,Nomogram 因可以计算单个患者不良预后的发生风险,被广泛运用于临床[28]。这项研究基于NLR-NLRs 结合其他已被证实的危险指标,构建一种新型的预测胃癌PPOI 发生风险的Nomogram 模型。内部数据集验证结果显示:C-index 为0.892,AUC 为0.889 且能提供显著的临床净收益。这项研究最大优势采用外部数据集对Nomogram 模型进行验证,与内部数据集验证结果一致,C-index 为0.817,AUC 为0.806且能提供显著的临床净收益且收益程度均高于其他临床指标。一般来说,AUC <0.5 表示预测效能无意义,0.7~0.8 可接受,0.8~0.9 优秀,>0.9 极为突出。该结果强调Nomogram 模型在预测胃癌PPOI风险中具有较强能力。据知,这是首次以NLRNLRs 构建预测胃癌患者PPOI 的Nomogram 模型研究,用于风险评估、改善患者和医生之间沟通及临床决策具有重要意义。如果患者PPOI 风险估计值较高,医生和护士可以采取适当干预措施来提前进行预警和预防性治疗,包括术前饮食干预,尽可能采用腹腔镜手术,术后尽早进行鼻胃管减压等。这项研究主要发现术前机体炎症反应与PPOI 关系,因此试图降低机体炎症反应,则能达到降低PPOI 风险的效果。可以在术前给予高风险患者大建中汤[29]或者非甾体抗炎药[30]
本研究作为一项单中心研究,不可避免导致入组患者数量较少;PPOI 危险临床指标不可能局限于本研究所纳入的临床指标,未来将会继续深入研究,完善模型;Nomogram 模型普遍适用性尚未得到其他医疗机构的验证,进一步临床使用还需要多中心研究来支持。
综上所述,本研究发现NLR-CARs 与胃癌患者PPOI 的发生显著相关。 基于NLR-CARs 的Nomogram 模型可以作为一种重要预警策略,术前识别高危PPOI 患者,为医护人员采取适当干预措施提供理论依据。

