胃癌间充质干细胞促进胃癌细胞PD-L1表达的特征观察*
魏凌, 孙丽, 王倩倩, 朱伟
(1.江苏大学医学院, 江苏 镇江 212013; 2.江苏大学附属昆山医院 检验科,江苏 昆山 215300)
近年来,程序性死亡受体1(programmed death-1, PD-1)/程序性死亡配体1(programmed deathligand 1, PD-L1)是导致肿瘤免疫逃逸的重要免疫检查点之一。PD-L1 在多种肿瘤中表达,通过与活化T 细胞上的PD-1 结合导致T 细胞功能受损,从而抑制T 细胞的激活,还能与其他免疫抑制信号协同作用,促进免疫抑制微环境的形成[1]。有研究表明,阻断多发性骨髓瘤细胞PD-L1 的表达后,T 细胞对骨髓瘤细胞的细胞毒性明显增强[2]。在非小细胞肺癌中,PD-L1 可通过作用于巨噬细胞,诱导CD4+T细胞向Treg 细胞分化,促进肿瘤进展[3]。间充质干细胞作为肿瘤微环境中重要的基质细胞之一,具有自我更新及多向分化的潜能[4]。近年来研究发现,间充质干细胞通过细胞间相互作用和旁分泌功能在固有免疫和适应性免疫中发挥重要的免疫调节作用[5]。研究表明,胃癌来源的间充质干细胞(gastric cancer mesenchymal stem cell, GCMSC)通过分泌白细胞介素-8(Interleukin-8, IL-8),上调胃癌细胞PD-L1 的表达,促进肿瘤免疫逃逸和耐药[6-7]。然而,GCMSC 促进胃癌细胞PD-L1 表达的具体特征不明确。本研究观察GCMSC 对胃癌细胞PD-L1表达的促进作用,并探究胃癌细胞PD-L1 表达对GCMSC 的反应性和异质性,为进一步研究GCMSC调控肿瘤细胞PD-L1 的表达机制提供依据。
1 材料与方法
1.1 细胞株
1.1.1 GCMSC分离与胃癌细胞株的培养 GCMSC 的分离获得江苏大学伦理委员会的批准。将江苏大学附属昆山医院收治的胃癌患者手术取得的新鲜胃癌组织置于75%乙醇中30 s,冲洗表面的血液等杂质后转移至含有10 000 u/mL 链霉素和青霉素的磷酸盐缓冲液(phosphate buffer saline, PBS)中15 min备用。在超净台中将胃癌组织用无菌手术剪和镊子分成约1 mm×1 mm×1 mm 的小块,均匀铺于60 mm 细胞培养皿中,在37 ℃、5%二氧化碳细胞培养箱中培养15 min 后加入1 mL 含有10%胎牛血清(fetal bovine serum, FBS)的无菌α-MEM 营养液,继续培养10 d 左右,每隔3 天更换新鲜培养基。显微镜下观察胃癌组织附近细长梭形呈漩涡状分布的细胞即为GCMSC,待GCMSC 密度扩增至70%~80%时,将GCMSC 用0.25%胰蛋白酶消化离心后继续扩增6~10 代,选择状态较好的细胞用于实验。原代胃癌细胞来源于患者的胃癌组织,将患者的新鲜胃癌组织绞碎,在3 mg/mL Ⅳ型胶原酶(北京索莱宝科技有限公司,cas:9001-12-1)中分离,并在37 ℃下稀释,然后将组织悬液置于培养皿中,在含10% FBS 的RPMI 1640 培养基中培养。胃癌细胞株SGC-7901 和MGC-803[美国模式培养物集存库(American type culture collection, ATCC)]用含10 %FBS 的RPMI 1640 培养基于37 ℃、5%二氧化碳饱和湿度培养箱中培养。采用2.5 g/L 胰酶消化细胞,每3~5 d 传代。
1.1.2 制备GCMSC 条件培养基(GCMSC condition medium, GCMSC-CM) GCMSC 在100 mm 细胞培养皿中培养,当细胞融合度达70%左右时更换新鲜培养基。48 h 后收集细胞培养上清液,3 300 r/min离心5 min,采用33 mm、0.22 µm 一次性针头式滤器过滤上清液,置入-80 ℃冰箱冷冻保存备用。
1.2 方法
1.2.1 GCMSC 成脂成骨诱导 将 0.1 mL Supplement Mix Ⅰ和Supplement Mix Ⅱ 加入100 mL基础分化培养基中配制成完全分化培养基。取3~6 代GCMSC 接种于6 孔细胞培养板,用含有10%FBS 的α-MEM 置于37 ℃、5%二氧化碳的饱和湿度培养箱中培养。24 h 后观察细胞,待细胞融合度达到80%左右时更换 2 mL BI MSCgo™间充质干细胞成脂或成骨诱导分化培养基(南京福麦斯生物技术有限公司)继续培养12 d,每3 d 换液。油红O 及茜素红染色步骤参照Viva Cell Biosciences 试剂盒(上海龙田生物技术有限公司)说明书。根据试剂盒说明书步骤对诱导完成的细胞进行染色,观察细胞内脂滴及矿化结节形成大小和数量。
1.2.2 流式细胞仪检测表面标记及细胞分选PD-L1阴性和PD-L1 阳性胃癌细胞 取待测胃癌细胞株SGC-7901 按5×105个/孔接种于6 孔板中培养48 h。0.25%胰酶消化细胞,3 300 r/min 离心 5 min,PBS洗涤3 次,弃上清液,收集细胞团块保存于1.5 mL EP 管中,400 µL PBS 重悬,分别加入3 µL 相应流式抗体。4 ℃避光孵育30 min,3 300 r/min离心5 min后200 µL PBS 重悬。流式细胞仪检测表面标记表达,FlowJo 7.6 软件分析检测结果。采用流式细胞仪分选PD-L1 阴性和PD-L1 阳性胃癌细胞。
1.2.3 实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction, qRT-PCR)检测PDL1 mRNA 表达 在GCMSC-CM 中加入IL-8 和IL-6的中和抗体,浓度为5 µg/mL,室温孵育1 h 后作用于胃癌细胞株SGC-7901 和MGC-803,24 h 后收集细胞。将细胞分为4 组:以GCMSC-CM 未处理组为Control 组、GCMSC-CM 处理组、GCMSC-CM+anti-IL-8 组及GCMSC-CM+anti-IL-6 组。向各组收集好的细胞中加入1 mL TRIzol 裂解液,室温静置10 min 后用移液枪吹打细胞转移至1.5 mL EP 管。加入200 µL 氯仿,手动震荡30 s,4 ℃静置15 min直至分层。吸取300 µL 上清液,加入300 µL 异丙醇,4 ℃下静置2 h。4 ℃、11 441 r/min 离心15 min,弃上清液,加入DEPC 水配制的75%乙醇,4 ℃、9 342 r/min 离心10 min。弃上清液,自然晾干至沉淀呈半透明状,加入20 µL DEPC 水溶解沉淀,分光光度计检测RNA 纯度及浓度,置入-80 ℃冰箱冷冻保存备用。qRT-PCR 检测mRNA,严格按照试剂盒(康为世纪生物科技股份有限公司,CW2602M)说明书操作。将提取的RNA、Primer Mix、dNTP Mix、DTT、RT Buffer、HiFiScript 及无RNA 酶水置于冰上解冻备用,按比例配制20 µL 反应体系:dNTP Mix 4 µL,Primer Mix 2 µL, 5 × RT Buffer 4 µL,DTT 2 µL,Total RNA 1 µg,HiFiScript 1 µL,RNase free ddH2O 补足至20 µL。采用定量分析仪(ABI Quanstudio 3)进行逆转录,42 ℃反应15 min,85 ℃反应5 min,进行qRT-PCR,得出CT 值后采用2-ΔΔCt法计算目的基因mRNA 相对表达量。PDL1:正向引物5'-TCACTTGGTAATTCTGGGAGC-3',反向引物5'-CTTTGAGTTTGTATCTTGGATGCC-3',引物长度124 bp。内参基因GAPDH:正向引物5'-GGAGCGAGATCCCTCCAAAAT-3',反向引物5'-GG CTGTTGTCATACTTCTCATGG-3',引物长度197 bp。
1.2.4 Western blotting 检测PD-L1 蛋白表达 在GCMSC-CM 中加入IL-8 中和抗体及IgG,浓度为5.0 µg/mL,室温孵育1 h 后作用于胃癌细胞株SGC-7901,24 h 后收集细胞。Rapamycin 预处理胃癌细胞株SGC-7901,浓度为0.1 µmol/L,DMSO 量与Rapamycin 一致,1 h 后撤除并加入GCMSC-CM 继续培养24 h 后收集细胞。将细胞分为6 组:以GCMSC-CM 未处理组为Control 组、GCMSC-CM 处理组、GCMSC-CM+IgG 组、GCMSC-CM+anti-IL-8 组、GCMSC-CM+Reparixin 组及GCMSC-CM+DMSO 组。采用PIPA 裂解液提取收集好的细胞全蛋白,BCA蛋白测定试剂盒(CWBIO)定量检测PD-L1 蛋白表达。以150 µg 为蛋白上样量,向电泳槽中加入1 L电泳液,60 V 电泳2 h 后配制转膜液预冷,将蛋白分离胶转印至甲醇活化后的聚偏二氟乙烯(Polyvinylidenefluoride, PVDF)膜上(350 mA,2 h,4 ℃),50 g/L 脱脂奶粉室温封闭2~3 h,倒去封闭液,加入稀释后的一抗,4 ℃孵育过夜。次日将PVDF 膜置于TBST 缓冲液中,于室温轻轻摇动洗膜30 min,每10 min 更换TBST 缓冲液。倒去TBST,加入相应二抗,37 ℃孵育1 h,TBST 清洗30 min。滴加HRP 发光底物用全自动凝胶成像仪进行PVDF膜成像。内参蛋白是GAPDH(南京福麦斯生物技术有限公司)。
1.2.5 酶 联 免 疫 吸 附 试 验(enzyme-linked immunoadsordent assay, ELISA)检测血清游离PD-L1和IL-8水平 收集胃癌患者手术前血清样本,分装后-80 ℃冷冻保存,采用ELISA 检测血清游离PDL1(sPD-L1)和IL-8 的水平,具体步骤参照ELISA试剂盒(南京福麦斯生物技术有限公司)说明书。
1.3 统计学方法
数据分析采用SPSS 16.0 统计软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析的Newman-Keuls 检验,两两比较用非配对t检验;相关性分析用Pearson 法。P<0.05 为差异有统计学意义。
2 结果
2.1 GCMSC鉴定结果
体外成脂成骨诱导实验显示,GCMSC 可诱导分化为骨细胞和脂肪细胞(见图1A)。免疫表型分析显示,GCMSC 中CD45、CD34、CD19 呈低表达,CD105、CD90 和CD29 呈高表达(见图1B)。
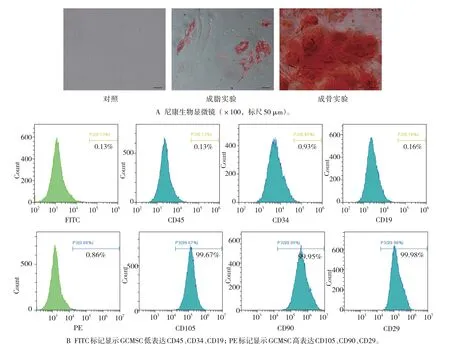
图1 GCMSC鉴定
2.2 GCMSC-CM 促进胃癌细胞株PD-L1表达的持续性
GCMSC-CM 处理SGC-7901 细胞24、48 和72 h后,PD-L1 mRNA 相对表达量分别为(5.07±0.45)、(5.09±0.53)、(4.93±0.20),去除GCMSC-CM 24、48 h 后,PD-L1 mRNA 相对表达量分别为(2.26±0.18)、(1.84±0.14),未处理为(1.01±0.16)。6 个不同时间的PD-L1 mRNA 相对表达量比较,差异有统计学意义(F=69.670,P=0.000)。GCMSC-CM 处理SGC-7901 细胞24、48、72 h 后,SGC-7901 细胞的PD-L1 mRNA 相对表达量较未处理时均上调;去除GCMSC-CM 后48 h,SGC-7901 细胞的PD-L1 mRNA相对表达量逐渐恢复(见图2A)。
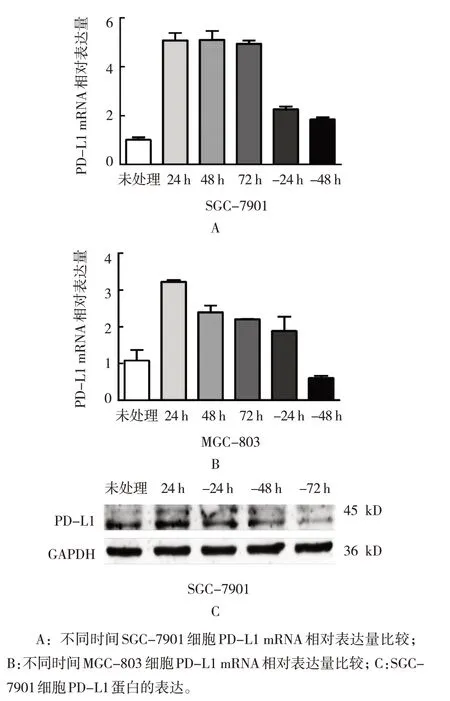
图2 不同时间胃癌细胞株PD-L1 mRNA和蛋白表达的比较
GCMSC-CM 处理MGC-803 细胞24、48 和72 h后,PD-L1 mRNA 相对表达量分别为(3.22±0.05)、(2.39±0.27)、(2.20±0.01),去除GCMSC-CM 24、48 h 后,PD-L1 mRNA 相对表达量分别为(1.88±0.56)、(0.60±0.10),未处理为(1.08±0.42)。6 个不同时间的PD-L1 mRNA 相对表达量比较,差异有统计学意义(F=13.310,P=0.000)。GCMSC-CM 处理MGC-803 细胞24、48 和72 h 后,MGC-803 细胞的PD-L1 mRNA 相对表达量较未处理时均上调;去除GCMSC-CM 48 h 后,MGC-803 细胞的PD-L1 mRNA相对表达量逐渐恢复(见图2B)。
Western blotting 结果也显示,GCMSC-CM 处理SGC-7901 细胞24 h 后PD-L1 蛋白表达增加,PD-L1蛋白相对表达量为(1.07±0.12),去除GCMSC-CM后72 h 内PD-L1 的表达逐渐恢复,去除GCMSCCM 24、48、72 h 后,PD-L1 蛋白相对表达量分别为(0.9±0.05)、(0.72±0.03)、(0.52±0.11),未处理为(0.78±0.06)(见图2C)。
2.3 GCMSC通过分泌IL-6和IL-8上调胃癌细胞株中PD-L1的表达
IL-8 或IL-6 中和抗体作用GCMSC-CM 后处理SGC-7901 和MGC-803 细胞24 h,采用qRT-PCR 检测PD-L1 mRNA 表达。结果表明,GCMSC-CM 处理后,SGC-7901 细胞PD-L1 mRNA 相对表达量为(3.87±0.29),使用IL-8 或IL-6 中和抗体作用GCMSC-CM 处理组分别为(2.42±0.33)、(3.09±0.26),未处理为(1.01±0.12)。不同处理组SGC-7901 细胞PD-L1 mRNA 相对表达量比较,差异有统计学意义(F=42.300,P=0.000)(见图3A)。
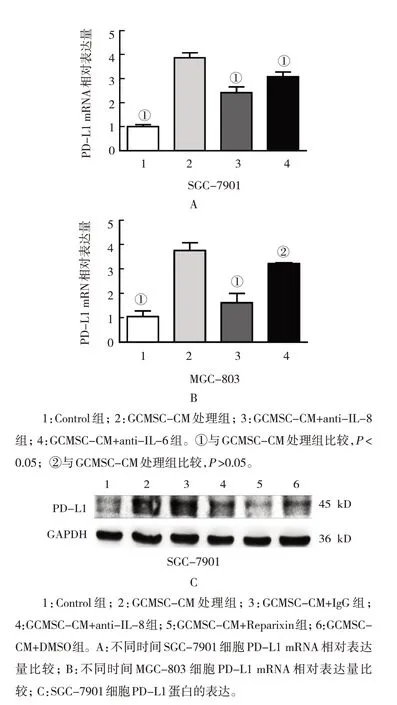
图3 GCMSC-CM促进胃癌细胞PD-L1表达
MGC-803 细胞在接受GCMSC-CM 后处理后,PD-L1 mRNA 相对表达量为(3.76±0.32),使用IL-8 或IL-6 中和抗体作用GCMSC-CM 处理组分别为(1.62±0.53)、(3.22±0.05),未处理为(1.05±0.33)。不同处理组MGC-803 细胞PD-L1 mRNA 相对表达量比较,差异有统计学意义(F=17.410,P=0.000)(见图3B)。
Western blotting 结果也显示,当加入Reparixin时,GCMSC-CM 对GC 细胞PD-L1 的促进作用显著降低。GCMSC-CM 未处理组PD-L1 蛋白相对表达量为(0.52±0.06),GCMSC-CM 处理后,SGC-7901 细胞PD-L1 蛋白相对表达量为(0.94±0.08),GCMSCCM+IgG 组和使用IL-8 中和抗体作用GCMSC-CM 处理组分别为(0.87±0.07)和(0.70±0.11),GCMSCCM+Reparixin 组和GCMSC-CM+DMSO 组PD-L1 蛋白相对表达量分别为(0.4±0.05)和(0.7±0.09)(见图3C)。
2.4 GC患者sPD-L1与IL-8的相关性
35 例GC 患者血清sPD-L1 水平为(38.78±1.96),IL-8 水平为(32.76±9.71)(见图4)。GC 患者血清IL-8 与sPD-L1 水平呈正相关(r=0.347,P=0.041)。见图5。
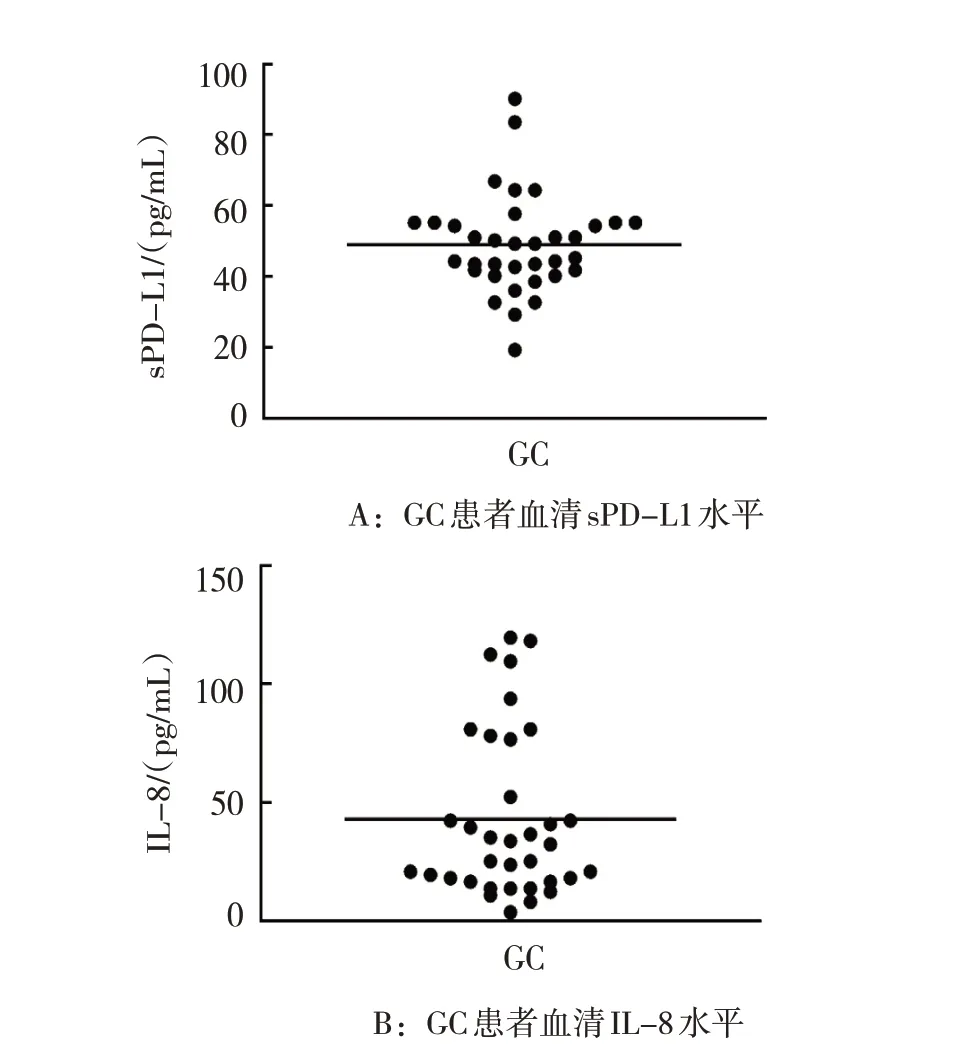
图4 GC患者血清IL-8和sPD-L1的水平
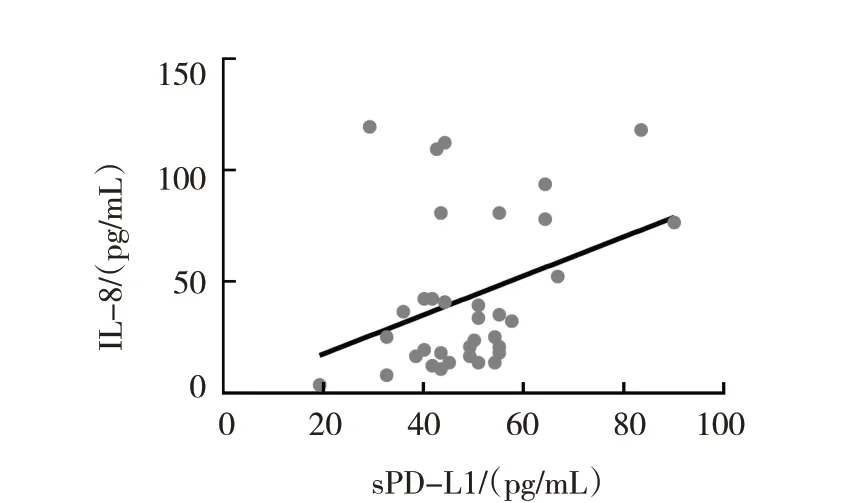
图5 GC患者IL-8和sPD-L1的相关性
2.5 GCMSC-CM促进PD-L1表达存在GC异质性
GCMSC-CM 处理SGC-7901 24 h 后,流式细胞术分离PD-L1 阴性和PD-L1 阳性细胞,再次用GCMSC-CM 处理分选细胞,检测PD-L1 的表达。流式细胞术结果显示,再次用GCMSC-CM 处理后,PD-L1 阳性细胞组PD-L1 表达水平升高(P<0.05),而PD-L1 阴性细胞组PD-L1 表达并未升高(P>0.05)(见图6A)。GCMSC-CM 处理GC 组织中分离出的原代GC 细胞,结果显示,原代GC 细胞PD-L1水平也升高。将GCMSC-CM 组的PD-L1 阳性和PDL1 阴性细胞进行分选(见图6B),用含10% FBS 的RPMI 1640 培养24 h,结果显示,撤除GCMSC-CM后,PD-L1 阳性的原代GC 细胞中PD-L1 的表达降低(见图6C)。

图6 GC 细胞中PD-L1表达存在对GCMSC-CM 反应异质性
3 讨论
肿瘤微环境中,免疫细胞和细胞因子在调控肿瘤生长及转移中发挥了重要作用。PD-L1 作为一个免疫抑制分子能够被肿瘤细胞等多种细胞调控。近年来,免疫检查点抑制剂(ICIs)疗法,尤其是抗PD-1/PD-L1 疗法,已成为除化疗和放疗外应用最普遍的胃癌治疗手段之一。但PD-L1 在肿瘤微环境中具体受到哪些细胞影响尚未阐明[8-15]。
间充质干细胞是一群多能干细胞,拥有自我更新及多向分化的能力,具有免疫调节功能,最初是骨髓中分离获得,目前已经可以从多种组织中获取,如脐带、皮肤、肌肉、牙髓和脂肪组织等[16-18]。早期实验研究证明骨髓间充质干细胞通过旁分泌可溶性细胞因子或Exosomes 促进肿瘤体内生长及血管形成[19-20]。骨髓间充质干细胞对肿瘤具有趋向性,在多种趋化因子的作用下到达肿瘤微环境并被驯化为肿瘤相关间充质干细胞[21]。多发性骨髓瘤患者来源的骨髓间充质干细胞可通过PD-1/PD-L1 轴诱导CD8+T 细胞死亡,抑制CD8+T 细胞穿孔素和颗粒酶B 的释放并促进骨髓瘤细胞免疫逃逸[22]。本团队在临床胃癌组织中分离培养出较骨髓间充质干细胞具有更强促瘤潜能的GCMSC[23]。实验结果表明,胃癌微环境中T 细胞、GCMSC 及肿瘤细胞相互作用共同调节PD-L1 表达,进一步促进胃癌细胞抵抗CTL 的细胞毒性作用并发生免疫逃逸[24-26]。
本研究从胃癌患者组织中分离培养出GCMSC并收集GCMSC 上清液。胃癌细胞与GCMSC-CM 共培养24、48 和72 h 后,PD-L1 表达均明显升高,然而当撤除GCMSC-CM 后,胃癌细胞的PD-L1 表达均无法保持在一个较高水平,表明胃癌细胞PD-L1 表达的升高依赖于GCMSC-CM 的持续作用。为了进一步验证GCMSC 对胃癌细胞PD-L1 的作用,本研究使用IL-6 和IL-8 的中和抗体抑制了胃癌细胞中IL-6和IL-8 的表达,当使用IL-6 或IL-8 中和抗体阻断GCMSC-CM IL-6 或IL-8 与其受体结合时,GCMSCCM 促进PD-L1 表达作用被逆转,尤其是阻断IL-8后效果更明显,表明IL-8 通过与CXCR1/2 相互作用激活偶联G 蛋白,进而激活信号分子调控基因表达。Reparixin 是CXCR1/2 激活的非竞争性变构抑制剂。Western blotting 检测结果也显示,当加入Reparixin时,GCMSC-CM 对GC 细胞PD-L1 的促进作用明显减弱。同时,ELISA 结果显示胃癌患者血清IL-8 和PD-L1 的表达呈正相关,进一步证明GCMSC 通过IL-6 和IL-8 促进PD-L1 的表达。为进一步探讨GCMSC 上调胃癌细胞PD-L1 表达是否存在异质性,本研究用流式细胞术将GCMSC-CM 处理后的胃癌细胞分为PD-L1 阴性和PD-L1 阳性细胞群,结果显示,PD-L1 阳性细胞群被GCMSC-CM 再次作用后,PD-L1 水平持续升高而PD-L1 阴性细胞群没有明显变化。这些结果表明GCMSC 对胃癌细胞PD-L1 的上调作用的异质性,不同细胞对GCMSC-CM 处理的反应不同,其具体机制还需进一步探索。WEI 等[27]分析9 769 例肿瘤患者的临床资料,其中包含32 种不同类型的肿瘤,发现不同免疫微环境下PD-L1 阳性肿瘤细胞存在异质性。巨噬细胞通过激活NFκB 信号上调肿瘤细胞PD-L1 表达,进而促进肿瘤细胞恶性增殖、血管形成及肿瘤转移,并抵抗传统化疗药物、CTL 的细胞毒性作用及抗PD-1/PD-L1 抗体治疗;而活化的T 细胞激活STAT1 信号形成的PDL1 阳性肿瘤细胞则敏感且易发生凋亡。此现象揭示了肿瘤内部微环境的复杂性,深入了解肿瘤微环境,阐明肿瘤细胞PD-L1 表达的调控机制对提高免疫治疗效率非常关键。
综上所述,GCMSC-CM 通过IL-6 和IL-8 上调胃癌细胞中PD-L1 的表达并且这种上调作用依赖于GCMSC-CM 的持续作用。此外,GCMSC-CM 对胃癌细胞的作用取决于胃癌细胞本身PD-L1 的表达。本研究仅阐述了GCMSC-CM 影响胃癌细胞PD-L1 的异质性,后续将深入探索其具体机制,为GCMSC 治疗胃癌提供新的思路。

