溶血磷脂酰胆碱酰基转移酶1在宫颈癌中的表达及临床意义
陈韩,杨江怡,陈华,韩锋
宫颈癌是女性生殖系统最常见的恶性肿瘤之一。GLOBOCAN2020全球癌症统计数据报告显示,2020年全球约60.4万宫颈癌新发病例和34.2万死亡病例[1-2]。2020年我国宫颈癌新发病例约11万例,死亡病例约6万例[3]。目前宫颈癌较为理想的治疗模式是手术切除配合术后同步放疗、化疗,但是宫颈癌早期症状不明显,确诊时通常已处于中晚期,贻误了最佳的手术治疗时机,且患者预后往往较差[4-5]。溶血磷脂酰胆碱酰基转移酶1(lysophosphatidylcholine acyltransferase 1,LPCAT1)是一种重要的磷脂酰基代谢酶,主要功能为介导磷脂代谢过程Land’s循环中溶血磷脂酰胆碱的再乙酰化,生成饱和磷脂酰胆碱(PC)[6]。胆碱代谢产物的变化是细胞癌变的一个重要特征,而PC是肿瘤细胞较正常细胞改变最为明显的磷脂。可见,磷脂酰胆碱的代谢异常与肿瘤的发生发展密切相关[7-8]。LPCAT1作为合成磷脂酰胆碱的关键酶在多种恶性肿瘤中表达显著上升,如肺癌、子宫内膜癌、前列腺癌、乳腺癌、肝癌等[9-13]。然而,关于LPCAT1蛋白在宫颈癌中的表达情况及其与患者预后的关系相关报道较少。因此,现分析不同LPCAT1蛋白表达的宫颈癌患者临床病理特征和预后的差异,以期为宫颈癌的早期诊断和临床治疗提供新思路,报道如下。
1 资料与方法
1.1 临床资料 选取2012年1月1日—2022年12月31日海南医学院第一附属医院妇科手术治疗宫颈癌患者163例作为观察组,年龄(50.37 ± 12.88)岁;肿瘤直径≤4 cm者71例,>4 cm者92例;参考国际妇产科联盟(FIGO)分期标准[14]:Ⅰ~Ⅱ期110例,Ⅲ~Ⅳ期53例;主要的组织病理类型为鳞癌133例(81.6%);子宫肌层浸润深度>1/2肌层72例(44.2%);发生盆腔淋巴结转移77例(47.2%);组织分化程度为低分化88例,中高分化75例;HPV感染阳性率为74.8%(122/163)。另选取同期因患子宫平滑肌瘤施行全子宫切除术患者77例作为对照组,年龄(52.93±13.56)岁。2组患者年龄比较差异无统计学意义(t=1.413,P=0.159)。本研究已经获得医院伦理委员会批准(HYFY20230258),患者及家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①无生育需求,主要术式为广泛子宫切除加盆腔淋巴结清扫术;②手术切除标本经病理组织活检证实为宫颈癌[15];③术前未接受放疗、化疗和靶向治疗等抗肿瘤治疗。(2)排除标准:①合并其他恶性肿瘤;②合并心、肺、肝、肾等严重影响患者生存的疾病;③临床资料不完整、随访不依从。
1.3 观测指标与方法
1.3.1 免疫组化法检测LPCAT1蛋白表达:收集观察组患者手术切除宫颈癌组织以及对照组患者手术切除正常宫颈组织,经10%福尔马林溶液固定、常规石蜡包埋,4 μm厚连续切片。二甲苯脱蜡、乙醇梯度水化后采用免疫组化SP法对切片进行染色。3%过氧化氢溶液浸泡后在柠檬酸溶液中修复抗原,PBS缓冲液漂洗后加入10%山羊血清室温下封闭20 min。将1∶200稀释的LPCAT4一抗(购自英国Abcam公司)滴加至切片上,4℃孵育过夜。次日PBS冲洗后将二抗(购自北京中杉金桥生物技术有限公司)滴加至切片上室温孵育30 min。PBS清洗后DAB显色、苏木精复染。常规乙醇梯度脱水后二甲苯固定、中性树脂封片,显微镜(型号CX23BGUV,购自日本Olympus公司)下观察并摄片。
1.3.2 随访:依据《宫颈癌诊疗规范》[15]推荐的随访方法,采用门诊复查或电话随访,第1年和第2年每3个月随访1次,以后每6个月随访1次,随访截至2023年5月31日。总生存期(overall survival,OS)是指患者接受手术治疗当日至任何原因死亡或失访的时间[16]。
1.4 结果判定 参照二级计分法对免疫组化结果进行判定,即总评分=阳性细胞百分比×细胞染色强度。以细胞膜和/或细胞质呈现棕黄色或棕褐色判定为LPCAT1蛋白表达阳性。阳性细胞百分比≤5%计0分,6%~25%计1分,26%~50%计2分,51%~75%计3分,>75%计4分;细胞染色强度呈无色、浅黄色、棕黄色、棕褐色分别计0、1、2、3分。上述两者乘积0分为阴性,1~4分为弱阳性,5~8分为阳性,9~12分为强阳性,其中阴性和弱阳性认定为LPCAT1蛋白低表达,阳性和强阳性认定为高表达[17]。

2 结 果
2.1 宫颈癌组织和正常宫颈组织中LPCAT1蛋白表达比较 宫颈癌组织和正常宫颈组织中LPCAT1蛋白表达见图1;宫颈癌组织中LPCAT1蛋白高表达率为50.9%(83/163),高于正常宫颈组织中的21.3%(16/75)(χ2=18.509,P<0.001)。
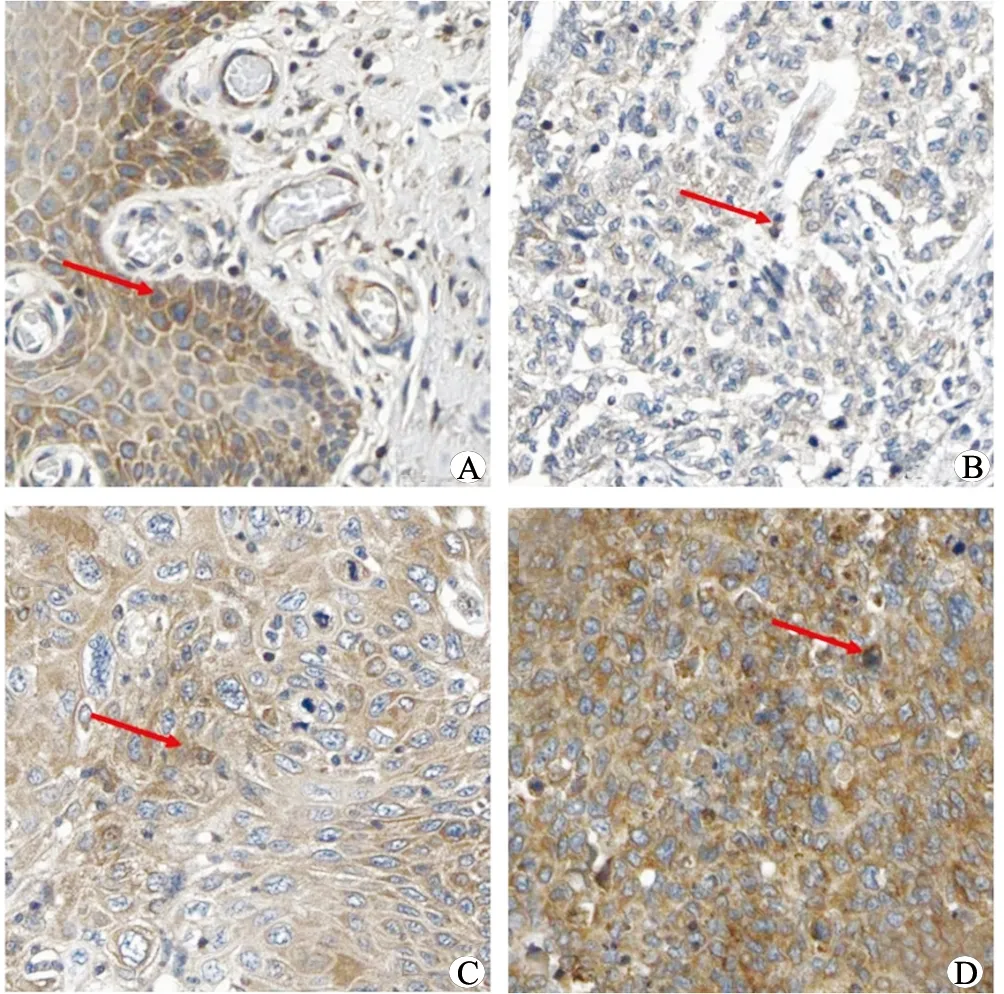
注:A.正常宫颈组织中LPCAT1蛋白阳性表达;B.宫颈癌组织中LPCAT1蛋白弱阳性表达;C.宫颈癌组织中LPCAT1蛋白阳性表达;D.宫颈癌组织中LPCAT1蛋白强阳性表达。
2.2 LPCAT1表达水平在宫颈癌患者不同临床病理特征中差异比较 FIGO分期Ⅲ~Ⅳ期、浸润深度>1/2肌层、淋巴结转移、中高分化宫颈癌患者LPCAT1蛋白高表达率高于FIGO分期Ⅰ~Ⅱ期、≤1/2肌层、无淋巴结转移、低分化者(P<0.05),而在不同年龄、肿瘤直径、组织病理类型和HPV感染中比较差异无统计学意义(P>0.05),见表1。

表1 LPCAT1表达水平在宫颈癌患者不同临床病理特征中差异比较 [例(%)]
2.3 LPCAT1蛋白表达与宫颈癌患者术后预后的关系 163例宫颈癌患者中位生存时间为67.73个月,1、3和5年总生存率分别为87.4%、60.5%和49.1%。
83例LPCAT1蛋白高表达者中位生存时间为36.10个月,低于80例低表达者中位生存时间95.30个月(χ2=4.791,P=0.029),见图2。

图2 LPCAT1蛋白表达与宫颈癌患者术后预后的关系
2.4 宫颈癌患者术后预后影响因素Cox回归分析 以宫颈癌患者术后生存为因变量,以上述结果中P<0.05项目为自变量进行多因素Cox回归分析,结果显示FIGO分期Ⅲ~Ⅳ期、肿瘤浸润深度>1/2肌层、淋巴结转移、中高分化和LPCAT1蛋白高表达均为宫颈癌患者术后预后不良的独立危险因素(P<0.05),见表2。

表2 宫颈癌患者术后预后影响因素Cox回归分析
3 讨 论
LPCAT1属于1-酰基甘油-3-磷酸酰基转移酶(1-acylglycerol-3-phosphate acyltransferases,AGPATs)家族,是一种具有4个保守结构域的Ⅱ型跨膜蛋白,定位于细胞的脂滴、内质网和高尔基体内[18]。LPCAT1通过将脂肪酰基链结合到磷脂酰胆碱中来催化溶血磷脂酰胆碱转化为磷脂酰胆碱,这种磷脂代谢反应一方面可为肿瘤细胞增殖提供更多的生物来源,另一方面可调节细胞内磷脂组分和脂滴含量,影响细胞膜性结构及信号通路传导[6,19]。多项研究表明LPCAT1催化的溶血磷脂酰胆碱向磷脂酰胆碱的转化是肿瘤进展的原因[10,20]。
LPCAT1表达上调可促进肿瘤细胞增殖、侵袭和迁移,而其表达下调可诱导细胞周期阻滞于G0/G1期从而抑制肿瘤细胞生长[9]。本研究发现宫颈癌组织中LPCAT1蛋白高表达率显著高于正常宫颈组织。前期细胞实验证实敲低LPCAT1可显著抑制宫颈癌细胞的增殖、迁移和侵袭,同时显著诱导细胞凋亡。LPCAT1沉默可显著降低宫颈癌细胞中白介素-6(IL-6)、p-Janus激酶2(JAK2)和磷酸化信号转导和转录激活因子3(p-STAT3)的表达水平[21]。类似地,在具有LPCAT1缺失的宫颈癌细胞中,IL-6/STAT3靶基因的表达水平也被显著下调[19]。添加重组IL-6后可消除由敲低LPCAT1引起的功能变化,抑制宫颈癌细胞的增殖和上皮间质转化过程[21]。此外,动物实验结果证实LPCAT1缺失可有效降低异种移植小鼠模型的肿瘤生长速率和体内肺转移[22]。Tao等[23]发现LPCAT1通过介导SREBP-1/EGFR/PI3K信号通路调节细胞内的胆固醇代谢,进而促进食管癌细胞的迁移和侵袭。
本研究发现,LPCAT1蛋白高表达的宫颈癌患者总生存率显著低于低表达者,与前期研究发现类似,例如刘小小等[24]发现LPCAT1 mRNA低表达的非小细胞肺癌患者总生存率明显高于高表达者;He等[13]检测了3 715例肝癌组织和3 105例非肝癌组织发现,肝癌组织标本中LPCAT1蛋白表达水平显著增加,且LPCAT1高表达与总生存状况恶化相关,是肝癌预后不良的危险因素(HR=2.21)。
综上所述,LPCAT1蛋白在宫颈癌组织中呈现高表达水平,其表达水平上升与FIGO分期Ⅲ~Ⅳ期、肿瘤浸润深度>1/2肌层、淋巴结转移、中高分化程度呈正相关,同时亦是宫颈癌患者术后预后不良的独立危险因素,提示LPCAT1蛋白可能是宫颈癌早期诊断的潜在生物标志物和治疗靶标。
利益冲突:所有作者声明无利益冲突
作者贡献声明
陈韩:设计研究方案,实施研究过程,论文撰写;杨江怡:实施研究过程,资料搜集整理,论文修改;陈华:提出研究思路,分析试验数据,论文审核;韩锋:论文审核,论文修改,论文终审

