益母草碱调节Akt/MDM2/p53信号通路对脑胶质瘤细胞恶性生物学行为的影响
黄超,方兴刚,陈璐,陈汉玉,陈曾凤
脑胶质瘤是常见的颅内恶性肿瘤,约占全部颅内肿瘤的50%,在儿童恶性肿瘤中排第二位,临床疗效差,积极开发改进其治疗技术有重要临床价值[1-2]。蛋白激酶B(protein kinase B,Akt)/双微体同源基因2(mouse double minute 2,MDM2)/p53通路与癌症的发生、恶性进展关系密切,使该信号失活可抑制肝癌、口腔鳞状细胞癌细胞的恶性进展[3-4],还可抑制神经胶质瘤细胞的增殖、体内生长和运动,延缓神经胶质瘤的发生及恶性进展[5-6];由此可知Akt/MDM2/p53是脑胶质瘤的重要治疗靶点。益母草碱是自中药益母草中分离出的一种抗肿瘤化合物,在前列腺癌、急性髓细胞白血病中均发挥抗癌活性,且抑制Akt信号激活是益母草碱发挥抗癌活性的机制之一[7-8]。因而预测益母草碱可能通过调节Akt/MDM2/p53信号通路而介导脑胶质瘤细胞的恶性生物学行为。本研究通过体外培养小鼠脑胶质瘤细胞GL261并构建其颅内胶质瘤小鼠模型,对此预测进行验证分析,报道如下。
1 材料与方法
1.1 材料 (1)实验动物:雄性C57BL/6小鼠(SPF级,7~8周龄,体质量19~22 g)购自武汉有度生物科技有限公司,生产许可证号SCXK(鄂)2015-0025,动物饲养及实验操作符合《实验动物管理条例》;GL261小鼠胶质瘤细胞购自上海雅吉生物科技有限公司。(2)试药、试剂:SC79(Akt激活剂,批号20220806)购自上海碧云天生物公司;益母草碱(批号111823-201704)购自安徽新星药物开发有限责任公司;兔抗小鼠p-Akt、Akt、p-MDM2、MDM2、p53、Ki67及甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗、辣根过氧化物酶标记(horseradish peroxidase,HRP)驴抗兔二抗、膜联蛋白V(Annexin V)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)细胞凋亡检测试剂盒、结晶紫染色液、免疫组织化学试剂盒、TUNEL细胞凋亡检测试剂盒购自北京百奥莱博科技有限公司;CCK-8细胞活力检测试剂盒购自赫澎(上海)生物科技有限公司。(3)仪器、设备:JMB-SA全波长酶标仪购自上海精若科学仪器有限公司;FACS Calibur全自动流式细胞仪购自上海佐明机械设备贸易有限公司;PH-3DMC倒置生物显微镜购自微特视界科技(深圳)有限公司;HS-4080全自动冰冻切片机购自山东欧莱博医疗器械有限公司;PowerPac HV电泳与转印设备电源、Trans-Blot®小型蛋白转印槽、Mini-PROTEAN Tetra小型蛋白垂直电泳槽购自美国伯乐公司。
1.2 细胞实验方法 2022年3—9月于湖北省十堰市太和医院实验室进行实验。
1.2.1 筛选益母草碱对GL261细胞的最佳药物作用浓度:解冻复苏购买的冻存小鼠脑胶质瘤细胞GL261,以DMEM培养基(含10%胎牛血清+1%双抗)培养,传代后接种在96孔板培养(1×104个/孔),细胞进入对数生长期后分别以0、0.4、0.8、1.2、1.6、2.0 mmol/L浓度益母草碱处理24 h[9],以0 mmol/L益母草碱处理细胞做对照组,同时以不接种细胞的培养孔做空白对照组,每孔细胞加入CCK-8试剂20 μl孵育1.5 h后,按CCK-8细胞活力检测试剂盒说明书指导测定各组细胞吸光度,按下式算出各组细胞存活率:存活率=(益母草碱处理组吸光度-空白对照组吸光度)/(0 mmol/L益母草碱处理组吸光度-空白对照组吸光度)×100%。
1.2.2 分组处理细胞并采集标本:GL261细胞传代后接种在12孔板(2.5×105个/孔),随机分为对照组、益母草碱组、益母草碱+SC79组,细胞进入对数生长期后分组进行处理:益母草碱组细胞以终浓度益母草碱1.6 mmol/L处理,益母草碱+SC79组细胞以终浓度1.6 mmol/L益母草碱和终浓度5.0 μmol/L的SC79联合处理[10],对照组细胞不做处理,24 h后收集各组细胞备用。
1.2.3 蛋白免疫印记法检测各组GL261细胞Akt/MDM2/p53通路相关蛋白表达情况:以RIPA裂解液分别提取1.2.2中收集的各组GL261细胞总蛋白,测出其浓度后沸水浴内加热变性,每组取出25 μg行电泳实验后电转,将其按分子量大小分离后移到硝酸纤维素膜上,封闭其非特异抗原后分别孵育兔抗小鼠p-Akt(1∶1 000)、Akt(1∶1 000)、p-MDM2(1∶1 000)、MDM2(1∶1 000)、p53(1∶2 000)、GAPDH(1∶2 000)一抗,洗膜后孵育HRP标记驴抗兔二抗(1∶2 000)进行抗原抗体反应,洗膜后以化学发光法显影,采集各组蛋白条带图像后以Image J软件定量其灰度值,按下式算出其相对表达:待测蛋白相对表达=待测蛋白灰度值/内参GAPDH蛋白灰度值。
1.2.4 CCK-8法检测各组GL261细胞增殖、凋亡、迁移和侵袭情况:GL261细胞传代接种在96孔板并按照1.2.2中方法分组处理24 h,采用CCK-8法检测各组细胞存活率,具体方法见1.2.1。
1.2.4.1 流式细胞术检测各组GL261细胞凋亡 GL261细胞传代接种在12孔板并按照1.2.2中方法分组处理24 h,收集各组细胞以磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤后计数,每组取5×105个细胞用Annexin V-FITC细胞凋亡检测试剂盒按其说明指导行FITC及PI双染,洗涤后置于流式细胞仪内检测各组细胞凋亡率。
1.2.4.2 细胞划痕实验检测各组GL261细胞迁移 GL261细胞传代接种在12孔板并按照1.2.2中方法分组处理24 h,收集各组细胞PBS洗涤、计数后每组取5×106个细胞接种在24孔板培养10 h,于每孔中央划一条直线后除去划痕内细胞,以倒置生物显微镜拍照后以Image J软件定量各组细胞划痕面积S0h,继续培养24 h后再次拍照后定量各组划痕面积S24h,按下式计算各组细胞迁移率:迁移率(%)=(S0h-S24h)/S0h×100%。
1.2.4.3 Transwell实验检测各组GL261细胞侵袭:GL261细胞传代接种在12孔板并按照1.2.2中方法分组处理24 h,收集各组细胞PBS洗涤、以不含胎牛血清的DMEM培养基重悬计数后,每组取5×106个细胞接种在以基质胶包被的24孔Transwell板上室并同时于下室中加入DMEM培养基(含10%胎牛血清+1%双抗),培养24 h后取下室细胞洗涤、固定、行结晶紫染色、洗涤,以倒置生物显微镜拍照后以Image J软件定量各组侵袭到下室的细胞数量,即为各组细胞侵袭数。
1.3 动物实验方法
1.3.1 构建颅内胶质瘤小鼠模型并筛选其益母草碱最佳作用剂量:参考文献[11]构建颅内胶质瘤小鼠模型,取对数生长期的GL261细胞,计数后制成密度为2×105/μl的单细胞悬液,以4%戊巴比妥钠(0.01 ml/g)腹腔注射麻醉小鼠后俯卧固定在脑立体定位仪上,头顶去毛备皮后分离暴露颅骨,定位矢状缝右2 mm、前囟前1 mm处开骨窗,于小鼠右侧脑尾状核区接种上述细胞悬液5 μl,进针深至硬脑膜下3 mm,缓慢注射后留针3 min,然后缓慢拔针并缝合伤口,消毒后继续饲养,共造模33只,死亡3只,成功30只,随机数字表法分为对照组、益母草碱低剂量组、益母草碱中剂量组、益母草碱高剂量组、益母草碱高剂量+SC79组,每组6只,益母草碱低剂量组、益母草碱中剂量组、益母草碱高剂量组小鼠分别以90、180、360 ng/g益母草碱(于造模后1 d开始处理,以生理盐水溶解制为9、18、36 ng/μl的药液,灌胃10 μl/g,1次/d)灌胃[12-13];同时腹腔注射生理盐水10 μl/g(于造模后2周开始处理,1次/d);益母草碱高剂量+SC79组小鼠以益母草碱360 ng/g(于造模后1 d开始处理,以生理盐水溶解制为36 ng/μl药液,灌胃10 μl/g,1次/d)灌胃,同时腹腔注射SC79 40 μg/g(于造模后2周开始处理,以生理盐水溶解制为4 μg/μl的药液,注射10 μl/g,1次/d)[14],至造模后3周给药结束。
1.3.2 小鼠颅内胶质瘤细胞增殖:给药结束24 h后颈椎脱臼处死各组小鼠,剪下头颅并解剖取出大脑内胶质瘤组织,OCT包埋后速冻成块,全自动冰冻切片机切片,复温后置于预冷丙酮内固定,以3%过氧化氢酶、兔源抗小鼠Ki67一抗依次孵育后,采用免疫组织化学试剂盒按其说明指导行免疫组化染色,封片后以倒置生物显微镜采集任意6个视野图片,采用Image J软件定量各组Ki67阳性细胞数和总细胞数后按下式计算其Ki67阳性率:Ki67阳性率=Ki67阳性细胞数/总细胞数×100%。
1.3.3 小鼠颅内胶质瘤细胞凋亡情况检测:按1.3.1中方法构建颅内胶质瘤小鼠模型18只,随机数字表法分为对照组、益母草碱组、益母草碱+SC79组,每组6只,以360 ng/g益母草碱和40 μg/g的SC79分组处理,具体给药方式见1.3.3,给药结束24 h后颈椎脱臼处死各组小鼠,取脑内胶质瘤组织0.4 g置液氮内备用,剩余胶质瘤组织按1.3.3中方法做冰冻切片、复温、固定,用TUNEL细胞凋亡检测试剂盒按其说明指导行TUNEL染色,封片后以倒置生物显微镜采集任意6个视野图片,采用Image J软件定量各组凋亡细胞数和总细胞数后按下式计算其凋亡率:凋亡率=凋亡细胞数/总细胞数×100%。
1.3.4 检测各组小鼠颅内胶质瘤组织Akt/MDM2/p53通路相关蛋白表达:取出1.3.1中各组小鼠胶质瘤组织分别提取其中总蛋白,进行免疫印迹实验检测其中Akt/MDM2/p53通路相关蛋白表达。

2 结 果
2.1 不同浓度益母草碱对GL261细胞增殖的影响比较 0.4、0.8、1.2、1.6、2.0 mmol/L的益母草碱均可抑制GL261细胞增殖,且抑制作用随益母草碱浓度的升高而增强(后续研究选择接近IC50值的1.6 mmol/L益母草碱),见图1。
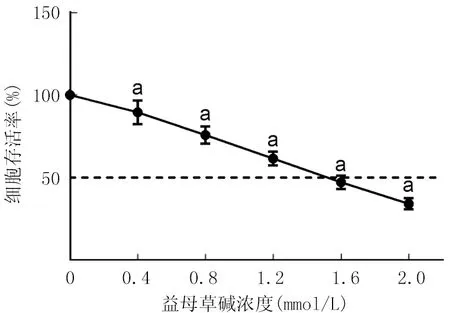
注:与0 mmol/L的益母草碱比较,aP<0.05。
2.2 益母草碱对GL261细胞Akt/MDM2/p53通路相关蛋白的影响比较 与对照组比较,益母草碱组细胞p-Akt/Akt、p-MDM2/MDM2降低(P<0.05),p53蛋白表达升高(P<0.05);与益母草碱组比较,益母草碱+SC79组细胞p-Akt/Akt、p-MDM2/MDM2升高(P<0.05),p53蛋白表达降低(P<0.05),见图2、表1。

表1 各组GL261细胞Akt/MDM2/p53通路相关蛋白相对表达比较

注:A.对照组;B.益母草碱组; C.益母草碱+SC79组。
2.3 益母草碱对GL261细胞增殖、凋亡、迁移与侵袭的影响比较 与对照组比较,益母草碱组细胞存活率、迁移率与侵袭数降低(P<0.05),凋亡率升高(P<0.05);与益母草碱组比较,益母草碱+SC79组细胞存活率、迁移率与侵袭数升高(P<0.05),凋亡率降低(P<0.05),见图3、图4、图5、表2。

表2 各组GL261细胞存活率、凋亡率、迁移率与侵袭数比较

图3 流式细胞术检测各组GL261细胞凋亡

图4 划痕实验检测各组GL261细胞迁移(×200)

图5 Transwell实验检测各组GL261细胞侵袭(结晶紫染色,×200)
2.4 不同剂量益母草碱对小鼠颅内胶质瘤细胞增殖的影响比较 与对照组小鼠颅内胶质瘤Ki67阳性率(65.42±8.83)%比较,益母草碱低剂量组(50.14±4.41)%、益母草碱中剂量组(34.89±3.63)%、益母草碱高剂量组(19.87±2.04)%均降低,并呈剂量依赖性(F/P=57.126/<0.001);与益母草碱组比较,益母草碱+SC79组(59.26±8.12)%升高(t/P=16.050/<0.001),见图6。

注:红色箭头表示Ki67阳性染色的细胞。
2.5 益母草碱对小鼠颅内胶质瘤细胞凋亡的影响比较 与对照组小鼠颅内胶质瘤组织细胞凋亡率(5.16±0.87)%比较,益母草碱组(40.52±7.13)%显著升高(t/P=20.076/<0.001);与益母草碱组比较,益母草碱+SC79组(8.24±2.06)%显著降低(t/P=18.328/<0.001),见图7。

注:红色箭头表示TUNEL阳性染色的凋亡细胞。
2.6 益母草碱对小鼠颅内胶质瘤组织Akt/MDM2/p53通路相关蛋白的影响比较 与对照组比较,益母草碱组胶质瘤组织p-Akt/Akt、p-MDM2/MDM2降低(P<0.05),p53蛋白表达升高(P<0.05);与益母草碱组比较,益母草碱+SC79组胶质瘤组织p-Akt/Akt、p-MDM2/MDM2升高(P<0.05),p53蛋白表达降低(P<0.05),见图8、表3。

表3 各组小鼠颅内胶质瘤组织Akt/MDM2/p53通路相关蛋白相对表达比较

注:A.对照组;B.益母草碱组;C.益母草碱+SC79组。
3 讨 论
胶质细胞瘤为浸润性生长,与正常脑组织界限不明显,手术治疗难以完全切除,临床中会辅助进行放疗、化疗,虽可延缓病情进展,但复发率高并伴随较大不良反应,因而仍需积极开发新型治疗策略[15-16]。益母草是我国广泛应用的传统药物,具有较强的抗癌活性[17]。益母草碱是益母草主要活性成分,研究显示,益母草碱可呈时间和剂量依赖性的方式抑制宫颈癌细胞生长、增殖,并可增强其对顺铂的敏感性[9];在前列腺癌中,益母草碱可通过促使前列腺癌细胞周期阻滞和凋亡来减轻其恶性生物学行为[7]。在本研究中,以0.4、0.8、1.2、1.6、2.0 mmol/L益母草碱处理GL261细胞均可抑制其增殖,且抑制作用随益母草碱浓度的升高而增强,以1.6 mmol/L益母草碱处理GL261细胞可升高其凋亡率,并降低其存活率、迁移率、侵袭数,表明益母草碱可抑制脑胶质瘤细胞增殖、迁移、侵袭并促使其凋亡。体内实验显示,90、180、360 ng/g的益母草碱可降低小鼠胶质瘤组织中Ki67阳性表达并呈剂量依赖性,以360 ng/g的益母草碱处理颅内胶质瘤模型小鼠可升高胶质瘤组织细胞凋亡率,证实益母草碱可抑制脑胶质瘤细胞在小鼠颅内增殖并诱导其凋亡,揭示益母草碱可减弱脑胶质瘤细胞在体内外增殖活性及促使其凋亡,并可抑制其体外迁移及侵袭,对脑胶质瘤发挥明显抗癌功效。
Akt/MDM2/p53信号通路可通过调控氧化应激、细胞衰老、DNA损伤等介导癌症的发生发展[18]。Akt磷酸化可促进转录因子MDM2的稳定和核易位,从而引发随后的泛素化和肿瘤抑制因子p53的降解[19-20]。据报道,增强Akt和MDM2磷酸化可降低p53表达,驱动致癌物诱导的肺癌、乳头状瘤和肝细胞癌等恶性肿瘤发生[21]。Zhao等[22]发现Akt/MDM2/p53参与介导杜鹃酮对肺癌的抗肿瘤过程,Akt激活剂SC79可逆转杜鹃酮对肺癌细胞的抗增殖、促凋亡和促细胞周期阻滞效应。Wang等[6]研究证实抑制胶质瘤细胞中的Akt/MDM2/p53信号转导可降低胶质瘤细胞的增殖、迁移和侵袭能力。此外,Zhuang等[8]发现益母草碱在抑制急性髓细胞白血病细胞增殖生长过程中可抑制Akt信号激活。本研究结果显示,以1.6 mmol/L益母草碱处理GL261细胞及其颅内胶质瘤模型小鼠可降低p-Akt/Akt、p-MDM2/MDM2并升高p53蛋白表达;因而推测益母草碱减轻脑胶质瘤细胞恶性生物学行为可能是通过促使Akt/MDM2/p53信号失活实现的。为了验证此推测,本研究以益母草碱和Akt激活剂SC79联合处理GL261细胞及其颅内胶质瘤模型小鼠,结果显示SC79可减弱益母草碱对脑胶质瘤细胞增殖、体内生长、迁移、侵袭的抑制作用,消除其对细胞凋亡的促进作用,最终逆转其对脑胶质瘤细胞恶性生物学行为的减轻作用,揭示益母草碱对脑胶质瘤细胞发挥抗癌功效是通过抑制Akt/MDM2/p53激活实现的。
综上所述,益母草碱可抑制脑胶质瘤细胞增殖、体内生长、迁移与侵袭,促使其在体内外凋亡,抑制Akt/MDM2/p53信号可能是其发挥抗肿瘤作用的机制。本研究证实了益母草碱可作为治疗脑胶质瘤的候选药物,并为其临床应用推广提供了科学依据,有利于开发更有效的脑胶质瘤治疗技术。
利益冲突:所有作者声明无利益冲突
作者贡献声明
黄超:设计研究方案,实施研究过程,论文撰写;方兴刚:提出研究思路,实施研究过程,分析试验数据,论文修改;陈璐:提出研究思路,分析试验数据,资料搜集整理,论文审核;陈汉玉、陈曾凤:统计学分析,论文修改,论文审核

