m6A 修饰促进宫颈癌的增殖和迁移并调控PD-L1 表达
杨京蕊,夏娜娜,余敏敏
(南京中医药大学附属南京医院妇科, 江苏 南京 210003)
宫颈癌是最常见的妇科恶性肿瘤,严重危害着女性的生命健康。2020 年中国宫颈癌新发病例近11 万,死亡病例近6 万,分别约占全球发病和死亡总数的18.3% 和17.6%,且患者年龄具有年轻化倾向[1]。2022 年 美 国 国 立 综 合 癌 症 网 络 (National Comprehensive Cancer Network, NCCN) 公布的宫颈癌临床实践指南指出,中晚期宫颈癌的一线治疗首 选 放 化 疗,PD-L1 阳 性 (CPS≥1) 或MSI-H/dMMR 的持续性或复发转移性宫颈癌患者一线联合化疗首选程序性死亡受体1 (PD-1) 抑制剂派姆单抗+顺铂(卡铂)+紫杉醇±贝伐单抗(证据等级1)[2]。肿瘤的免疫治疗已逐渐成为宫颈癌治疗的研究热点,但单独使用PD-1 抑制剂的总体缓解率仅20%左右[3],因此,探索更为有效的免疫联合治疗手段和免疫治疗应答生物标志物对宫颈癌的治疗尤为重要。
N6-甲 基 腺 嘌 呤 (N6-methyladenosine, m6A)修饰是一种基因调控机制,异常 m6A 修饰水平的变化会导致一系列癌症的发生,包括宫颈癌、子宫内膜癌、鳞状细胞癌等[4]。m6A 修饰普遍存在于真核生物中,研究发现 m6A 修饰的动态调控与基因表达显著相关,有可能通过其他途径影响PD-L1 的表达[5]。甲基转移酶蛋白3 (methyltransferase-like 3,METTL3) 在 近 终 止 密 码 子 区 域 介 导PD-L1mRNA 的m6A 甲基化修饰,从而调控PD-L1的表达并维持基因的稳定[6]。此外,研究通过分析癌症基因组图谱(The Cancer Genome Atlas,TCGA) 数据集中的 306 例宫颈癌患者的临床信息和转录组数据,发现m6A 修饰模式与免疫治疗应答密切相关,对于宫颈癌的发生和进展具有重要影响[7]。目前,m6A 修饰在宫颈癌发生发展中的关键作用研究不足,与PD-L1 表达的相关性研究尚未有报道。因此,本研究拟观察m6A 修饰相关基因和PD-L1 在宫颈癌组织中的表达情况,并探索其对宫颈癌细胞增殖、迁移和凋亡的影响,及其与PD-L1 表达的相关性,进一步发现相关分子机制,为宫颈癌的免疫联合治疗和有效的免疫治疗应答生物标志物提供理论依据。
1 材料和方法
1.1 一般材料
SiHa 细胞(中国上海科学院细胞库);胎牛血清(Gibco 公司);RFect 转染试剂、si-METTL14 (序列为 5'-CCGACAGCAUUGGUGCCGUGUUAAA-3')、si-YTHDF1(序列为5'-CCUACGGACAGCUCAGUAA-3')、si-NC (序 列 为5'-UUCUCCGAACGUGUCACGUdTdT-3')、CCK-8 试 剂 盒、PCR引物 (#YWSJ)、超灵敏化学发光检测试剂盒(均购自南京普诺恩生物科技有限公司);RNA 提取试剂盒、逆转录试剂盒 (#R333-01)、定量PCR 检测试剂盒 (#Q711-02)、Annexin V-FITC/PI 细胞凋亡检测试剂盒(均购自诺唯赞生物科技有限公司);BCA蛋白浓度测定试剂盒(碧云天生物技术有限公司);蛋 白Marker (#01120923)(Thermo 公 司);兔 抗METTL14 Rabbit pAb (#26158-1-AP)、YTHDF1 Rabbit pAb (#17479-1-AP)、PD-L1/CD274 Rabbit pAb (#28076-1-AP) 、 GAPDH Rabbit pAb(#KK1102) (均购自ProteinTech 公司);HRP Goat Anti-Rabbit IgG(H+L) (#AS014) (ABclonal 公司);柠 檬 酸 抗 原 修 复 液 (#C1032)、兔 血 清(#SL034)、DAB 显色试剂盒(#DA1010)(均购自北京索莱宝科技有限公司)。
1.2 方法
1.2.1 免疫组织化学染色 将正常宫颈组织和宫颈癌组织依次进行石蜡切片脱蜡至水,抗原修复,阻断内源性过氧化物酶,血清封闭,兔抗METTL14单克隆抗体 (1∶300) 、兔抗YTHDF1 单克隆抗体(1∶300) 、PD-L1 单克隆抗体 (1∶200) 孵育过夜,次日HRP 标记的山羊抗兔IgG (1∶2 000) 室温孵育50 min,DAB 显色,苏木素复染,中性树胶脱水封片,结果判读(苏木素染细胞核为蓝色,DAB 显出的阳性表达为棕黄色)。
1.2.2 SiHa 细胞培养和转染 SiHa 宫颈癌细胞用含10%胎牛血清和1%双抗的完全培养基培养,置于37 ℃,含5% CO2的培养箱中。转染前一天,取经过两次传代以上的处于对数生长期的SiHa 细胞接种于6 孔板,待细胞达到约50%的融合度时,按照转染试剂说明书步骤进行小干扰 RNA(si-METTL14、si-YTHDF1、si-NC) 的转染,分为实 验 组(si-METTL14、si-YTHDF1) 和 对 照 组(si-NC),放入培养箱培养48 h 进行RNA 水平检测,培养72 h 进行蛋白水平检测。
1.2.3 CCK-8 法检测SiHa 细胞的活力 取转染后处于对数生长期的SiHa 细胞,包括si-METTL14、si-YTHDF1 实验组(已分别培养0、24、48、72、96 h)和si-NC 对照组分别计数,调整细胞浓度为3×104个/mL,用排枪按100 μL 细胞悬液/孔接种于96 孔板中,每组细胞设置3 个复孔,放入37 ℃,含5%CO2培养箱中培养。待细胞贴壁后,每孔加入10 μL CCK-8 溶液,继续避光孵育3 h,酶标仪下测定450 nm 波长处各孔吸光度。然后利用GraphPad Prism 8.0.2 软件,以时间 (h) 为横轴,细胞活力 (OD450)值为纵轴,绘制生长曲线。
1.2.4 qPCR 法 检 测 METTL14、YTHDF1 和PD-L1 mRNA 的表达 取转染后的SiHa 细胞,按照RNA 提取试剂盒说明书提取总RNA,酶标仪中测量所提取RNA 的浓度和纯度后进行逆转录,然后根据定量PCR 检测试剂盒说明进行PCR 反应。以GAPDH 作为内参基因,其上游引物为5'-GAAGGTGAAGGTCGGAGTC-3',下游引物为5'-GAAGATGGTGATGGGATTTC-3';METTL14 上游引物为5'-AGTGCCGACAGCATTGGTG-3',下游引物为5'-GGAGCAGAGGTATCATAGGAAGC-3';YTHDF1 上 游 引 物 为5'-ACCTGTCCAGCTATTACCCG-3',下游引物为5'-TGGTGAGGTATGGAATCGGAG-3',PD-L1上游引物为5'-GCTGCACTAATTGTCTATTGGGA-3',下游引物为5'-AATTCGCTTGTAGTCGGCACC-3'。
1.2.5 Western blot 法 检 测METTL14、YTHDF1和PD-L1 蛋白的表达 从培养箱取出转染后的Si-Ha 细 胞,用 按100∶1 比 例 配 制 的RIPA 裂 解 液 与PMSF 的混合液裂解细胞,提取总蛋白,根据BCA蛋白试剂盒定量蛋白浓度后进行归一化,然后在100 ℃高温下对所提蛋白进行加热变性。设置恒压150 V 电泳90 min 左右,至溴酚蓝跑出胶的底端停止电泳,用250 mA 电流转膜1 h,5%脱脂牛奶封闭1 h。然后在PVDF 膜上滴加兔抗METTL14 单克隆抗体(1∶1 500),兔抗YTHDF1 单克隆抗体(1∶4 000),兔抗PD-L1 单克隆抗体(1∶600),兔抗GAPDH 单克隆抗体(1∶1 000),4 ℃冰箱孵育过夜。次日,TBST 清洗掉一抗,在PVDF 膜上继续滴加HRP 标记的山羊抗兔IgG(H+L)(1∶5 000),室温孵育1 h,洗膜。最后,配制超敏ECL 化学发光液,在化学发光成像系统上进行显影成像,并采集图像。
1.2.6 Transwell 实验检测SiHa 细胞的迁移能力取转染后的实验组 (si-METTL14、si-YTHDF1) 和对照组 (si-NC) 细胞,用胰蛋白酶消化,重悬计数,调整细胞密度为3×105个细胞/mL,加入200 μL 于Transwell 小 室 的 上 室 中,再 加 入600 μL 含20%FBS 的DMEM 培养基于下室中,置于37 ℃,5%CO2培养箱中培养48 h,用干燥医用棉签擦去小室内部未迁移的细胞,加入4%多聚甲醛溶液常温固定20 min,再加入结晶紫溶液常温避光染色15 min,PBS 清洗,待自然风干后,置于显微镜下拍照,并用ImageJ 软件进行定量,GraphPad Prism8.0.2 软件进行数据分析及绘图。
1.2.7 流式细胞术检测SiHa 细胞的凋亡情况 取实 验 组 (si-METTL14、si-YTHDF1) 和 对 照 组(si-NC) 细胞经胰酶消化,预冷的PBS 洗2 遍,离心,加入适量体积1×Binding Buffer 重悬细胞,计数,调整细胞密度为1×106个/mL。设置实验组(空白管、FITC 单染管、PI 单染管、FITC-PI 双染管)和对照组(空白管、FITC-PI 双染管),每管均加100 μL细胞悬液,单染管分别加入5 μL FITC 和5 μL PI,双染管同时加入5 μL FITC 和5 μL PI,室温避光孵育15 min,结束后再次加入400 μL 1xBinding Buffer到5 mL 流式管,充分混匀,在流式细胞分析仪上检测细胞凋亡情况,最后用FlowJo 10 进行结果分析。
2 结果
2.1 METTL14、YTHDF1、PD-L1 在宫颈癌组织中高表达
通过对宫颈癌组织和正常宫颈组织进行免疫组化染色,结果发现,相比于正常宫颈组织,8 例宫颈 癌 样 本 中 的METTL14、YTHDF1、PD-L1 均 显著高表达。见图1。
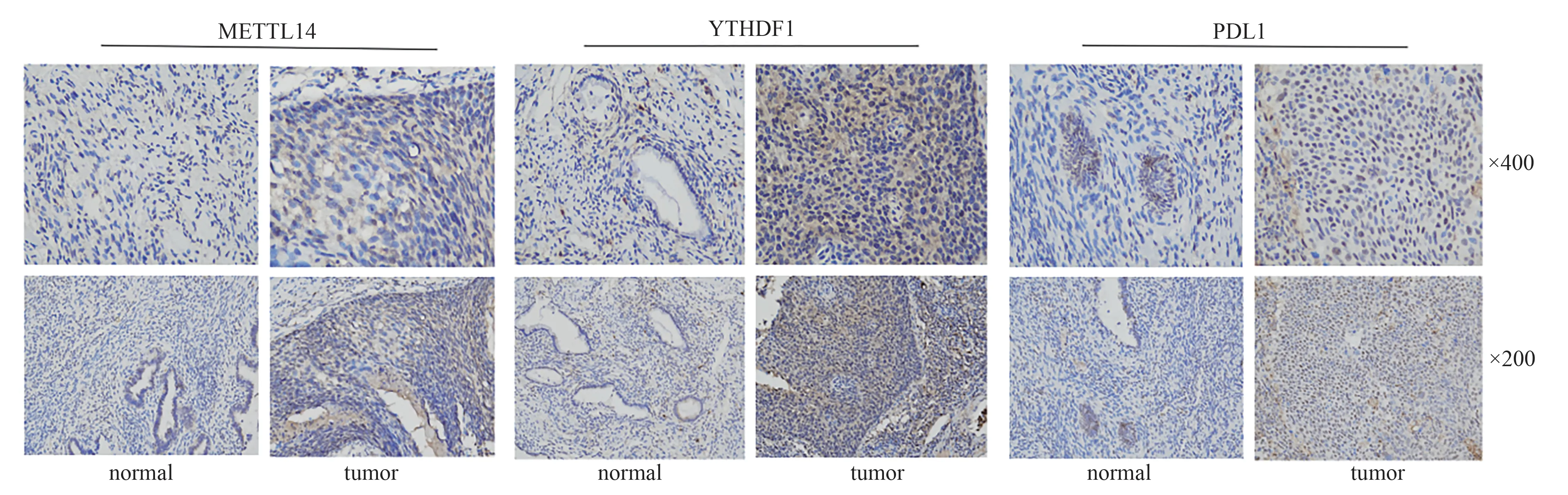
图1 免疫组化染色检测METTL14、YTHDF1、PD-L1 在宫颈癌组织中的表达水平Fig 1 Immunohistochemical staining for the expression levels of METTL14, YTHDF1, and PD-L1 in cervical cancer tissue
2.2 敲低 METTL14、YTHDF1 抑制 SiHa 细胞活性
为了研究METTL14 和YTHDF1 在宫颈癌中的作用,在SiHa 细胞中敲低METTL14 和YTHDF1 的表达,同时转染阴性对照和荧光转染对照,荧光电子显微镜观察转染效率(图2A),并通过qPCR 法进一步验证敲低效果(P<0.05,图2B)。敲 低 METTL14 和YTHDF1 后,CCK-8 实 验 检 测METTL14 和YTHDF1 对SiHa 细胞生长的影响,结果表明,敲低 METTL14 和YTHDF1 表达后,Si-Ha 细胞的活性显著降低(P<0.05,图2C)。
2.3 敲低 METTL14、YTHDF1 抑制 SiHa 细胞的迁移
进一步探究 METTL14、YTHDF1 对宫颈癌细胞迁移能力的影响,敲低 METTL14、YTHDF1 后,采用 Transwell 细胞迁移实验检测 SiHa 细胞的迁移能力。结果显示,相对于si-NC 组,si-METTL14组和si-YTHDF1 组的细胞迁移数量明显减少,(P<0.05,图3),表明敲低 METTL14、YTHDF1 可以显著抑制宫颈癌SiHa 细胞的迁移能力。
2.4 敲低 METTL14、YTHDF1 促进 SiHa 细胞的凋亡
为了明确 METTL14、YTHDF1 是否影响 Si-Ha 细胞的凋亡,在敲低 METTL14、YTHDF1 后,利用流式细胞仪检测 SiHa 细胞凋亡情况。结果显示,敲低METTL14、YTHDF1 后,SiHa 细胞凋亡数量明显增多(P<0.05,见图4)。

图4 敲低 METTL14、YTHDF1 后对SiHa 细胞凋亡的影响Fig 4 The effect of knocking down METTL14 and YTHDF1 on SiHa cell apoptosis
2.5 敲 低 METTL14、YTHDF1 抑 制PD-L1 的表达
通 过 qPCR 法 检 测 敲 低 METTL14 和YTHDF1 后对PD-L1 mRNA 表达的影响,结果显示,敲 低METTL14、YTHDF1 表 达 后,PD-L1 mRNA 的表达明显下调(P<0.05,图5A、B)。进一步通过Western blot 检测敲低 METTL14 和YTHDF1 表达后是否影响PD-L1 蛋白的表达,结果显示,PD-L1 蛋白的表达也随着METTL14 和YTHDF1 的敲低而明显下调(P<0.05,图5C、D)。
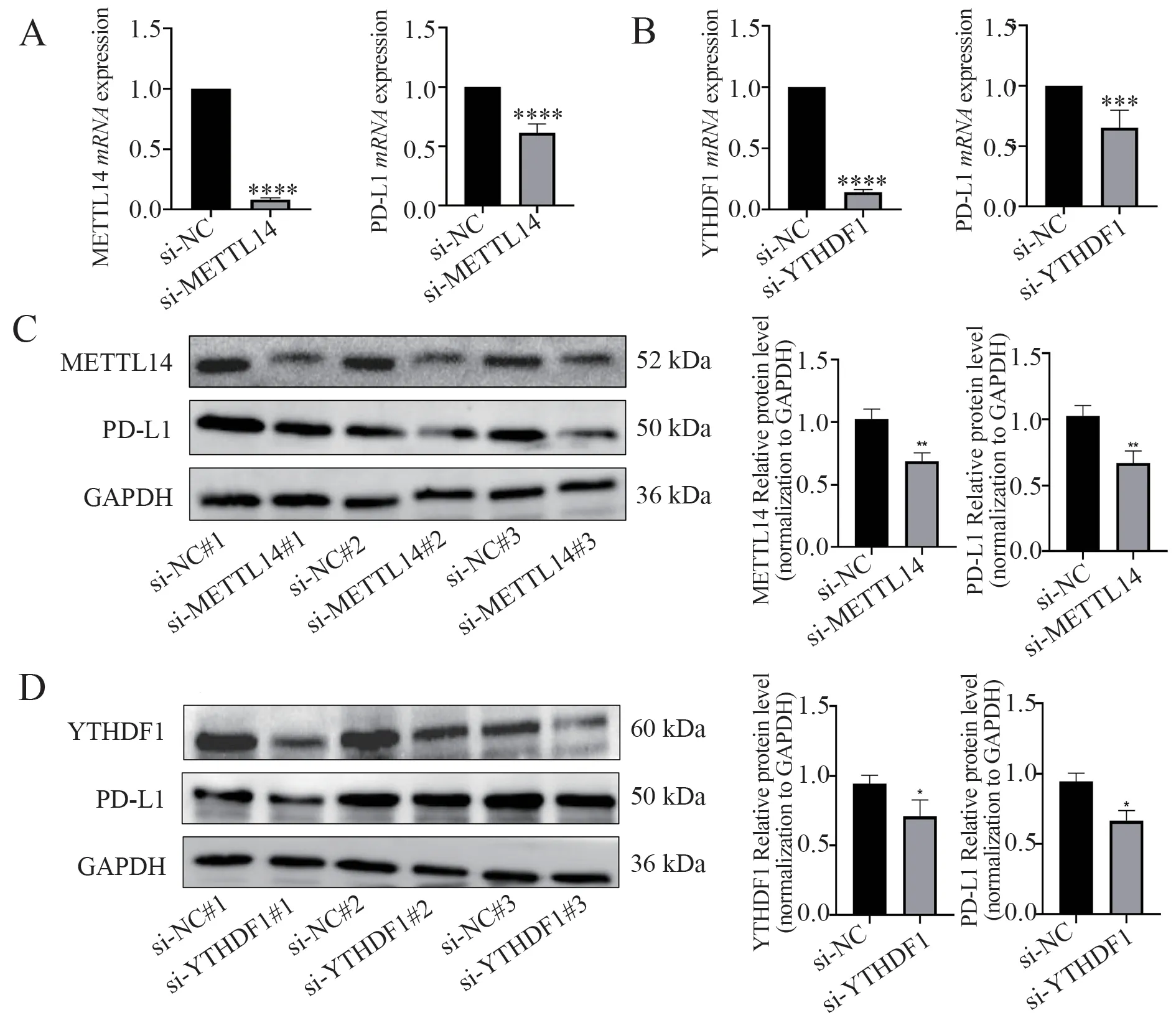
图5 敲低 METTL14、YTHDF1 对PD-L1 表达的影响Fig 5 The effect of knocking down METTL14 and YTHDF1 on PD-L1 expression
3 讨论
宫颈癌的传统治疗主要采用手术、放化疗。近几年,一些新的靶向药物也被用于宫颈癌的治疗,如靶向血管内皮生长因子和表皮生长因子受体等,这些药物可以更加精准地攻击宫颈癌细胞,减少对正常细胞的伤害[8]。同时,利用人工智能、基因编辑、核酸递送等新技术开发的新型治疗方法也在被广泛研究[9]。此外,随着首个PD-1 抑制剂派姆单抗(pembrolizumab) 及极具价格优势的国产PD-1 抑制剂的获批上市,免疫治疗也逐渐成为宫颈癌治疗的研究热点[10]。研究人员还通过对宫颈癌患者的组织和血液样本进行分析,发现表观遗传修饰、基因突变等因素在宫颈癌的发生和发展中也发挥着重要作用,并识别了一系列潜在的生物标志物,为宫颈癌的治疗提供了新的靶点和方法[11]。本研究通过免疫组织化学染色法观察m6A 修饰相关调节基因METTL14、YTHDF1 和免疫检查点PD-L1 在宫颈癌组织和正常宫颈组织中的表达情况,也发现METTL14、YTHDF1 和PD-L1 在宫颈癌组织中显著高表达,推测m6A 相关基因与免疫检查点之间具有一定的相关性,严重影响着宫颈癌的进展和预后。
m6A 甲基化修饰可调控疾病的进展过程,在不同肿瘤中有着不同的调控作用,近年来受到肿瘤治疗界的广泛关注[12]。甲基转移酶样蛋白14(Methyltransferase-Like Protein 14,METTL14)是催化m6A修饰的主要甲基化酶之一 ,在催化m6A 在RNA 上的甲基化,包括稳定性、剪接、运输和翻译等方面发挥着重要作用[13]。研究发现METTL14 通过促进YTHDF2 以m6A 修饰依赖的方式降解诱导泛素连接酶 (Siah2) 在胆管癌中表达,而Siah2 的表达可抑制PD-L1 的表达。同时,研究还发现Siah2 低表达的肿瘤对PD-1 抑制剂治疗更为敏感,进而证实了METTL14-Siah2-PD-L1 调节轴在癌症免疫治疗中的潜在作用[14]。此外,研究还发现沉默METTL14的同时联合PD-1 抑制剂治疗可有效抑制肿瘤进展,增强免疫治疗效果,其主要作用机制为抑制METTL14 可改变肿瘤微环境中CD8+TIL 的招募,使癌症患者对免疫治疗敏感[15]。YTH 结构域家族蛋白1(YTH N6-Methyladenosine RNA Binding Protein 1, YTHD1) 是 一 种 与m6A 修 饰 相 关 的 RNA结合蛋白,通过与mRNA 上的m6A 结合调控mRNA 的 翻 译[16]。有 研 究 证 实,YTHDF1 缺 陷 小鼠相较于野生型小鼠,肿瘤细胞内特异性抗原的提呈及CD8+T 细胞的激活更强,从而表现出更持久的抗肿瘤反应。因此,研究通过下调YTHDF1 并联合PD-1 抑制剂,发现YTHDF1 以m6A 依赖的方式调节树突状细胞中溶酶体蛋白酶的表达,进而增强了免疫检查点抑制剂的治疗效果[17]。AlkB 同源物5(AlkB homolog5, ALKBH5) 作为一种重要的m6A去甲基化酶,对m6A 甲基化组的测序发现,PD-L1 mRNA 是m6A 修饰的直接靶点,肿瘤固有的ALKBH5 可通过维持肿瘤细胞PD-L1 的表达来抑制T细胞的扩增,进而促进肿瘤进展[18]。这些结果均证实了靶向m6A 的免疫调控治疗方案的可行性,是克服肿瘤免疫耐药的新思路。虽然靶向肿瘤免疫联合治疗在癌症治疗中已取得进展,但在宫颈癌研究中仍处于发展阶段。因此,有必要深入探索宫颈癌免疫治疗获益的潜在作用靶点和有效联合方式。本研究首先通过在宫颈癌组织中发现m6A 修饰相关调节基因METTL14、YTHDF1 和免疫检查点PD-L1 均显著高表达,且表达水平呈现正相关。之后在SiHa 细胞中敲低METTL14 和YTHDF1 基因的表达,通过CCK-8 实验、Transwell 实验、细胞流式实验验证METTL14、YTHDF1 对宫颈癌细胞功能的影响,发现敲低METTL14 和YTHDF1 可显著抑制SiHa 细胞的增殖和迁移,促进SiHa 细胞的凋亡。同时通过qPCR 和Western blot 法验证METTL14、YTHDF1 与PD-L1 的相关性,发现PD-L1 的表达水平随着METTL14 和YTHDF1 下调而降低。因此,本研究得出m6A 相关调节因子METTL14 和YTHDF1 显著影响宫颈癌细胞的功能,并通过促进PD-L1 的表达来促进宫颈癌的发生发展及免疫耐药,其作用机制还需要进一步深入研究。本研究也推测METTL14 和YTHDF1 可能是靶向肿瘤免疫联合治疗的有效靶点,也可能是筛选宫颈癌免疫治疗潜在获益人群的生物标志物。未来可通过针对METTL14 或YTHDF1 靶点的小分子抑制剂联合PD-L1 抑制剂进行宫颈癌治疗,或通过检测METTL14 或YTHDF1 联合PD-L1 的表达来筛选免疫治疗受益人群。
作者贡献度说明:
余敏敏:负责实验设计、实验指导及论文修改;杨京蕊:负责实验实施、数据处理及论文撰写;夏娜娜:负责部分实验实施和数据处理。
所有作者声明不存在利益冲突关系。

