大黄酸通过调控Sirt1/PGC-1α 通路对糖尿病心肌病的改善作用及机制研究
王甜甜,王 魏,杨翠华,卢 斌
(1.南京医科大学金陵临床医学院(东部战区总医院),江苏 南京 210002;2.中国人民解放军东部战区总医院,江苏 南京210002)
糖尿病患病率呈不断上升趋势,根据国际糖尿病联合会(international diabetes federation,IDF)第10 版报告[1],直到2021 年,215 个地区国家中20~79岁的成年人中有5.37 亿人患有糖尿病。糖尿病可造成心脏、脑、眼、肾脏、足等靶器官严重损害,这些并发症花费巨大,降低生活质量,严重危及生命。心血管并发症是糖尿病患者后期死亡的最主要原因之一,包括冠状动脉粥样硬化性心脏病,心脏自主神经改变,糖尿病心肌病( diabetic cardiomyopathy,DCM)[2]。DCM 是排除高血压、冠状动脉粥样硬化、心脏瓣膜疾病等高危因素,由糖尿病引起的以心脏结构和心室舒缩功能改变为特点的一种心脏病变,是糖尿病人心源性猝死的主要原因之一[3]。目前DCM 发病机制涉及心肌底物代谢转变、线粒体功能障碍、炎症氧化应激损伤、胰岛素抵抗、钙离子调控障碍及神经体液失调等[4,5]。心脏是高耗能的器官,其舒缩活动要依靠线粒体源源不断产生ATP,心肌细胞内约90% 的ATP 是由线粒体氧化磷酸化产生的,因此线粒体稳态对维持心脏功能有重要意义[6]。糖尿病条件下存在明显线粒体功能障碍,研究表明改善线粒体功能可减少糖尿病心肌的损伤[7-9]。
大黄酸(rhein, RH)是从传统中药大黄中提取到的一种蒽醌类化合物,作用广泛,能改善糖脂代谢、抗癌、抗炎、抗纤维化、抗氧化应激。研究表明,大黄酸能够延缓糖尿病肾病进展[10],提高胰岛功能[11],治疗脂肪肝[12]。目前尚无大黄酸对糖尿病心肌病的研究,本研究通过建立糖尿病小鼠模型,模拟糖尿病心肌病的病理条件,探讨大黄酸对糖尿病心肌病的保护作用及可能机制,为研究与治疗糖尿病心肌病提供理论依据。
1 材料与方法
1.1 实验动物
采用30 只5 周龄SPF 级C57BL/6J 雄性小鼠,体重18~20 g,购自南京集萃药康生物有限公司,均饲养在东部战区总医院比较医学科动物实验中心,环境温度约22 ℃,湿度约45%,昼夜循环12 h,自由进食、水。
1.2 试剂和仪器
大黄酸(南京景竹生物科技有限公司); 沉默信息调节因子 2 同源蛋白 1(silent mating type information regulation 2 homolog 1,SIRT1)抗体(Mllipore)、过氧化物酶体增殖物激活受体γ 共激活剂-1α(peroxisome proliferator-activated receptor-γ coactivator,PGC-1α)抗体(Abcam)、线粒体转录因子A(Mitochondrial transcription factor A,TFAM)抗体、β-tublin 抗体 (Abclonal);Sirt1、PGC-1α、TFAM、心钠肽(atrial natriuretic polypeptide,ANP)、脑钠肽(brain natriuretic peptide,BNP)、β-肌 球 蛋 白 重 链(β-myosin heavy chain,β-MHC)引物(南京普诺恩生物技术有限公司);Trziol、RNA 反转录和扩增试剂(南京诺唯赞生物科技股份有限公司)。强生血糖仪(美国强生公司)、实时荧光定量PCR 扩增仪(上海赛默飞世尔科技有限公司)、逆转录仪(日本Takara 公 司)、电 泳 仪/转 膜 仪、酶 标 仪(美 国BIO-RAD 公司)、组织研磨仪(武汉赛维尔生物科技有限公司)。
1.3 糖尿病小鼠造模
30 只C57BL/6J 小鼠随机分为正常对照组(Control 组,6 只)普通饮食喂养,24 只小鼠作为糖尿病组,高脂饮食喂养4 周后,每只鼠按照75 mg/kg腹腔注射链脲佐霉素(streptozotocin, STZ)溶液,7天后用采血针取尾静脉血测量空腹血糖,血糖≥11.1 mmol/L,视为造模成功;血糖<11.1 mmol/L的小鼠,再次注射STZ(50 mg/kg)直至空腹血糖≥11.1 mmol/L,每只小鼠注射STZ 次数不超过3 次,共计20 只小鼠达到糖尿病造模标准。
1.4 分组及药物干预
造模成功小鼠随机分成糖尿病组(DM 组)、糖尿病+大黄酸组(DM+RH 组)。DM+RH 组小鼠灌胃120 mg·kg-1·d-1体 重大黄酸;Control 组和DM组小鼠每天等体积灌胃0.5%纤维素钠溶液,共计12 周。
1.5 小鼠参数记录
大黄酸干预12 周后,所有小鼠禁食12 h,记录空腹血糖、体重;处死小鼠,取出心脏称重,计算心脏/体重比。
1.6 组织病理学染色
部分心脏组织用4%中多聚甲醛溶液固定后,常规脱水、透明、浸蜡、包埋、石蜡切片,苏木精-伊红染色观察心脏组织形态学变化;马松染色评价心肌间质纤维程度。
1.7 心肌线粒体形态观察
左心室部分组织依次用2.5%戊二醛溶液、1%四氧化锇溶液固定后,经脱水透明,3%醋酸铀-枸橼酸铅双染色,透射电子显微镜下观察心肌线粒体超微结构。
1.8 实时荧光定量PCR 检测基因表达
称取30 mg 心肌组织,利用Trizol 法提取细胞总RNA,根据逆转录试剂盒说明合成cDNA。PCR引物序列见表1。根据实时定量PCR 扩增试剂盒说明,反应程序为:第一步预变性:95 ℃ 5 min,1 个循环:第二步PCR 反应:95 ℃ 10 s,60 ℃ 34 s,40 个循环;第三步,熔解曲线分析。使用2-△△CT法计算各样本中相对mRNA 量,GAPDH 作为内参。
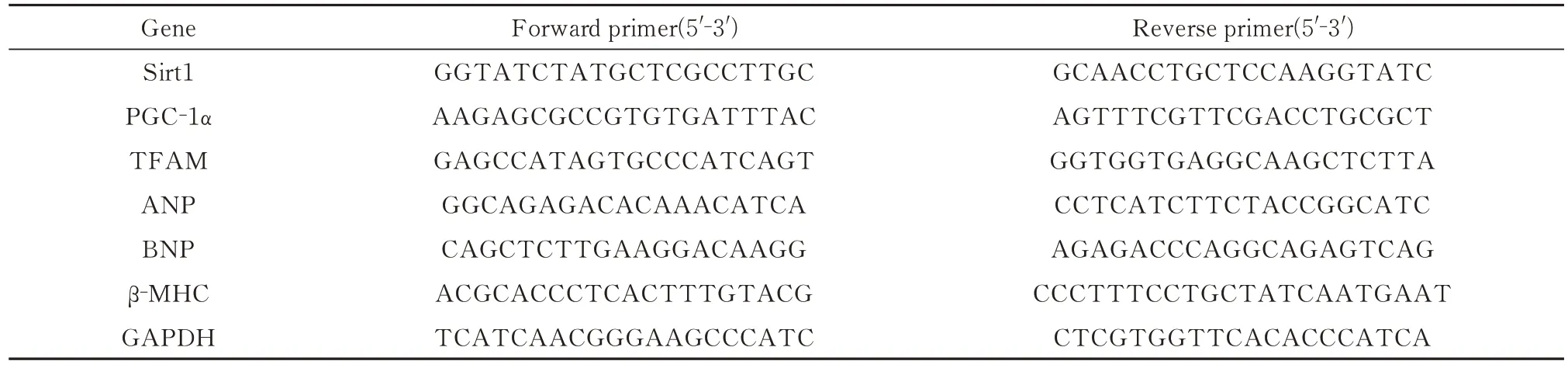
表1 小鼠引物序列Tab 1 Mouse primer sequences
1.9 蛋白质免疫印迹法检测心肌蛋白表达
称取15 mg 心脏组织加入裂解液(RIPA 裂解液:蛋白酶抑制剂=100∶1)离心留取上清,BCA 法测定蛋白浓度。SDS-PAGE 电泳分离、湿转至PVDF 膜,并 用5%BSA 的TBST 封 闭1 h,后 分别 用 一 抗Sirt1、PGC-1α、TFAM(1∶1 000)、β-tublin(1∶5 000)4 ℃孵育过夜,然后用TBST 洗涤4 次,再室温下孵育相应的山羊抗兔、抗鼠IgG 二抗(1∶5 000)1.5 h,再次TBST 洗涤4 次,用超敏ECL化学发光试剂显影曝光拍照。利用Image J 软件分析条带灰度值。
1.10 免疫组织化学染色
将切片梯度脱水透明后,微波炉加热进行抗原修复18 min,并用3%BSA 封闭2 h。分别用Sirt1、PGC-1α、TFAM(1∶50)抗体 4 ℃孵育过夜。PBS 冲洗两遍,山羊抗兔二抗室温孵育1 h,PBS 冲洗两遍,DAB 镜下显色45 s,苏木素染细胞核,最后进行一次脱蜡、脱水、中性树脂封片,显微镜下拍照观察。
1.11 统计学处理
采用Graphpad Prism9.0 软件进行数据分析。实验结果以均数±标准差(±s)表示,多组比较采用单因素方差分析,组间比较采用Turkey 多重比较。P<0.05 为差异有统计学意义。
2 结果
2.1 实验动物一般情况
24 只小鼠注射STZ 后, 4 只小鼠血糖未达标,20 只小鼠空腹血糖≥11.1 mmol/L,糖尿病模型成功。药物治疗12 周后,DM 组有3 只小鼠死亡,DM+RH 组 有2 只 小 鼠 死 亡,Control 组 无 小 鼠 死亡。死亡原因有血糖过高、感染。Control 组小鼠毛发光滑、色泽明亮,摄食量、进水量、尿量正常,活泼好动。DM 组小鼠体重降低,多饮、多食、多尿,有毛发脱落现象,精神不振,行动缓慢。DM+RH 组小鼠三多一少症状减轻,毛色有光泽,精神状态及活动较DM 组明显好转。
2.2 大黄酸对糖尿病小鼠血糖、体重及心脏/体重比的影响
与Control 组相比, DM、DM+RH 组的血糖均显著升高,差异具有统计学意义(P<0.01),DM+RH 组比DM 组的血糖有所降低,但两组间无统计学差异;与Control 组相比,DM、DM+RH 组的体重均显著降低,差异具有统计学意义(P<0.01);DM组体重低于DM+RH 组,两组体重无统计学差异;与Control 组相比,DM 组心脏/体重比明显增加,差异具有统计学意义(P<0.01),与DM 组比,DM+RH 组心脏/体重显著降低,差异具有统计学意义(P<0.01)。见表2。
表2 各组小鼠参数比较(n=5~8,±s)Tab 2 Comparison of parameters among different groups of mice(n=5~8,±s)
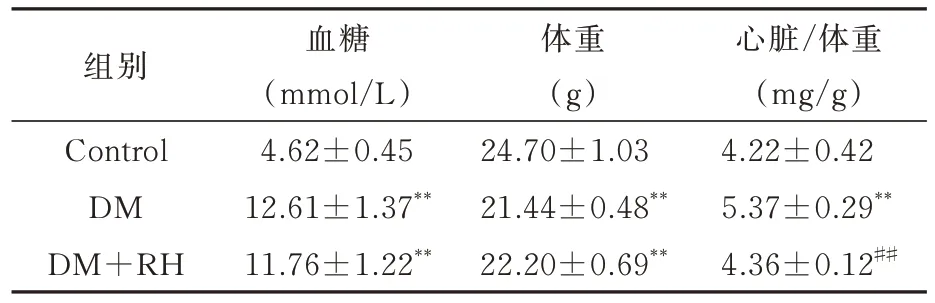
表2 各组小鼠参数比较(n=5~8,±s)Tab 2 Comparison of parameters among different groups of mice(n=5~8,±s)
组别Control DM DM+RH血糖(mmol/L)4.62±0.45 12.61±1.37**11.76±1.22**体重(g)24.70±1.03 21.44±0.48**22.20±0.69**心脏/体重(mg/g)4.22±0.42 5.37±0.29**4.36±0.12##
2.3 大黄酸改善糖尿病小鼠心肌组织结构损伤
HE 染色评估心肌组织损伤程度。与Control 组相比,DM 组的心肌纤维排列紊乱,心肌纹理不清,间隙增大,细胞核不规则、蓝染模糊,胞浆染色不匀,而DM+RH 组小鼠心肌排列较为规则,心肌纹理清晰,连接紧密,细胞核清晰,见图1。Masson 染色观察心肌间质纤维化情况,与Control 组相比,DM 组的心肌间质有较多胶原纤维沉积(蓝色)。与DM 组相比,DM+RH 组纤维沉积明显减少,见图2。
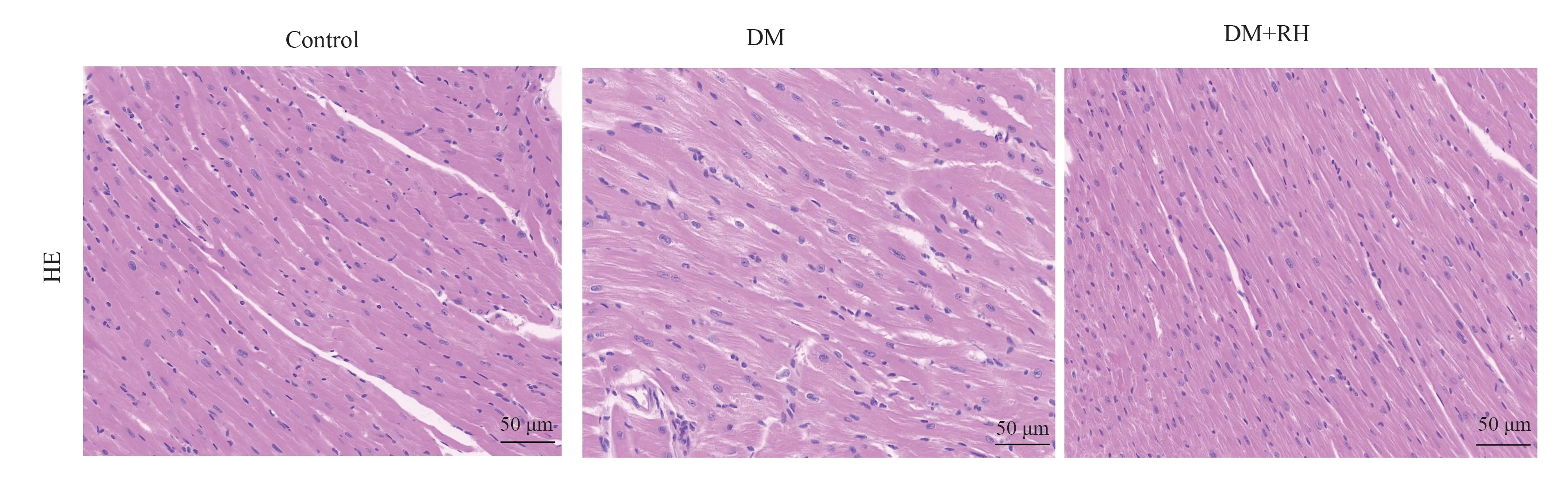
图1 三组小鼠HE 染色结果Fig 1 HE staining results of three groups of mice
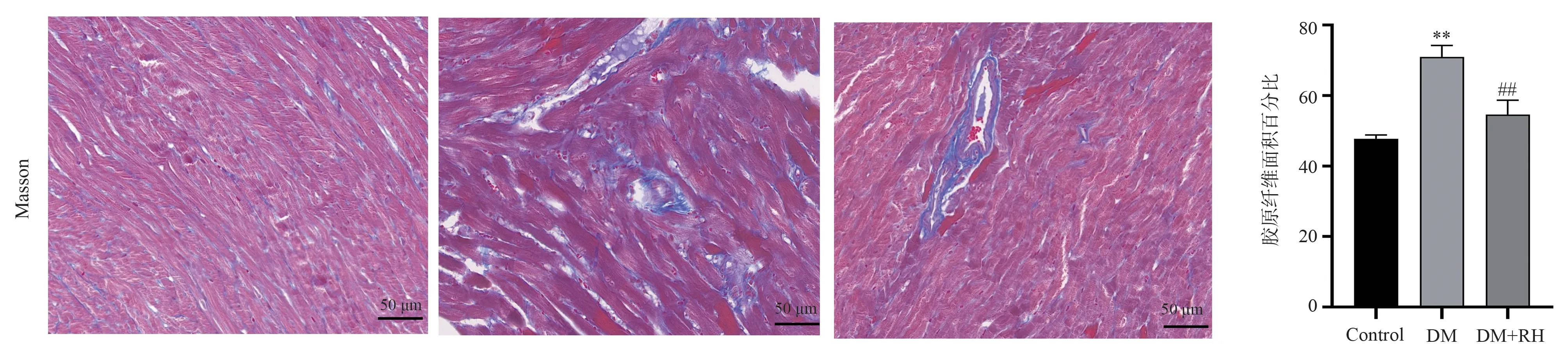
图2 三组小鼠Masson 染色结果Fig 2 Masson staining results of three groups of mice
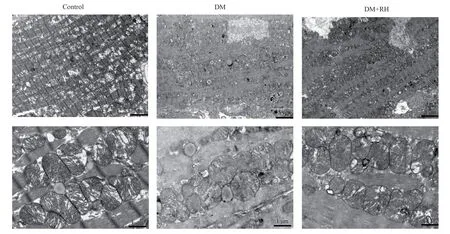
图3 不同组小鼠左心室线粒体超微结构Fig 3 Ultrastructure of left ventricular mitochondria in different groups of mice
2.4 大黄酸保护糖尿病小鼠心肌线粒体
电镜结果显示:Control 组小鼠心肌细胞结构完整,肌纤维排列规则,闰盘清晰可见,肌原纤维排列整齐,肌丝间可见多个排列成行的线粒体,线粒体嵴密集、整齐; DM 组心肌超微结构明显损伤,肌丝排列紊乱,闰盘模糊不清,有不规则的线粒体堆积,线粒体嵴几乎完全断裂;DM+RH 组心肌纤维排列较规则,线粒体形态基本正常,心肌损伤较DM 组减轻。
2.5 大黄酸对糖尿病小鼠心肌组织mRNA表达影响
RT-PCR 检测结果显示:与Control 组相比,DM组Sirt1、PGC-1α、TFAM mRNA 表 达 明 显 降 低,ANP、BNP 和β-MHC 明显增加(P<0.01),大黄酸干预后,上述基因表达水平改善(P<0.05),见表3及图4。
表3 三组小鼠心肌基因表达水平(n=3~4,±s)Tab 3 Myocardial gene expression levels in three groups of mice(n=3~4,±s)

表3 三组小鼠心肌基因表达水平(n=3~4,±s)Tab 3 Myocardial gene expression levels in three groups of mice(n=3~4,±s)
组别Control DM DM+RH Sirt1 1.00±0.12 0.50±0.09**0.75±0.08#PGC-1α 1.00±0.03 0.65±0.01**0.89±0.14##TFAM 1.00±0.07 0.55±0.01**0.84±0.05##ANP 1.00±0.14 1.81±0.30**1.31±0.12#BNP 1.00±0.21 3.22±0.06**2.03±0.07##β-MHC 1.00±0.32 2.34±0.07**1.38±0.23##
2.6 Western blot 检测蛋白表达结果
结 果 发 现,与Control 组 相 比,DM 组Sirt1、PGC-1α、TFAM 蛋 白 条 带 信 号 减 弱,与DM 组 比较,DM+RH 组上述蛋白条带信号明显增强(图5);以β-tublin 为内参,半定量计算显示,与Control 组相比,DM 组Sirt1、PGC-1α、TFAM 蛋白水平明显降低;与DM 组比较,DM+RH 组上述蛋白表达水平增加(表4)。
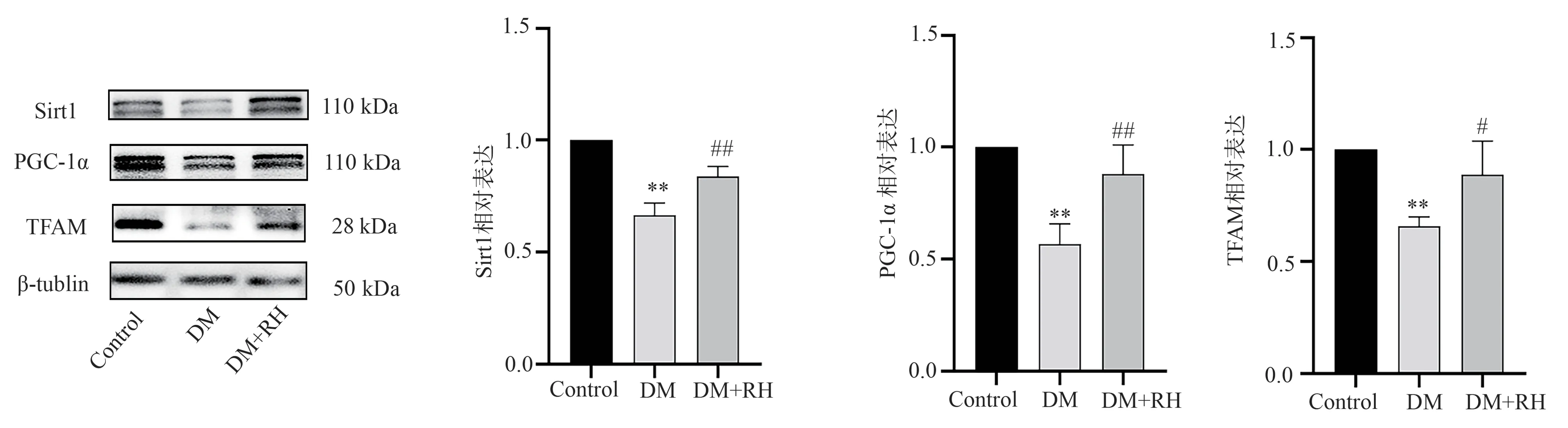
图5 三组小鼠心脏Sirt1、PGC-1α、TFAM 蛋白水平Fig 5 Sirt1 、 PGC-1 α and TFAM protein level of mouse heart in three groups
表4 三组小鼠心脏Sirt1、PGC-1α、TFAM 相对表达(n=3~4,±s)Tab 4 Sirt1、PGC-1 α and TFAM relative expression of mouse heart in three groups(n=3~4,±s)

表4 三组小鼠心脏Sirt1、PGC-1α、TFAM 相对表达(n=3~4,±s)Tab 4 Sirt1、PGC-1 α and TFAM relative expression of mouse heart in three groups(n=3~4,±s)
组别Control DM DM+RH Sirt1 1 0.67±0.05**0.84±0.04##PGC-1α 1 0.57±0.09**0.88±0.13##TFAM 1 0.66±0.04**0.89±0.15#
表5 Sirt1、PGC-1α、TFAM 蛋白阳性面积百分比(n=3,±s)Tab 5 Sirt1, PGC-1 α and TFAM protein positive area percentage(n=3,±s)
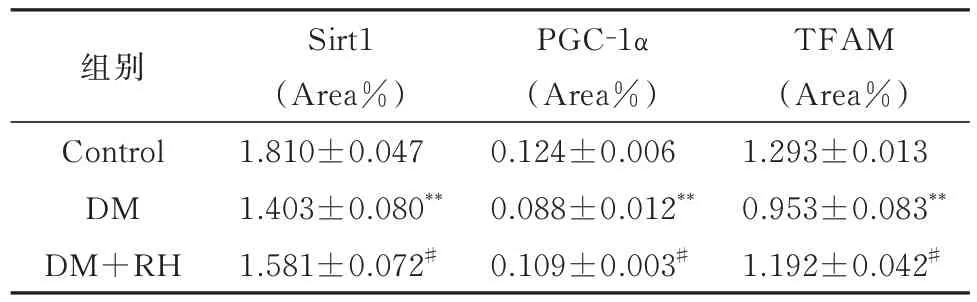
表5 Sirt1、PGC-1α、TFAM 蛋白阳性面积百分比(n=3,±s)Tab 5 Sirt1, PGC-1 α and TFAM protein positive area percentage(n=3,±s)
组别Control DM DM+RH Sirt1(Area%)1.810±0.047 1.403±0.080**1.581±0.072#PGC-1α(Area%)0.124±0.006 0.088±0.012**0.109±0.003#TFAM(Area%)1.293±0.013 0.953±0.083**1.192±0.042#
2.7 免疫组化检测蛋白表达结果
Sirt1、PGC-1α、TFAM 蛋白为胞浆中棕黄色颗粒样物质,与Control 组相比,DM 组心肌组织中棕黄色物质明显减少,DM+RH 组较DM 组的棕黄色物质增多。提示大黄酸可上调糖尿病小鼠心肌中Sirt1、PGC-1α、TFAM 蛋白表达。
3 讨论
糖尿病目前是全球最普遍慢性疾病之一,已严重危害人类健康。DCM 是由糖尿病引起的, 以心肌细胞坏死、凋亡和心脏重塑为特点,表现舒张和收缩功能障碍,最终发展至心力衰竭[5]。目前除了二 甲 双 胍[13]、钠-葡 萄 糖 协 同 转 运 蛋 白2 抑 制 剂(sodium-glucose contransporter2 inhibitors,SGLT2i)[14]、胰高血糖素样肽-1 受体激动剂(GLP-1RA)[15]被证实有良好的降糖效果和心血管益处,大多降糖药物并无心脏保护作用。线粒体占心肌细胞体积的30~40%,线粒体功能障碍是DCM 发病主要机制之一,因此以线粒体为靶点治疗DCM 的方法有望成为改善糖尿病心血管结局的重要思路[16]。
本研究采用STZ 联合高脂饮食构建糖尿病模型,STZ 具有破坏胰岛β 细胞的作用,已被广泛应用于诱导糖尿病模型的实验中[17,18]。在本研究中发现,给予C57BL/6J 小鼠STZ 单次腹腔注射一周后出现血糖升高,多饮、多食、多尿等糖尿病症状,小部分小鼠血糖仍正常,需要再次注射STZ。随着病程的延长,DM 组小鼠体重逐渐降低,DM+RH 组的体重高于DM 组,这说明大黄酸能够改善糖尿病三多一少典型症状。大黄酸干预组的血糖略低于DM 组,但无明显差别,提示大黄酸可能通过降低血糖以外的机制保护糖尿病心肌。
DCM 早期以心室舒张功能障碍为特点,对DCM 的预后有重要意义,DCM 舒张功能障碍与心肌 损 伤 与 重 构 相 关[19,20]。研 究 中HE 染 色 结 果 显示,DM 组的心肌纤维排列紊乱,心肌纹理不清,而DM+RH 组小鼠心上述表现减轻。这说明大黄酸可改善糖尿病心肌的结构损伤。心肌Masson 染色结果显示DM 组的心肌间质有较多胶原纤维沉积蓝色,DM+RH 组纤维沉积明显减少。β-MHC 是哺乳动物心脏内肌球蛋白连重链之一,主要表达在胚胎期的心脏中,与心肌间质纤维化、心肌僵硬和随后的舒张功能障碍密切相关,之前的研究已证实在糖尿病心肌中β-MHC 升高[21,22]。本实验中,DM 组小鼠心肌β-MHC mRNA 水平上调,而大黄酸逆转了β-MHC 表达上调。HW/BW 作为评价心肌肥厚的指标,其比值越大表示心肌肥厚越明显[23,24]。本实验中,DM 组HW/BW 比明显增加,与DM 组比,DM+RH 组HW/BW 显 著 降 低。ANP 和BNP 分别由心房和心室分泌,反应房室压力变化,在心脏舒张功能障碍早期可出现,有研究表明BNP 可作为糖尿病心肌病早期筛查、预后的指标[25]。实验中DM 组小鼠ANP 和BNP mRNA 均显著升高,反映了小鼠心脏功能障碍,而大黄酸可降低其表达。综上说明,大黄酸可减轻糖尿病心肌肥厚与纤维化情况,改善心功能。
线粒体是心肌细胞最重要的细胞器之一,线粒体稳态对维持心脏功能有重要意义。电子透射电镜结果显示,DM 组线粒体明显损伤,大黄酸干预后线粒体损伤减轻。Sirt1/PGC-1α 通路调控线粒体生物合成的重要途径之一。Sirt1 是烟酰胺腺嘌呤二核苷酸 (NAD+)依赖的组蛋白去乙酰化酶,作为治疗心血管疾病的潜在靶点被应用在多项研究中[26,27]。PGC-1α 是线粒体生物合成的中枢调节因子,受Sirt1 调控,可激活多种转录因子如NRF-1、NRF-2、TFAM、和雌激素相关受体-α,线粒体转录因子A 最终启动线粒体DNA 的合成[28]。目前有研究证实Exendin-4[29]、白藜芦醇[30]、褪黑素[31]可调控糖尿病心肌 Sirt1/PGC-1α 通路,减轻心肌损害。因此作用于 Sirt1/PGC-1α 通路的药物有可能成为治疗糖尿病心肌的方法之一。本研究结果显示DM 组Sirt1、PGC-1α、TFAM mRNA 及蛋白表达均显著降低,给 予 大 黄 酸 干 预 后,Sirt1、PGC-1α、TFAM 均升高。
综上所述,大黄酸对高糖导致的心肌损伤具有保护作用,其机制之一可能是通过激活Sirt1/PGC-1α 信号通路实现的。
作者贡献度说明:
王甜甜:实验设计与操作,数据整理与统计分析,论文撰写;王魏、杨翠华:实验操作助手;卢斌:研究指导,论文修改,经费支持。
所有作者声明不存在利益冲突关系。

