中性粒细胞外泌体中miR-15a-5p 通过靶向抑制BCL2L2 促进巨噬细胞凋亡
柯 桥,胡龙辉,阮楚峻,黎 敏,3
(1.海南医学院急诊创伤学院,海南 海口 571199;2.海南医学院附属海南医院急救中心,海南 海口 570311;3.教育部急诊与创伤重点实验室,海南 海口 570311)
中性粒细胞是人类淋巴系统中最丰富的白细胞,通过在炎症与损伤部位富集发挥先天性免疫功能[1,2]。研究表明,这些细胞能通过外泌体调控巨噬细胞,从而参与脓毒症相关急性肺损伤的发病过程[3,4],但其分子机制尚未完全清楚。
外泌体是一类由细胞释放,大小为40~150 nm,具有脂质双层膜的细胞外小泡,内含DNA、RNA 和蛋白质[5]。近年来已被发现作为特定细胞间通信的重要媒介[6]。尤其是微小RNA(microRNA ,miRNA)这类约22 nt 的短RNA 在外泌体中的角 色 正 引 起 广 大 研 究 者 的 兴 趣[7,8]。研 究 表 明,miR-15a-5p 在多种肿瘤中低表达,发挥抑制肿瘤增殖 转 移 的 功 能[9-11]。此 外,miR-15a-5p 通 过 靶 向TNIP2 调节巨噬细胞的炎症反应参与脓毒症发生发展[12]。尽管miR-15a-5p 已被证实可调控巨噬细胞的炎症反应,但其在中性粒细胞调控巨噬细胞的过程中如何通过外泌体进行传递,目前尚未见相关研究。
本研究通过探讨中性粒细胞外泌体中miR-15a-5p 表达,以及外泌体与miR-15a-5p 模拟物对巨噬细胞raw267.4 检测增殖凋亡变化,并验证miR-15a-5p 与BCL2L2 互作结合关系。结果提示,miR-15a-5p 在脂多糖LPS 诱导的中性粒细胞外泌体中高表达,可能通过靶向抑制巨噬细胞中BCL2L2 表达促进raw267.4 巨噬细胞凋亡。这可能是炎症诱导的中性粒细胞可通过外泌体miR-15a-5p 调节巨噬细胞凋亡的新机制,这对于理解中性粒细胞与巨噬细胞在微环境调控中的作用具有重要意义,为相关疾病的研究及临床治疗提供新的思路和方向。
1 材料与方法
1.1 实验动物
雄性C57BL/6J 小鼠购自上海斯莱克实验动物有限责任公司,提供充足的水和饲料,在无病原体环境下饲养,遵循海南医学院动物管理与动物伦理进行护理与动物处理。
1.2 实验细胞
依据文献[13],在8~10 周龄C57BL/6J 小鼠腹腔内诱导中性粒细胞。简而言之,小鼠腹腔间隔1 d分别2 次腹腔注射1 mL 9%酪蛋白溶液,第二次注射3 h 后处死,取腹腔灌洗液,然后离心漂洗后取细胞沉淀。根据制造商的说明采用不连续密度梯度离心法分离中心粒细胞(Sigma 公司,#1119 和#10771)。得到的细胞由90%的中性粒细胞组成。raw267.4 巨噬细胞,购自武汉普诺赛生命科技有限公司(CL-0190)。分离后,将中性粒细胞悬浮在完全培养基(RPMI1640,含10%无外泌体胎牛血清,添加50 mg/mL 青霉素/链霉素)中,浓度为106cells/mL,在37 ℃下,用15 μmol/L 脂多糖LPS(购自sigma 公司,SMB00610)孵育12 h 诱导中性粒细胞激活。以等量的磷酸盐游离生理盐水(PBS) 处理12 h 作为阴性对照。
1.3 外泌体分离与鉴定
采用超滤离心的方法提取外泌体(12 000g,4 ℃,45 min 离心去除较大囊泡后,4 ℃下110 000g离心70 min 2 次,取沉淀),提取后的外泌体用2%多聚甲醛固定,采用透射电镜(日本JEOL 公司,JEM-2100)观 察 外 泌 体 形 态(80 kV,拍 摄10 000 倍)。
1.4 ELISA 检测
IL-2(ml063136)、IL-6(ml063159)、IL-10(ml037873)与TNF-α(ml002095)试剂盒均购自上海酶联生物科技有限公司,根据试剂盒说明书,使用标准品绘制标准曲线,各样本在分光光度计(日本岛津公司,UV-1900)中检测OD 值,并利用标准曲线计算样本对应浓度。
1.5 RT-PCR 检测
使用Trizol 试剂(Invitrogen 公司,15596-026)从细胞和外泌体中提取总RNA,并说明书使用逆转录试剂盒(Toyobo 公司,fsq-101)合成互补DNA。使用SYBR Green PCR Master Mix(北京索莱宝科技有限公司,SR1110)进行RT-PCR。表达数据统一标准化为内参GAPDH 或U6,并使用2-ΔΔCt方法评估相对表达水平。BCL2L2、GAPDH、miR-15a-5p 和U6的引物购自广州安尔诺生物科技有限公司。研究涉及的引物序列如下:miR-15a-RT:GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTG -CACTGGATACGACCACAAAC,miR-15a-F:ATCCAGTGCGTGTCGTG,miR-15a-R :TGCTTAGCAGCACATAATG ,BCL2L2-F :GGTGGGACAAGTGCAGGATT,BCL2L2-R:TCTGTTCCGTGACCATCCAG,U6-RT:GTCGTATCCAGTGCAGGGTCCGAGGTGCACTGGATACGA -CAAAATATGG,U6-F:TGCGGGTGCTCGCTTCGGCAGC,U6-R:CCAGTGCAGGGTCCGAGGT,GAPDH-F :GGTTGTCTCCTGCGACTTCA ,GAPDH-R :CCCTAGGCCCCTCCTGTTAT 。
1.6 Western blot 检测
细胞在含有完全蛋白酶和磷酸酶的RIPA 裂解缓 冲 液 中 裂 解(MedChemExpress 公 司 ,HY-K1001)。 每 个 样 品 装 载30 μg 蛋 白 质 到SDS-PAGE 凝胶,然后转移到0.22 μm PVDF 膜上。封闭膜然后在4 ℃下与一级抗体孵育过夜,之后在室温下与HRP 结合的二级抗体孵育。最后用Thermo-Pierce 化学发光(ECL)(Thermo,34577)进行发光,使用全自动化学发光成像分析系统(上海天能科技有限公司,Tanon 5200)进行观察与拍照。实验中使用的主要抗体为BCL2L2 多克隆抗体(16026-1-AP)和GAPDH 单克隆抗体(60004-1-Ig)购自武汉三鹰生物技术有限公司。
1.7 CCK8 检测细胞活力
细胞分别处理后,将每个孔5×103个细胞放入96 孔板中,每个处理组使用三个孔进行重复。分别在处理后1、2、3、4、5 d 用CCK-8 试剂盒(全式金,FC101-03)检测细胞活力。将10 μL CCK-8 试剂与细胞混合2 h。使用分光光度计(日本岛津公司,UV-1900)在每个孔中评估450 nm 处的最终吸光度。
1.8 流式检测细胞凋亡
培养48 h 后,收集所有处理后细胞,应用Annexin V- FITC 凋亡检测试剂盒(武汉伊莱瑞特生物科技股份有限公司,E-CK-A211)测量凋亡率。收获的细胞进行离心,并在冰冷的PBS 缓冲液(购自爱必信(上海)生物科技有限公司,abs961)中清洗。随后,细胞在加入Annexin V-FITC(5 μL)和碘化丙啶溶液(5 μL)的结合缓冲液(100 μL)中制备成悬液,在黑暗中孵育15 min。在流式细胞仪(美国BD公司,FACSAria)上测定凋亡比例。
1.9 双荧光素酶实验
采 用Targetscan 数 据 库 (http://www.targetscan.org/)预 测miR-15a-5p 与BCL2L2 结 合 位点,合成BCL2L2 3'UTR 野生型与突变型序列,构建到荧光素酶质粒载体中,分别与miR-15a-5p mimic、海肾质粒共同转染293T 细胞,采用酶标仪(上海闪谱生物科技有限公司,ReadMax 1200)检测萤火虫荧光、海肾荧光表达。
1.10 统计分析
使用Shapiro-Wilk 检验法检验数据的正态分布。正态分布数据以平均值±标准差(±s)表示。两组之间的比较采用Student'st检验。通过单因素方差分析进行多组比较,然后使用GraphPad Prism 8 软件进行Tukey's 多重比较测试与作图。P<0.05的值被认为具有统计学意义。
2 结果
2.1 miR-15a-5p 在炎症状态中性粒细胞的外泌体中显著高表达
脂多糖(LPS)与对照磷酸盐缓冲溶液(PBS)分别处理中性粒细胞后,ELISA 结果显示,LPS 处理组(LPS 组)中炎症因子IL-2、IL-6、IL-10 与TNF-α浓 度 分 别 为(190.66±6.94)、(66.61±2.46)、(18.80±0.88)、(180.73±3.00) pg/mL,显 著 高 于PBS 处理组(PBS 组)中炎症因子IL-2、IL-6、IL-10与TNF-α 浓 度,分 别 为(15.69±0.76) pg/mL(t=43.38,P<0.001)、(6.29±2.18) pg/mL(t=31.81,P<0.001)、(3.39±0.10) pg/mL(t=30.12,P<0.001)与(77.05±1.06) pg/mL(t=56.46,P<0.001),见图1A,提示,LPS 成功诱导中性粒细胞进入炎症状态。抽提炎症状态中性粒细胞上清外泌体,采用透射电镜观察,结果提示,可以观察到双层膜结构,中间凹陷,呈现“柿饼”形态的外泌体结构,见图1C,提示,我们分离外泌体的方法可行,可以成功分离得到外泌体。提取外泌体RNA,采用RT-PCR 检 测 外 泌 体 中miR-15a-5p 表 达,RT-PCR结果显示,LPS 处理组(LPS 组)中miR-15a-5p 相对表达为(3.23±0.20),显著高于PBS 处理组(PBS组)中miR-15a-5p 相对表达(0.97±0.06)(t=18.59,P<0.001),见图1B,提示,miR-15a-5p 在炎症状态中性粒细胞的外泌体中显著高表达。
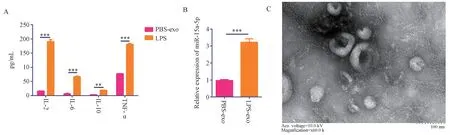
图1 miR-15a-5p 在炎症状态中性粒细胞的外泌体中显著高表达Fig 1 mir-15a-5p is significantly overexpressed in the exosomes of inflammatory neutrophils
2.2 炎症状态中性粒细胞的外泌体与miR-15a-5p促进raw267.4 巨噬细胞凋亡
流式凋亡检测结果提示,LPS 处理中性粒细胞后外泌体组(LPS-exo)凋亡率为(8.79±0.30)%,显著高于PBS 处理中性粒细胞后外泌体组(PBS-exo)凋 亡 率(4.53±0.11)%(t=23.25,P<0.001);miR-15a-5p mimic 转染组(miR-15a-5p mimic)凋亡率为(10.57±0.59)%,显著高于阴性对照转染组(NC)组 凋 亡 率(4.51±0.13)%(t=17.43,P<0.001),见图2A、图2B。

图2 炎症状态中性粒细胞的外泌体与miR-15a-5p 促进raw267.4 巨噬细胞凋亡Fig 2 Exosomes of inflammatory neutrophils and mir-15a-5p promote raw267.4 macrophage apoptosis
CCK8 结果提示,LPS 处理中性粒细胞后外泌体组(LPS-exo)细胞活力显著低于PBS 处理中性粒细胞后外泌体组(PBS-exo)(t=15.52,P<0.001);miR-15a-5p mimic 转染组(miR-15a-5p mimic)细胞活力显著低于阴性对照转染组(NC)组(t=10.28,P<0.001),见图2C。
2.3 数据库预测与双荧光素酶实验验证miR-15a-5p 靶向结合BCLCL2
通过Targetscan 数据库预测miR-15a-5p 靶基因,发现凋亡相关靶基因BCLCL2,miR-15a-5p 与BCLCL2 mRNA 的3'UTR 端具有结合位点,见图3A,根据结合位点,设计野生型与突变型BCLCL2 mRNA 的3'UTR 端序列,见图3A;双荧光素霉实验结果提示,BCL2L2 野生型与miR-15a-5p 共转染组(BCL2L2-WT+miR-15a-5p 组)中荧光素酶相对活性为(0.50±0.06),显著低于BCL2L2 野生型与miRNA 对照共转染组(BCL2L2-WT+miR-NC 组)中荧光素酶相对活性(1.00±0.06)(t=9.26,P<0.001);BCL2L2 突 变 型 与miR-15a-5p 共 转 染 组(BCL2L2-WT+miR-15a-5p 组)中荧光素酶相对活性为(0.50±0.06),相对BCL2L2 突变型与miRNA对照共转染组(BCL2L2-WT+miR-NC 组)中荧光素酶相对活性(1.00±0.06)无明显差异(t=0.83,P=0.45>0.05),见图3B。
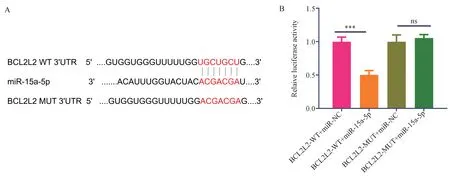
图3 数据库预测与双荧光素酶实验验证miR-15a-5p 靶向结合BCLCL2Fig 3 Database prediction and double-luciferase experiment to verify the targeted binding of mir-15a-5p to BCLCL2
2.4 miR-15a-5p 抑 制 raw267.4 巨 噬 细 胞 中BCLCL2 mRNA 与蛋白表达
RT-PCR 结果显示,miR-15a-5p 模拟物转染组(miR-15a-5p mimic)中miR-15a-5p 相 对 表 达 为(2.41±0.05),显著高于阴性对照组中miR-15a-5p相对表达(1.05±0.09)(t=22.33,P<0.001)。
miR-15a-5p 模拟物转染组(miR-15a-5p mimic)中BCLCL2 mRNA 相对表达为(0.40±0.04),显著低于阴性对照组中BCLCL2 mRNA 相对表达(0.99±0.03)(t=21.52,P<0.001),见图4A。
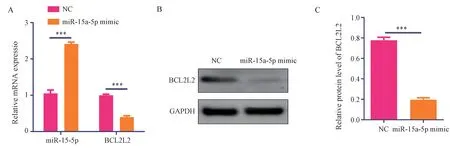
图4 miR-15a-5p 抑制raw267.4 巨噬细胞中BCLCL2 mRNA 与蛋白表达Fig 4 miR-15a-5p inhibits BCLCL2 mRNA and protein expression in raw267.4 macrophages
Western blot 结果显示,miR-15a-5p 模拟物转染组(miR-15a-5p mimic)中BCLCL2 蛋白相对表达为(0.40±0.04),显著低于阴性对照组中BCLCL2 蛋白相对表达(0.78±0.20)(t=29.47,P<0.001),见图4B、图4C。
3 讨论
在脓毒症的早期阶段,中性粒细胞被认为是导致宿主组织损伤的主要先天免疫细胞[14]。除了释放重要的细胞因子、趋化因子、ROS 外,中性粒细胞衍生的外泌体,可以作为中性粒细胞驱动的炎症和组织损伤的关键[15]。本研究结果表明,脂多糖LPS诱导中性粒细胞后,中性粒细胞释放炎症因子IL-2、IL-6、IL-10 与TNF-α 显著增加,同时中性粒细胞外泌体中miR-15a-5p 表达显著增加。脂多糖LPS 作为细胞炎症造模常用药物,处理细胞后可促进细胞炎症状态[16]。提示,炎症状态下的中性粒细胞,促进外泌体中miR-15a-5p 释放。这可能是中性粒细胞炎症状态下调控其他细胞或微环境的关键分子机制。
脓毒症是全球人类死亡的主要原因,其特点是对感染的过度炎症反应[17]。在脓毒性炎症反应期间,中性粒细胞和单核细胞在腹腔中被募集,后者分化为炎性巨噬细胞[18]。巨噬细胞是组织内的免疫细胞,在脓毒症肺损伤过程中,血小板活化因子引起肺血管和支气管收缩,全身血管舒张,毛细血管通透性增强以及巨噬细胞和中性粒细胞活化以产生更高浓度的炎症介质,进而引发脓毒症肺损伤[19,20]。中性粒细胞和巨噬细胞之间通过外泌体的相互作用被认为是调节创伤后炎症、失血性休克和脂多糖血症以及其他病理状况的重要因素[21,22]。例如,失血性休克激活的肺泡巨噬细胞释放的外泌体促进肺中性粒细胞坏死性凋亡[21];此外,中性粒细胞外泌体通过诱导巨噬细胞产生细胞因子来促进炎症和动脉粥样硬化的发展[22]。然而,在脓毒症中,中性粒细胞和巨噬细胞之间的相互作用在炎症发展中的作用及其潜在机制仍不清楚。本研究结果表明,炎症状态中性粒细胞可能通过外泌体介导miR-15a-5p 传递,进而抑制巨噬细胞中BCL2L2 蛋白表达,促进巨噬细胞凋亡,这可能是炎症中性粒细胞调控巨噬细胞凋亡的关键机制。
微小RNA(miRNA),长度大约为22 个核苷酸,是一种非编码的单链RNA 分子,主要通过靶向结合mRNA 的3'UTR 端,抑制蛋白翻译发挥生物学功能[23]。已有研究发现,miR-15a-5p 可通过直接靶向神经母细胞瘤中的MYCN 抑制肿瘤进展[24]。miR-15a-5p 还可以调控巨核细胞GPVI 信号通路中多种蛋白的表达[25]。miR-15a-5p-XIST-CUL3 轴可以调控脓毒症诱导的急性肾损伤[26]。环形RNA circFADS2 通过抑制miR-15a-5p 的成熟抑制脂多糖诱导的肺细胞凋亡,从而促进脓毒症发展[27]。关于miR-15a-5p 与BCL2L2 的调控作用亦有部分报道,例 如,miR-15a 通 过 靶 向BCL2L2 和BCL2 诱 导HPV 阳性下咽鳞癌细胞凋亡[28];miR-15a 通过靶向BCL2L2 诱导非小细胞肺癌细胞凋亡和抑制转移[29];miR-15a 通过BCL2L2 等靶基因抑制黑色素瘤细胞的侵袭性[30]。均提示miR-15a-5p 具有促进凋亡功能,且能与BCL2L2 结合,但miR-15a-5p 通过中性粒细胞外泌体调控巨噬细胞BCL2L2 未见相关报道。本研究结果中发现miR-15a-5p 能靶向结合BCL2L2 3'UTR 端,抑 制BCL2L2 mRNA 与 蛋白表达,进而促进raw267.4 巨噬细胞凋亡,与文献报道一致。
当然研究也有不足之处,首先,研究缺乏临床脓毒症与正常对照样本的论证;其次,研究未能进行动物体内水平的探讨;此外,未能进行miR-15a-5p 与BCL2L2 共同干预以及中性粒细胞与巨噬细胞共培养的实验验证。
本研究表明,脂多糖LPS 诱导的炎症状态中性粒细胞,可能通过分泌包含miR-15a-5p 的外泌体,靶向结合BCL2L2 3'UTR 端,抑制BCL2L2 mRNA 与蛋白表达,进而促进raw267.4 巨噬细胞凋亡。这可能为进一步理解中性粒细胞与巨噬细胞炎症调控分子机制提供理论依据。
作者贡献度说明:
柯桥:实验与写稿;胡龙辉:ELISA 检测RT-PCR 与WB检测;阮楚峻:增殖凋亡检测;黎敏:统计分析,文章审核。
所有作者声明不存在利益冲突关系。

