喹唑啉衍生物(N111)体外抗卵巢癌的作用及机制研究
李 艳,黄 强,黄银久,刘 刚,刘 健
(1.蚌埠医学院第一附属医院妇瘤科,安徽 蚌埠 233099;2.蚌埠医学院生命科学学院,安徽 蚌埠233030;3.鲁东大学化学与材料科学学院,山东 烟台 264025)
卵巢癌(OC),妇科癌症最常见死亡原因之一[1,2]。使用抗肿瘤药物可诱导癌细胞应激促进肿瘤细胞凋亡,也可诱导细胞产生过量的活性氧,引发氧化应激,最终导致机体严重受损,因此,抗氧化剂的抗癌应用值得深入研究[3]。
喹唑啉,应用最为广泛的含氮杂环化合物,研发具有喹唑啉药效团的化合物已普遍用于肿瘤的治疗[4-7]。在药物研发中,常将金属元素掺入生物活性配体,增加了配体的生物活性,也增强了非活性配体的药理潜力[8,9]。硒是一种天然存在的微量非金属元素,具有抗病毒性、抗氧化性,研究证实硒可用于预防和治疗多种疾病和肿瘤[10,11]。研究表明,硒化合物可通过抑制磷脂酰肌醇-5-磷酸酶(SHIP2)增强胰岛素敏感性及防止炎症和氧化应激[12],含有硒与喹唑啉药效团的化合物通过PI3K/AKT 信号通路诱导细胞凋亡,抑制细胞自噬[13]。连接喹唑啉衍生物与酚类衍生物的药效团,由于效应相加,使得最终化合物具有强抗氧化性[14]。但尚未发现相关含硒类喹唑啉衍生物在卵巢癌的研究。
因此,本研究基于两种具有抗癌特性成分,合成一种新的含硒类喹唑啉衍生物,通过MTT 筛选,N111 具有显著的抗肿瘤特性,通过生物信息学将N111 抗卵巢癌靶点的功能分析结果与N111 的体外抗肿瘤作用和机制进行验证及预测,进一步探索了N111 对卵巢癌的抗肿瘤作用机制。
1 实验材料
实验室合成2-乙氧基-4-乙硒基喹唑啉(N111),属于含硒喹唑啉类化合物、有机硒类化合物(附件1)。使用二甲基亚砜(DMSO)配制成40 mmol/L储存原液。细胞源于实验室。周期、凋亡、活性氧(ROS)检测试剂盒购买于碧云天生物技术公司、抗体:β-肌动蛋白(β-Actin)、凋亡蛋白(Bax)、抗凋亡蛋白(Bcl2)、胱天蛋白酶3(Caspase-3 、Cleaved Caspase-3)购买于武汉三鹰生物技术公司,蛋白激酶B(AKT)、SHIP2 购买于爱博泰克生物公司。所有其他化学试剂均为分析试剂级。人卵巢癌细胞株A2780、HEY、ES-2 和人正常卵巢上皮细胞IOSE80均源于本实验室师姐和同学的友情赞助。
2 实验方法
2.1 药物结构、靶点获取
通过在线网站(http://www.swisstargetprediction.ch、https://www.genecards.org/、https://go.drugbank.com/、https://omim.org/)[15],分析所选化合物结构式,根据化合物结构预测药物治疗靶点信息。
2.2 分子对接
准备小分子配体及大分子受体的3D 格式,使用AutoDock Tools 1.5.7 软件转化PDBQT 格式,建立受体蛋白活性口袋。Perl 脚本进行分子对接分析。利用PyMOL2.5.1 软件呈现靶蛋白与化合物虚拟对接模型。
2.3 细胞培养与传代
按照完全培养基的配制比例需求(基本培养基∶血清=9∶1),配制新鲜RPMI-1640 完全培养基。在37 ℃和5% CO2湿润环境的保温箱中,使用含10%胎牛血清(FBS)、青-链霉素的培养液(1640)培养细胞。日常观察细胞生长状态和细胞密度是否可以进行细胞传代,密度是否达75%~80%,一般约2~3 d 进行一次换液或传代操作。
2.4 形态学观察法
将细胞以4×103/孔的密度接种于96 孔板,于保温箱中常规培养。次日,配制药物浓度为(0、5、10、20、40 μmol/L)的工作液,与所选化合物以不同浓度孵育24 h,倒置显微镜下观察细胞形态学变化。
2.5 四甲基偶氮唑蓝(MTT)比色法
将细胞以4×103/孔的密度接种于96 孔板,于保温箱中常规培养。次日,用适量完全培养基进行化合物的浓度调节,配制药物浓度为(0、5、10、15、20、25、30、35、40 μmol/L)的工作液,与所选化合物以不同浓度孵育24 h,每组设置3 个副孔,于保温箱中 常 规 培 养。24 h 后,每 孔 加 入10 μL MTT 工 作液,于保温箱中孵育4 h。4 h 后,使用DMSO(100 μL/孔)溶解甲臜,酶联免疫检测仪(570 nm)测量光密度值。
2.6 细胞周期分析
细胞接种在6 孔板中,于保温箱中常规培养。次日,与所选化合物以不同浓度(0、5、10、20 μmol/L)孵育24 h。24 h 后,胰酶收集细胞,使用预冷的75%乙醇重悬细胞,4 ℃储存过夜。次日,根据试剂盒说明书,配制PI 染色工作液,温育30 min,流式细胞仪上机检测。
2.7 细胞内活性氧(ROS)的检测
细胞接种在6 孔板中,于保温箱中常规培养。次日,与所选化合物以不同浓度(0、5、10、20 μmol/L)孵育24 h。根据试剂盒说明书,配制染色工作液,孵育30 min,流式细胞仪检测。
2.8 DAPI 染色
细胞接种在6 孔板中,于保温箱中常规培养。次日,与所选化合物以不同浓度(0、5、10、20 μmol/L)孵育24 h。24 h 后取出板,PBS 清洗两次,室温下使 用200 μL4% 多 聚 甲 醛 固 定30 min,200 μL 0.1%TritonX-100/PBS 通 透30 min,DAPI 染 色5 min,适量PBS 润洗细胞,在荧光显微镜下拍照。
2.9 线粒体膜电位的测定
细胞接种在6 孔板中,于保温箱中常规培养。次日,与所选化合物以不同浓度(0、5、10、20 μmol/L)孵育24 h。收集细胞,根据试剂盒说明书,配制JC-1 染色工作液,温育20 min,流式细胞仪检测及倒置显微镜下拍照。
2.10 细胞凋亡检测
细胞接种在6 孔板中,于保温箱中常规培养。次日,与所选化合物以不同浓度(0、5、10、20 μmol/L)孵育24 h。根据试剂盒说明书,配制染色工作液,孵育30 min,流式细胞仪检测。
2.11 划痕实验
细胞接种在6 孔板中,于保温箱中常规培养。次日,与所选化合物以不同浓度(0、5、10、20 μmol/L)孵育24 h,次日,用200 μL 的黄色枪头垂直刮出划痕,PBS 清洗细胞碎片,立即于倒置显微镜下观察拍照记录(此时为0 h 划痕面积),记录结束,放回保温箱中继续常规培养24 h。24 h 后取出板,PBS清洗两次,加入适量低血清培养基,立即于倒置显微镜下观察拍照(此时为24 h 划痕面积),利用 Image J 计算划痕面积值。24 h 迁移率(%)=[(0 h 划痕面积-24 h 划痕面积)/0 h 划痕面积]×100%。
2.12 集落形成试验
细胞接种在6 孔板(500 个/孔)中,于保温箱中常规培养。次日,与所选化合物以不同浓度(0、5、10、20 μmol/L)孵育2 d。2 d 后更换新鲜完全培养基继续常规培养,观察细胞团的大小或等常规培养14 d 后,PBS 清洗两次,甲醇固定20 min,0.1%结晶紫染色30 min,手机拍照,Image J 计算。
2.13 Western blot 检 测Bax、Bcl2、Caspase 3、Cleaved Caspase-3、AKT、P-AKT、SHIP2
细胞接种在6 孔板中,与所选化合物以不同浓度孵育24 h。RIPA 裂解缓冲液冰冻裂解细胞30 min,12 000 r/min 离心15 min。收集上清液,BCA法测定蛋白质浓度。12.5%的SDS-聚丙烯酰胺凝胶上分离蛋白质(30 μg/孔),转移到0.45 μm 聚偏氟乙烯膜上。室温下用5%脱脂牛奶[使用含0.1%吐温的Tris-Buffed 生理盐水(TBS)配制]封闭膜2 h,4 ℃冰箱里一抗孵育过夜。室温下与二抗孵育2 h,用增强型化学发光检测试剂盒测量信号,并用ChemiDocTM 成像系统进行可视化。以抗β-Actin作为内参对照。
2.14 统计学处理
采用GraphPad Prism 5 软件分析数据,计量资料的两组间分析采用t检验、3 组或4 组分析采用方差分析,按照P<0.05 判断差异有统计学意义。
3 结果
3.1 N111 靶点及卵巢癌治疗靶点功能分析
根据N111 化学结构式,使用swisstargetprediction 在线网站展示N111 的药物结构式(图1 A),并通过SwissTargetPrediction 数据库获取预测N111抗卵巢癌的前100 位靶点蛋白。Vene 图分析genecard、DrugBank 和OMIM 数 据 库 共 获 取7 991 个 卵巢癌的治疗靶点(图1 B)。Vene 图获取卵巢癌的7 991 个治疗靶点与N111 预测抗卵巢癌治疗靶点的共同71 个靶点蛋白(图1 C)。对71 个共同靶点蛋白进行GO 功能分析,结果表明靶点蛋白主要富集于缺氧反应、血管生成、膜结构、信号通路蛋白激活等(图1 D),生物功能KEGG 集中富集于人类疾病、炎症、肿瘤等方面(图1 E)。
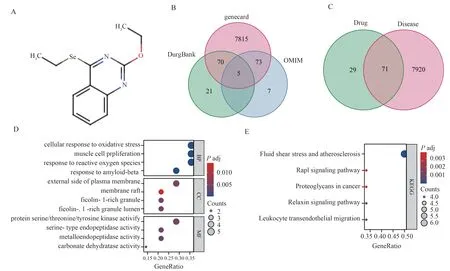
图1 N111 靶点及卵巢癌治疗靶点功能分析Fig 1 Functional analysis of N111 target and ovarian cancer treatment target
3.2 分子对接
将SHIP2、PI3KCA、AKT1 分 别 与N111 进 行分子模拟对接,选择分子对接能量依次为-4.2、-6.1、-4.3 (kcal/mol)模型进行展示(图2)。

图2 受体蛋白SHIP2、PIK3CA、AKT1 分别与配体N111 进行分子模拟对接Fig 2 Molecular simulation docking of receptor proteins SHIP2, PIK3CA and AKT1 with ligand N111
3.3 N111 抑制卵巢癌细胞的生长和增殖
经不同浓度N111 作用24 h 后,细胞形态学观察中,N111 浓度依赖性诱导细胞变形、萎缩及破裂(图3 A)。以顺铂(DDP)作为阳性对照,结果显示,N111 具有浓度依赖性抑制细胞增殖(IC50=14.62 μmol/L)(P<0.000 1)(图3 B,表1)。通过流式分析细胞周期,N111 处理A2780 细胞后,G1 期细胞占比从对照组(66.9±0.86)%减少到实验组5 μmol/L(55.93±1.36)% 、10 μmol/L(37.43±0.86)% 、20 μmol/L(21.50±0.80)%;S 期细胞占比 从对照组(15.47±0.38)%增加到实验组5 μmol/L(21.83±1.15)% 、10 μmol/L(42.10±0.65)% 、20 μmol/L(58.03±1.03)%(P<0.000 1)(图3 C、D,表2)。
表1 N111 对卵巢癌细胞A2780 细胞毒性作用(n=3,±s)Tab 1 Toxic effects of N111 on ovarian cancer cell line A2780 (n=3,±s)
N111 浓度(μmol/L)IOSE80 0.29±0.01 0.28±0.01*0.26±0.00**0.26±0.00****0.24±0.01****0.22±0.01****0.21±0.00****0.2±0.00****0.19±0.00****0.16±0.00****79.21<0.000 1 A2780 0.29±0.01 0.28±0.01*0.26±0.01****0.26±0.00****0.24±0.00****0.22±0.01****0.19±0.00****0.18±0.00****0.17±0.00****0.16±0.00****197.7<0.000 1 DDP 浓度(μmol/L)IOSE802 0.26±0.00****0.24±0.00****0.23±0.00****0.23±0.00****0.22±0.00****0.22±0.00****0.2±0.00****0.17±0.00****0.13±0.00****0.12±0.00****820.5<0.000 1 0 2 5 1 0 15 20 25 30 35 40 FP 0 2 5 1 0 15 20 25 30 35 40 A27803 0.35±0.01 0.34±0.00 0.30±0.00***0.26±0.02****0.25±0.01****0.22±0.01****0.21±0.00****0.18±0.01****0.16±0.00****0.15±0.01****102.1<0.000 1
表2 N111 诱导A2780 细胞周期阻滞(n=3,±s)Tab 2 N111 induced A2780 cell cycle arrest(n=3,±s)
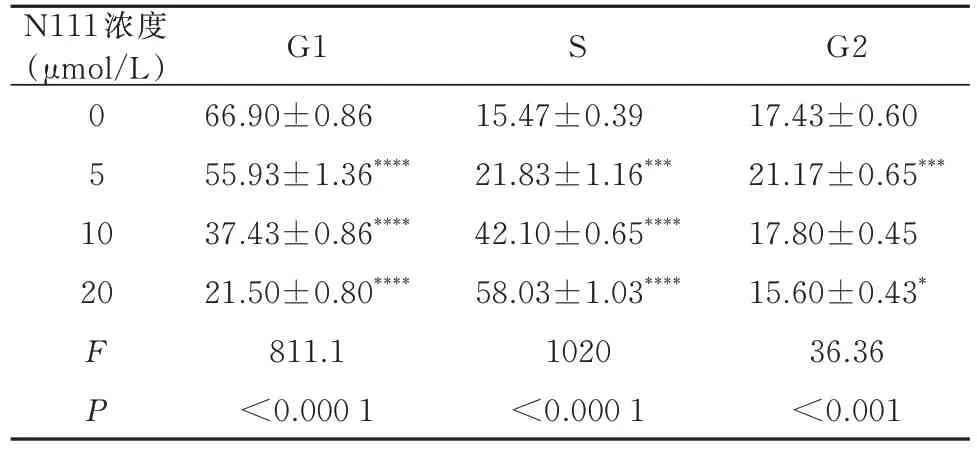
表2 N111 诱导A2780 细胞周期阻滞(n=3,±s)Tab 2 N111 induced A2780 cell cycle arrest(n=3,±s)
S N111 浓度(μmol/L)0 5 1 0 20 FP G1 66.90±0.86 55.93±1.36****37.43±0.86****21.50±0.80****811.1<0.000 1 15.47±0.39 21.83±1.16***42.10±0.65****58.03±1.03****1020<0.000 1 G2 17.43±0.60 21.17±0.65***17.80±0.45 15.60±0.43*36.36<0.001

图3 N111 抑制卵巢癌细胞的增殖Fig 3 N111 inhibits the proliferation of ovarian cancer cells
3.4 N111 的ROS 活 性 水 平
不同浓度的N111 作用24 h 后,细胞内ROS 水平显著降低,其中20 μmol/L 浓度组的荧光强度反而增高,这是由于药物浓度过大,N111 抗肿瘤作用增强,使细胞应激产生较多ROS,诱导细胞发生凋亡。平均荧光强度×103:对照组(302.95±15.84)、5 μmol/L(270.12±3.68)、10 μmol/L(159.92±2.05)、20 μmol/L(244.58±2.49)(P<0.000 1)(图4,表3)。
表3 N111 诱导卵巢癌细胞A2780 产生ROS(n=3,±s)Tab 3 N111 induces ROS production in ovarian cancer cell line A2780(n=3,±s)

表3 N111 诱导卵巢癌细胞A2780 产生ROS(n=3,±s)Tab 3 N111 induces ROS production in ovarian cancer cell line A2780(n=3,±s)
N111 浓度(μmol/L)(×103)0 5 1 0 20 F P xˉ±s 302.95±15.84 270.12±3.68*159.92±2.05****244.58±2.49***109.1<0.000 1

图4 N111 降低细胞内ROS 活性水平Fig 4 N111 reduces ROS activity in cells
3.5 N111 诱导卵巢癌细胞凋亡
不同浓度的N111 作用A2780 细胞24 h 后,细胞数目减少、细胞核固缩、破裂(图5 A)。细胞内JC-1 荧光探针的检测结果表明,N111 作用后,随着其浓度逐渐增加,细胞内红色荧光逐渐减弱,绿色荧光逐渐增强(图5 B)。流式细胞仪检测结果示:随着N111 浓度增加,可显著看到第二/三象限的细胞比例显著降低:对照组(10.69±0.77)、5 μmol/L(9.71±0.92)、10 μmol/L(5.38±0.16)、20 μmol/L(2.94±0.08)(P<0.000 1)(图5 C,表4)。流式细胞仪分析凋亡示:随着N111 浓度增加,细胞总凋亡率(第二、三象限细胞占比总和)显著增加,总凋亡率:对照组(12.07±0.56)、5 μmol/L(13.56±0.61)、10 μmol/L(18.48±0.61)、20 μmol/L(22.64±0.40)(P<0.000 1)(图5 D,表5)。
表4 N111 诱导卵巢癌细胞A2780 线粒体膜电位变化红绿荧光比值(n=3,±s)Tab 4 Red green fluorescence ratio of N111 induced changes in mitochondrial membrane potential of ovarian cancer cell A2780(n=3,±s)

表4 N111 诱导卵巢癌细胞A2780 线粒体膜电位变化红绿荧光比值(n=3,±s)Tab 4 Red green fluorescence ratio of N111 induced changes in mitochondrial membrane potential of ovarian cancer cell A2780(n=3,±s)
浓度0 5 1 0 20 FP细胞比例10.69±0.77 9.71±0.92 5.38±0.16****2.94±0.08****71.57<0.000 1
表5 N111 诱导卵巢癌细胞A2780 凋亡(n=3,±s)Tab 5 N111 induces apoptosis in ovarian cancer cell line A2780(n=3,±s)

表5 N111 诱导卵巢癌细胞A2780 凋亡(n=3,±s)Tab 5 N111 induces apoptosis in ovarian cancer cell line A2780(n=3,±s)
浓度0 5 1 0 20 FP凋亡率12.07±0.56 13.56±0.61 18.48±0.61****22.64±0.40****153.4<0.000 1
3.6 N111 抑制卵巢癌细胞迁移
将不同浓度N111 作用A2780 细胞24 h 后,N111 浓度依赖性显著抑制A2780 细胞的迁移能力,迁移率:对照组(13.87±1.22)、5 μmol/L(13.73±0.34)、10 μmol/L(11.03±0.24)、20 μmol/L(10.63±0.91)(P<0.000 1)(图6 A,表6)。N111 浓度依赖性显著抑制A2780 细胞的单克隆形成能力,克隆形成率:对照组(0.87±0.10)、5 μmol/L(0.64±0.03)、10 μmol/L(0.26±0.04)、20 μmol/L(0.06±0.01)(P<0.000 1)(图6 B,表7)。
表6 N111 抑制卵巢癌细胞A2780 迁移(n=3,±s)Tab 6 N111 inhibits the migration of ovarian cancer cell line A2780(n=3,±s)

表6 N111 抑制卵巢癌细胞A2780 迁移(n=3,±s)Tab 6 N111 inhibits the migration of ovarian cancer cell line A2780(n=3,±s)
浓度 迁移率0 5 1 0 20 FP 13.87±1.22 13.73±0.34 11.03±0.24*10.63±0.91**9.5 0.005 2
表7 N111 抑制卵巢癌细胞A2780 迁移(n=3,±s)Tab 7 N111 inhibits the migration of ovarian cancer cell line A2780(n=3,±s)
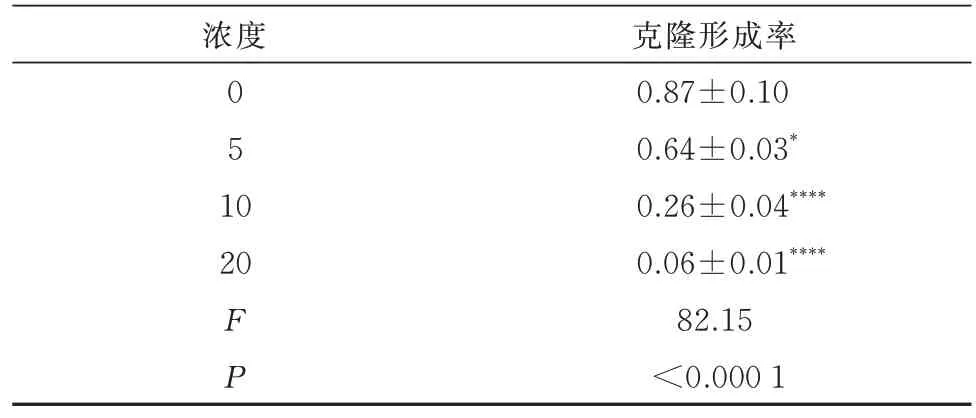
表7 N111 抑制卵巢癌细胞A2780 迁移(n=3,±s)Tab 7 N111 inhibits the migration of ovarian cancer cell line A2780(n=3,±s)
浓度0 51 0 20 FP克隆形成率0.87±0.10 0.64±0.03*0.26±0.04****0.06±0.01****82.15<0.000 1
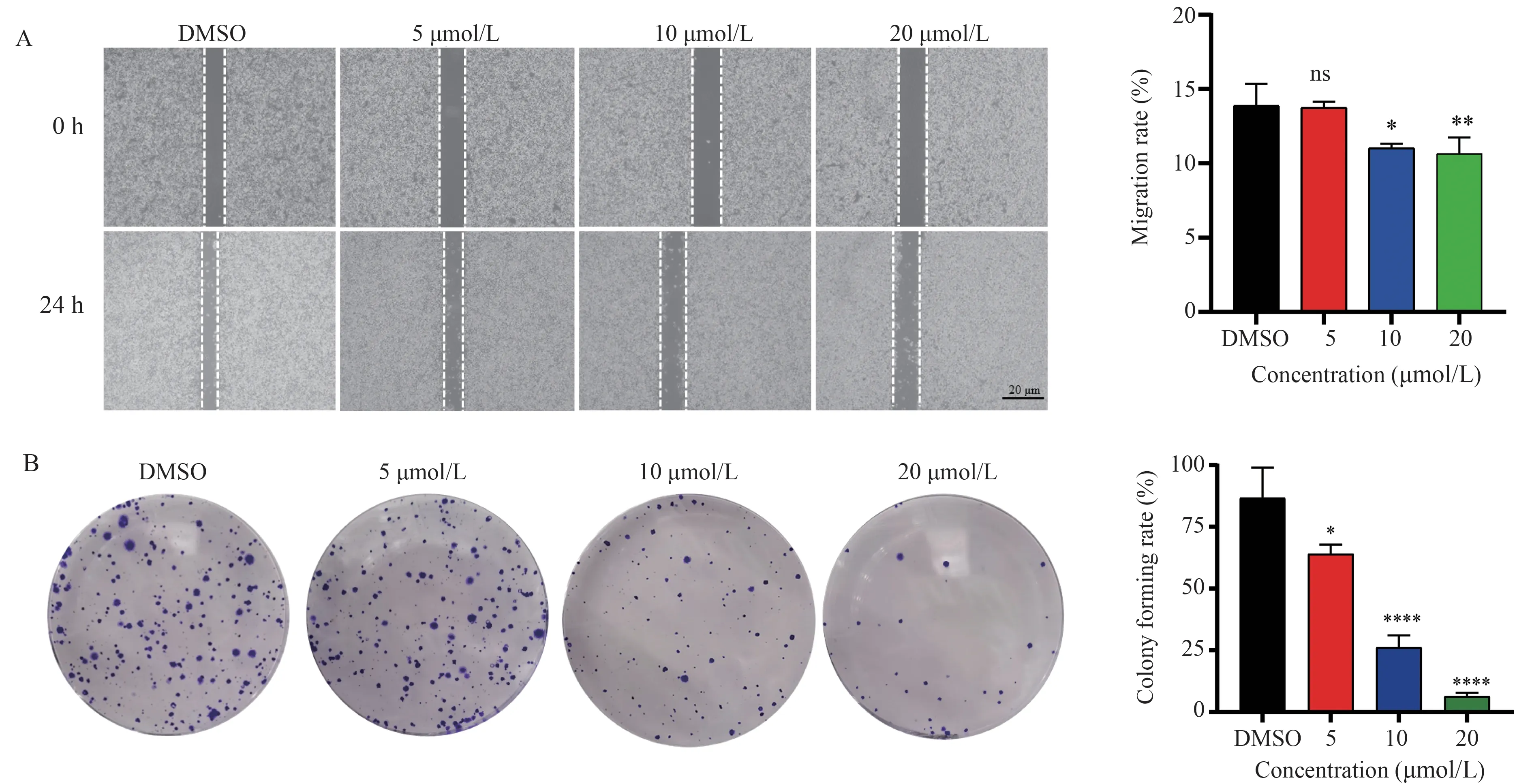
图6 N111 抑制卵巢癌A2780 细胞迁移及单克隆细胞团的形成Fig 6 N111 inhibits migration and monoclonal formation of ovarian cancer A2780 cells
3.7 N111 通过SHIP2/AKT 信号通路发挥抗卵巢癌作用
随着N111 处理A2780 卵巢癌细胞24 h 后,Bcl2、Caspase 3、P-AKT、SHIP2 的表达量逐渐降低,AKT 没有变化,Bax、Cleaved Caspase-3 表达量逐渐增加(图7,表8)。
表8 N111 处理卵巢癌细胞A2780 后蛋白表达变化(n=3,±s)Tab 8 Changes in protein expression of ovarian cancer cell A2780 after N111 treatment(n=3,±s)
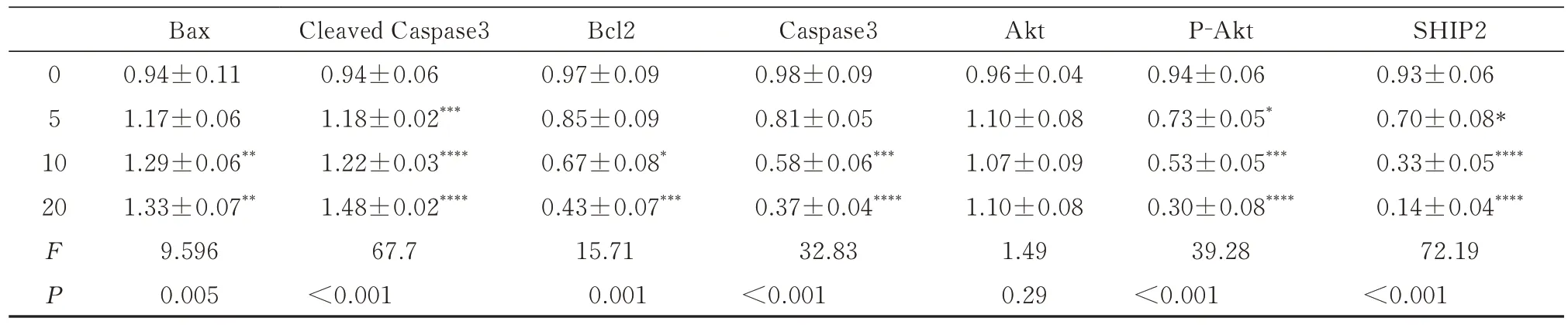
表8 N111 处理卵巢癌细胞A2780 后蛋白表达变化(n=3,±s)Tab 8 Changes in protein expression of ovarian cancer cell A2780 after N111 treatment(n=3,±s)
Bax 0.94±0.11 1.17±0.06 1.29±0.06**1.33±0.07**9.596 0.005 Cleaved Caspase3 0.94±0.06 1.18±0.02***1.22±0.03****1.48±0.02****67.7<0.001 Bcl2 0.97±0.09 0.85±0.09 0.67±0.08*0.43±0.07***15.71 0.001 0 5 1 0 20 FP Caspase3 0.98±0.09 0.81±0.05 0.58±0.06***0.37±0.04****32.83<0.001 Akt 0.96±0.04 1.10±0.08 1.07±0.09 1.10±0.08 1.49 0.29 P-Akt 0.94±0.06 0.73±0.05*0.53±0.05***0.30±0.08****39.28<0.001 SHIP2 0.93±0.06 0.70±0.08*0.33±0.05****0.14±0.04****72.19<0.001
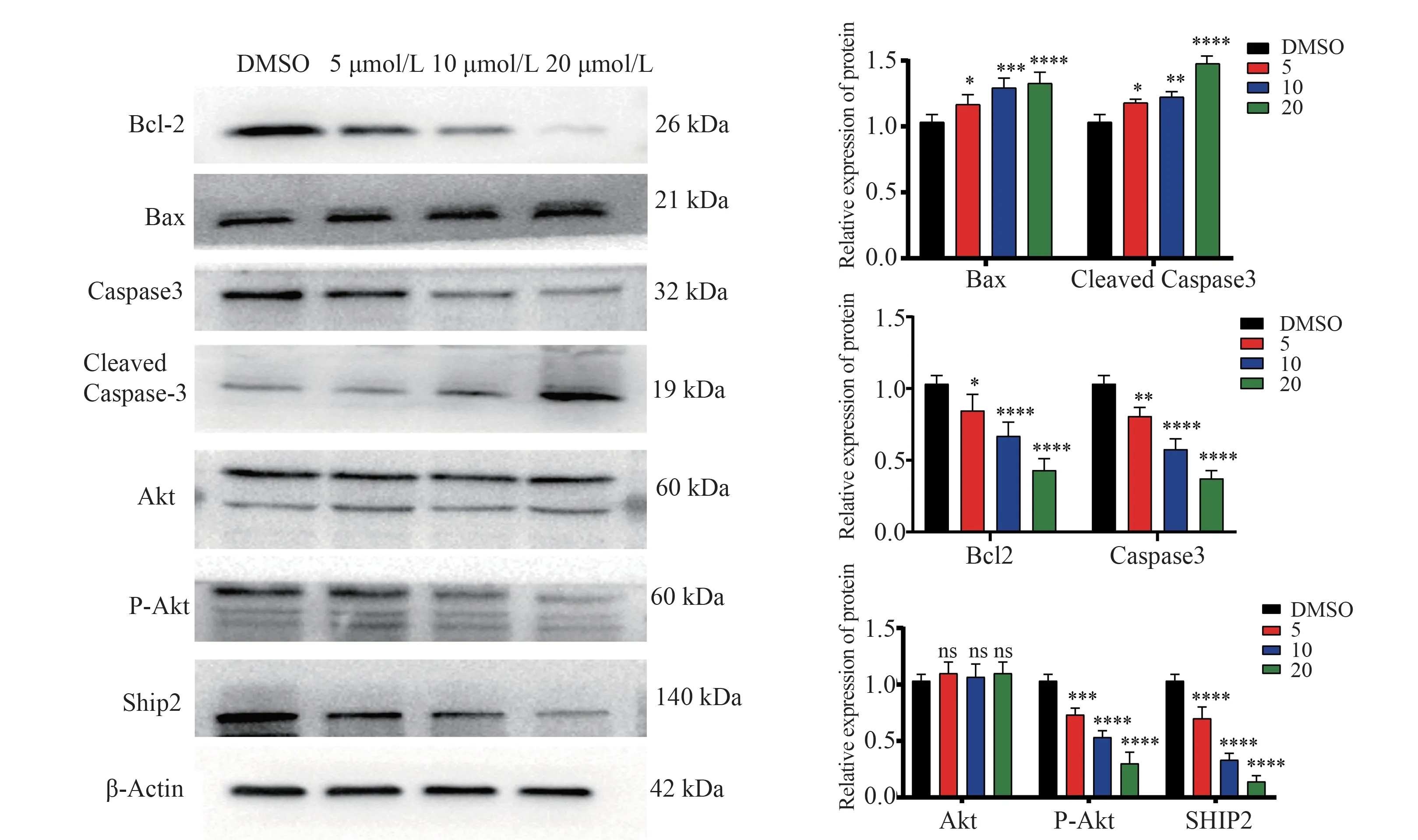
图7 N111 通过SHIP2/AKT 信号通路发挥抗卵巢癌作用Fig 7 N111 exerts anti ovarian cancer effect through SHIP2/AKT signal pathway
4 讨论
目前应用药效团杂交原理是设计和开发新药化合物的重要方法之一,杂化偶联物具有潜在的双重作用[16,17]。本研究将具有抗氧化作用结构(硒)和抗肿瘤作用药效团(喹唑啉)偶联,得到最终化合物N111,进一步研究N111 抗卵巢癌作用。
SHIP2 是有肌醇多磷酸磷酸酶样 1(INPPL1)基因编码蛋白,当PI3K 催化PI(4,5)P2 变为第二信使PI(3,4,5)P3 后,SHIP2 将其转化为PI(3,4)P2,PI(3,4)P2 与AKT 的PH 结 构 域 有 较 强 的 亲 和力[18,19]。以往研究认为SHIP2 通过降解PI(3,4,5)P3,从而抑制AKT 的激活发挥抑癌作用。如在胃癌的研究中,通过降低SHIP2 蛋白表达,激活PI3K-AKT 信号通路,促进细胞的增殖[20]。但目前大多数研究表明,SHIP2 可促进细胞迁移、侵袭,降低细胞黏附能力等作用[21],诱导结直肠癌细胞提高耐药性[22]。在ER 阴性乳腺癌的研究中,SHIP2 激活AKT 和JNK,上 调VIM,增 加 了 致 瘤 率[23]。SHIP2 的高表达,导致喉鳞状细胞癌患者的低无病生存期和总生存期[24]。其中,在喉鳞状细胞癌的研究中,下调SHIP2,抑制了AKT 信号通路的激活,从而抑制了细胞增殖,促进细胞周期阻滞和细胞凋亡,以及增强癌细胞对放射敏感性。其机制可能为SHIP2 的产物与AKT 具有较强亲和力,通过抑制SHIP2 导致AKT 部分活性降低和相应受体表达减少[25]。另一研究同样表明,若PI3K-AKT 信号通路被生长因子刺激,AKT 磷酸化增强,若被过氧化氢刺激,SHIP2 活性被 抑制,AKT 的磷酸化减弱[26]。与我们的观察结果一致,结直肠癌细胞中的SHIP2抑制降低了AKT 磷酸化[22]。与之相同的是,本研究中N111 通过下调SHIP2,AKT 磷酸化抑制,从而抑制细胞增殖,诱导周期阻滞和凋亡。
再者,通过数据库对N111 抗卵巢癌靶点进行生物功能分析,数据库分析结果与细胞学实验结果相同,这表明通过数据库对N111 的分析结果具有较强的可靠性。根据数据库对药物作用机制的预测,N111 发挥抗肿瘤机制与受体酪氨酸激酶信号通路和氧化应激信号通路相关。
综上,化合物N111 通过抑制SHIP2,促进ROS水平紊乱,减弱AKT 信号通路的激活,从而抑制肿瘤细胞A2780 的增殖、迁移和克隆形成等能力,诱导细胞凋亡。
作者贡献度说明:
李艳:负责实验操作,研究过程的实施、实验结果统计,起草论文; 黄强:参与实验操作,负责实验数据收集和统计学分析; 黄银久:负责设计论文框架,实验过程监督管理;刘刚:药物研发及药物分析、论文书写监督、修改; 刘健:负责拟定写作思路,指导撰写文章并最后定稿。
所有作者声明不存在利益冲突关系。

