细胞溶素HlyE变体对禽致病性大肠杆菌致病力的影响
文哲,王忠星,诸葛祥凯,戴建君
(南京农业大学动物医学院,江苏 南京 210095)
禽致病性大肠杆菌(avian pathogenicEscherichiacoli,APEC)是一种主要的禽细菌性病原,对养禽业造成严重的经济损失[1]。APEC属于肠道外致病性大肠杆菌(ExPEC),可以导致禽局部或多系统混合感染,如败血症、输卵管炎、肺炎、关节炎、腹膜炎、卵黄囊感染和呼吸道感染等[2]。APEC可以通过被污染的家畜产品传播给人,具有人畜共患的潜力[3]。人源ExPEC,如尿道致病性大肠杆菌(UPEC)和致新生儿脑膜炎大肠杆菌(NMEC),与APEC具有遗传相似性和相同的毒力基因[4]。因此深入探究APEC的致病性、耐药性和传播机制,对全球公共卫生安全具有至关重要的意义。
溶血素是致病性细菌中的一种主要毒力因子,在许多细菌中都有发现[5]。这些分子因为具有溶解红细胞的能力而被命名,但近年研究发现细菌溶血素还能损伤甚至致死多种有核细胞和血小板,如单核细胞、粒细胞、巨噬细胞、成纤维细胞、心肌细胞和内皮细胞等,故又称为细胞溶素(Cytolysin),其在参与细菌致病过程中发挥了重要作用[6]。HlyE(又称ClyA或SheA)最早在大肠杆菌K12中发现,属于孔道形成毒素,不属于RTX家族[5,7]。HlyE基因位于大肠杆菌染色体骨架上,因此在大肠杆菌中广泛分布。然而,由于HlyE基因的表达受到组蛋白样类核结构蛋白(H-NS)的抑制,它的溶血活性不能在标准血平板上观察得到[8]。但是,Murase等[9]发现在肠出血性大肠杆菌(EHEC)O55/O157菌株厌氧培养在含有5%脱纤维绵羊血平板上时HlyE具有溶血活性;Oscarsson等[5]发现HlyE能在红细胞上形成3.0~3.5 nm的微孔,但是用胆固醇预处理后的HlyE抑制了微孔的形成,表明HlyE能与胆固醇结合;Wai等[10]发现细菌的外膜囊泡(OMVs)中包含HlyE蛋白,HlyE在OMVs中形成低聚物孔集合体,通过OMVs转运到细胞内,从而对细胞产生毒性作用。Faucher等[11]在沙门菌中也发现了HlyE,它对上皮细胞具有毒性作用,感染肠道时能溶解上皮细胞,从而进入深层组织,且这种毒性作用是由操纵子PhoP调控的。
AlbrechtL等[12]发现仅部分致病性大肠杆菌携带功能性的HlyE基因,其余携带HlyE的突变体衍生物或非功能性HlyE片段。我们前期在APEC中发现有HlyE突变体(HlyE-V)基因,其突变体和本体相比氨基酸具有77%的同源性[13],功能未知。因此,本研究想探究在APEC中HlyE突变体的致病作用。
1 材料与方法
1.1 质粒、菌株及细胞
禽致病性大肠杆菌CBE59(血清型O145、序列型ST117、ECOR G群,对庆大霉素、氯霉素、氨苄西林等抗生素敏感)、质粒pKD46(氨苄西林抗性,Ampr)、pKD3(氯霉素抗性,Chlr)、pCP20(Ampr,Chlr)、pSTV28、禽源巨噬细胞(HD11),均由本实验室保存。
1.2 主要试剂和仪器
DMEM细胞培养液(美国,BD公司),小鼠抗CBE59全菌多抗(自制),5-异硫氰酸酯(FITC)标记山羊抗鼠二抗、鬼笔环肽(美国,AAT Bioquest公司),CCK8检测试剂(南京奇博能生物科技有限公司),Green Tap Mix(南京诺唯赞生物科技股份有限公司),胎牛血清(FBS)(美国,Gibco公司)。NanoDrop紫外可见分光光度计(美国,Thermo Fisher公司),电穿孔仪(美国,Bio-Rad公司),倒置荧光显微镜(德国,蔡司集团)。
1.3 HlyE缺失株、回补株的构建
参考Datsenko等[14]建立的Red两步同源重组法构建HlyE-V缺失株。首先将质粒pKD46电转入CBE59菌株中,通过氨苄平板筛选阳性菌株CBE59-pKD46,接着以氯霉素抗性pKD3质粒为模板,利用表1中含有HlyE-V基因上下游50 bp同源臂序列和pKD3 FRT上下游20 bp序列的HlyE-V-que-F、HlyE-V-que-R引物通过PCR扩增合成基因打靶片段,将PCR产物通过二次胶回收。在200 Ω、25 μF、1 800 V的条件下将打靶片段电转化入CBE59-pKD46的感受态细胞中,在30 ℃摇床培养2~3 h后取出,6 000 r/min离心5 min,弃去大部分上清液,重悬菌体沉淀,均匀涂布在具有Chlr抗性的LB琼脂平板,置于28 ℃培养箱过夜孵育,第2天挑取单菌落,用表2中引物HlyE-V-JD-F、HlyE-V-JD-R鉴定。再将筛选出来的阳性菌株以同样的方法电转化入pCP20质粒,37 ℃培养去掉Chlr抗性片段,最后42 ℃培养去除pCP20质粒。最后通过测序确认HlyE-V基因是否敲除成功,缺失后的菌株命名为CBE59ΔHlyE-V。将pSTV28-HlyE-V电转入CBE59ΔHlyE-V中构建回补株CBE59CΔHlyE-V。
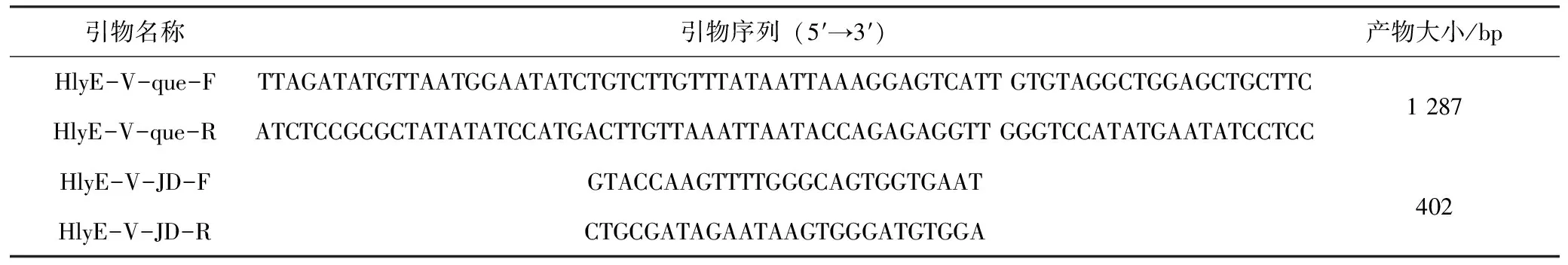
表1 HlyE-V缺失及鉴定引物

表2 菌株CBE59、CBE59ΔHlyE-V和CBE59CΔHlyE-V对雏鸡的LD50测定
1.4 生长曲线的测定
对野生株CBE59、缺失株CBE59ΔHlyE-V和回补株CBE59CΔHlyE-V的生长曲线进行测定。将上述3株菌在LB平板上划线,挑取单菌落转接于5 mL LB液体培养基中,37 ℃摇床过夜培养后将菌液离心(4 ℃,5 000g)10 min,弃上清液,用1×PBS溶液洗涤2次后,将菌液OD600值调整为1.0,按照1∶100重新转接于50 mL的锥形瓶中培养至平台期。期间每隔1 h测定其OD600值,进行3次平行试验,整理数据并用GraphPad Prism 7.0绘制生长曲线。
1.5 溶血活性测定
配制含有5%脱纤维绵羊血平板,将CBE59、CBE59ΔHlyE-V和CBE59CΔHlyE-V按1∶100的比例接种到1 mL LB液体培养基中,于37 ℃摇床震荡培养至对数期,用1×PBS洗涤2遍,将菌液OD600值稀释至0.8,取1.0 μL细菌悬浮液到血平板上,将平板置于37 ℃厌氧培养箱中孵育24 h,最后观察血平板上是否形成溶血环[15]。
1.6 动物试验
1.6.1 半数致死剂量(LD50)的测定
将7日龄雏鸡随机分为15组,每组10只。将CBE59、CBE59ΔHlyE-V和CBE59CΔHlyE-V于LB平板上划线,37 ℃培养过夜,挑选单菌落转接至LB液体培养基中,培养至对数期,将菌液离心,弃上清液收集菌体沉淀,用4 ℃预冷的1×PBS洗涤2遍,重悬沉淀,用1×PBS将菌株OD600值稀释为1.0后,进行10×倍比稀释至浓度为105~109CFU/mL。将稀释好的野生株CBE59攻毒雏鸡,每只0.1 mL,攻毒剂量分别为104、105、106、107、108CFU/只,缺失株和回补株处理方法同上。用菌感染7日内观察雏鸡的生长状况并记录死亡结果,采用软件SPSS计算LD50[16]。
1.6.2 组织切片制作与观察
采用颈椎脱臼法处死雏鸡,取感染雏鸡肺脏和肝脏,用10%的甲醛固定。常规制作病理切片,HE染色染色后封片观察。
1.7 胞内存活试验
取HD11细胞1×105CFU/mL加至24孔细胞培养板中。将CBE59、CBE59ΔHlyE-V和CBE59CΔHlyE-V培养至对数期,离心收集菌体沉淀并用PBS缓冲液洗3遍,用无血清DMEM重悬菌体沉淀,以感染比(MOI)为1∶100将菌液加入细胞培养孔,每株菌3组平行孔,1组对照(不加菌液)。300g离心5 min,沉淀细菌,将孔板置于细胞培养箱中孵育。在感染HD11细胞3 h后,将培养基吸去,用1×PBS缓冲液洗涤未黏附的细菌,在DMEM中按1∶1 000加入庆大霉素,并将抗性DMEM培养基用巴氏吸管均匀加入每孔中,放37 ℃的CO2细胞培养箱中孵育1 h后,在不同时间点(2、4、6、8、10、12、14和16 h)取出24孔板,将DMEM培养基吸去,用PBS缓冲液洗涤细胞3遍,然后每孔加入200 μL 0.1% Triton X-100裂解细胞,用PBS进行倍比稀释,取100 μL均匀涂布于LB平板上。37 ℃培养过夜后进行细菌计数。
1.8 免疫荧光标记试验
为了直观对比野生株CBE59、缺失株CBE59ΔHlyE-V和回补株CBE59CΔHlyE-V在HD11细胞内的存活能力,进行了免疫荧光标记试验。将HD11细胞均匀铺在细胞Dish中,待细胞贴壁,在 HD11细胞dish中以10∶1感染比(MOI)加入总量 5×108CFU的CBE59、CBE59ΔHlyE-V和CBE59CΔHlyE-V,在37 ℃ CO2培养箱孵育3 h后,弃掉培养液,用PBS清洗3遍,在DMEM中按1∶1 000加入浓度为100 mg/mL庆大霉素,将抗性DMEM各加1 mL到Dish中,放入细胞培养箱1 h,以杀死未黏附细胞的细菌。拿出Dish后,用真空泵吸去培养基,用PBS洗涤Dish 3遍,每次5 min。用4 ℃预冷的4%多聚甲醛固定细胞10 min后,用PBS洗3遍,每次5 min,再加入0.5%的Triton X-100通透细胞15 min,PBS洗3遍,每次5 min。用含5% BSA的PBS室温封闭30 min,弃液。用1%BSA按1∶500比例稀释小鼠抗CBE59全菌多抗,加入到每个Dish中,室温孵育 2 h,PBS洗涤3遍,1∶100的比例加入 2. 5% BSA 稀释的异硫氰酸荧光素 (FITC)标记的羊抗鼠二抗,同时1∶500加入鬼笔环肽,37 ℃避光孵育45 min后取出,按1∶100的比例加入DAPI,作用5 min后洗涤3遍。在荧光显微镜下观察(严格避光)。
1.9 CCK8细胞毒性试验
在96孔板中加入100 μL HD11细胞悬液,将培养板放入37 ℃ CO2培养箱培养24 h。然后向96孔板中加入10 μL野生株CBE59、缺失株CBE59ΔHlyE-V和回补株CBE59CΔHlyE-V菌液,每组3个平行,1个对照(不加菌液)。300 r/min水平离心5 min。将96孔板放入培养箱中孵育0.5、1.5、4、8、16、24后,向每孔加入10 μL CCK8,将培养板放在37 ℃ CO2培养箱孵育1~4 h,用酶标仪测定在波长450 nm处的吸光值。细胞存活率计算方法为:[(样品孔OD值-空白孔OD值)/(阴性孔OD值-空白孔OD值)]×100%。
1.10 数据处理与统计分析
所有试验均重复进行了3次,使用GraphPad Prism 7.00对数据进行绘图,数据用“平均值±标准差”表示,利用t检验比较了各菌株胞内存活、细胞毒性等试验数据的差异。P<0.05作为差异显著性判断标准。*表示P<0.05;**表示P<0.01;***表示P<0.001;****表示P<0.000 1。
2 结果
2.1 生长曲线的测定
为了验证HlyE-V基因缺失后是否影响了CBE59的生长,对野生株CBE59、缺失株CBE59ΔHlyE-V和回补株CBE59CΔHlyE-V进行了生长曲线测定,结果见图1。野生株和缺失株在平台期的OD600值相近,数值为2.5~3.0,回补株在平台期OD600值稍高,数值为3.0~3.5,表明缺失HlyE-V基因不影响CBE59的生长。

图1 CBE59、CBE59ΔHlyE-V、CBE59CΔHlyE-V在LB培养基中的生长速度
2.2 溶血活性
在无氧情况下检测了野生株CBE59、缺失株CBE59ΔHlyE-V和回补株CBE59CΔHlyE-V在脱纤维绵羊血平板上的溶血活性,3种菌株在血平板上都不能形成溶血环,表明HlyE-V不能产生溶血活动。
2.3 LD50测定和组织学观察
为了探究HlyE-V对APEC菌株CBE59毒力的影响,对野生株CBE59、缺失株CBE59ΔHlyE-V和回补株CBE59CΔHlyE-V的LD50进行了测定,结果见表2。在雏鸡模型中,野生株、缺失株、回补株的LD50值分别为8.2×105、4.9×106和4.2×105CFU/只,表明缺失HlyE-V后CBE59的毒力显著下降。
取野生株攻毒组、缺失株免疫组和PBS空白对照组雏鸡肺脏和肝脏制作组织切片,结果见图2。野生株和回补株感染组肺脏和肝脏存在明显病变,肺泡有出血、炎性细胞浸润,肺泡间隔变宽,肝细胞破碎、萎缩、消失;而缺失株感染组和PBS组无明显病变。表明缺失HlyE-V 后APEC的毒力显著下降。

图2 不同攻毒组雏鸡肺脏和肝脏病理切片(标尺=50 μm)
2.4 胞内存活试验
通过胞内存活试验鉴定缺失HlyE-V对CBE59在禽源巨噬细胞HD11内存活的影响。如图3所示,与野生株和回补株相比,感染后6~16 h,缺失株CBE59ΔHlyE-V的胞内存活率显著降低。免疫荧光试验观察如图4所示,在野生株CBE59感染的HD11中有一半的细胞中含有6~8个细菌,且从56.7%的细胞中观察到,含有超过6个细菌;而在观察缺失株CBE59ΔHlyE-V时,菌量超过6个的仅为10.7%,相较野生株下降了46%。如图5所示,在荧光显微镜下清楚观察到缺失株CBE59ΔHlyE-V在细胞内的数量普遍低于野生株CBE59;在回补株CBE59CΔHlyE-V中,细菌进入细胞中的数量与野生株相近。这些结果均表明HlyE-V对 APEC 在吞噬细胞内的存活起到十分重要的作用。

图3 细菌在巨噬细胞HD11内的存活能力
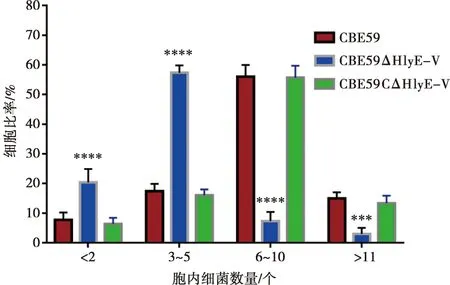
图4 胞内细菌数量统计

图5 免疫荧光标记观察细胞内的细菌
2.5 CCK8细胞毒性试验
通过Cell Counting Kit-8试剂检测细胞毒性,测得在450 nm的OD值并计算存活率,结果如图6所示。从图中可见,野生株和回补株组的细胞存活率随时间变化较明显,而缺失组变化较小。在感染24 h后,野生株感染的细胞存活率为42%,回补株感染细胞的存活率为35%,而缺失组的为70%,由此可见,缺失HlyE-V后CBE59对细胞的毒性显著下降。

图6 不同菌株对HD11细胞的毒性作用
3 讨论
APEC是危害养禽业的重要细菌性病原,主要通过呼吸道感染家禽,导致家禽的多系统混合感染,甚至引起禽急性死亡[17]。APEC还具有人畜共患潜力,可以导致人尿路感染、腹膜炎、血流感染等。由于APEC具有不同的血清型和复杂的毒力因子,目前还缺乏有效的疫苗防控APEC引起的疾病[18]。此外,由于抗生素的滥用,使得APEC呈现多重耐药的趋势,甚至多黏菌素耐药基因mcr-1在APEC分离株中被发现,这给全球的养殖业造成严重的威胁[19]。因此探究APEC的致病机制有利于有效疫苗的研发和细菌疾病的防控。
溶血素是致病性大肠杆菌中的一种主要毒力因子[20],HlyE属于膜成孔毒素(pore-forming toxin,PFT),PFT能在靶细胞膜上形成穿膜孔道,破坏细胞膜结构并使其渗透性增强而导致细胞渗透性溶解。除了损伤红细胞外,PET还能损伤免疫细胞、内皮细胞和上皮细胞,特别是肝细胞和内部组织器官[21]。根据蛋白质二级结构不同,PFT分为α-PFT和β-PFT,分别形成α-螺旋两亲性跨膜孔道和β-桶状跨膜结构,α-PFT可以产生体外溶血活动,β-PFT产生的溶血活动与细胞相关,HlyE属于α-PFT。HlyE可以溶解哺乳动物红细胞,对巨噬细胞具有细胞毒性和凋亡作用[22]。HlyE的表达也受到一些转录因子的调控,如H-NS可以抑制HlyE的转录,环腺苷酸受体蛋白(CRP)可以激活HlyE的表达。
Enow等[23]研究表明,HlyE结构上2个区域的突变,可以使HlyE的功能丧失,分别是启动子区域和N末端部分区域,这些突变体对动物的毒力减弱,对抗生素更加敏感。Nyunt等[24]发现在C-末端丢失了氨基酸残基的HlyE突变体的转运能力受损,不能转运到细胞外,只能留在胞内。C-末端对HlyE的转运、在膜上成孔很重要,因此HlyE突变体的溶血活动受到抑制。
为了研究APEC中新发现的HlyE-V对APEC致病力的影响,通过Red两步同源重组法构建HlyE-V缺失株,在缺失株中导入pSTV28-HlyE-V质粒构建回补株,首先对其生长曲线进行了测定,结果显示野生株和缺失株的生长速度相近,回补株在平台期的OD600值略高,这表明缺失HlyE-V基因对APEC的影响较小。溶血试验结果显示,野生株也无溶血现象,这可能与HlyE-V的结构有关。Ludwig等[25]通过定向位点突变研究了HlyE基因上不同结构的功能,结果发现HlyE N末端的两性分子螺旋αA1结构对溶血活动十分重要,突变体影响了C末端螺旋αG,在头部的β-tongue区域,或者在尾部的疏水区域,表明两性分子C-末端对孔道形成十分重要。
细胞试验表明,HlyE-V缺失株的胞内存活能力下降,对细胞毒性降低。在宿主体内 APEC 需要逃避宿主免疫系统的清除作用,只有在吞噬细胞内存活下来的细菌才能发挥毒性作用。动物试验结果表明,缺失HlyE-V基因对APEC的毒力有较大影响,与野生株相比,缺失株雏鸡的LD50降低了5倍左右,通过观察组织病理切片,可见野生株和回补株的组织器官具有明显病变,出现肝细胞核萎缩、慢性肝淤血、肝小叶中央静脉及其周围肝窦明显扩长,充满大量红细胞等,肺泡充血、有大量炎性细胞浸润等。这表明缺失HlyE-V基因后可以显著降低APEC菌株毒力。
综上,本研究证实HlyE-V是APEC的一个重要毒力因子,与HlyE不同的是,HlyE-V不能导致细胞溶血,但可以导致细胞毒性、 损伤、禽败血症等。至于HlyE-V蛋白在胞内的分泌机制以及对巨噬细胞信号途径的影响还需进一步研究。

