昆虫死亡素thanatin与斑点叉尾鮰β-防御素在毕赤酵母中的表达及其抑菌效果评价
何敬文,陈婷,赵微,扈立伟,任君,刘青,顾天越,包利霞,金天明
(1. 天津农学院/天津市农业动物繁育与健康养殖重点实验室 天津 300392;2. 天津市农业科学院,天津 300192)
抗生素曾广泛造福人类,但其滥用带来的一系列“细菌耐药性”、“超级耐药菌”、“DNA污染”等问题已造成人类公共卫生巨大威胁,加之我国减抗、禁抗政策的实施,寻求抗生素替代物的研究尤为迫切[1]。抗菌肽(antimicrobial peptides,AMPs)是生物抵御外界病原微生物而产生的一类7~60个氨基酸的小分子多肽类物质,具有广谱抗菌、抗病毒、抗肿瘤、抗寄生虫作用,又被称为“自然抗生素”[2]。抗菌肽通过与细菌的核酸、蛋白质或表面负电荷结合,破坏细菌的细胞膜、生物大分子或细胞壁的合成,因此不易产生耐药性,抗菌肽替抗已成研究热点[3-5]。
昆虫死亡素thanatin源自刺肩蝽(Podisusmaculiventris),共21个氨基酸,β反向折叠及二硫键结构发挥抑菌作用[6-7],生理浓度下即具有良好抑菌作用,但对金黄色葡萄球菌抗性较低,是迄今为止抗菌谱最广、抗菌活性最强的昆虫抗菌蛋白[8]。斑点叉尾鮰为低等脊椎动物,底栖鱼,栖息环境复杂,易遭受病原微生物的侵染,已有研究证明其β-防御素发挥了主要免疫作用,Zhu等[9]化学合成后发现其水溶液可抑制多种细菌生长。其C1-C5、C2-C4、C3-C6可形成二硫键,总体呈3股反相平行的片层结构,高度稳定,不易被蛋白酶降解,故可发挥持久抗菌作用[10]。
将不同抗菌肽基因融合表达或共表达是弥补单一抗菌肽抗菌谱或增强其抗菌效果的常用方式。融合表达易出现重组蛋白与原蛋白结构、功能不同的现象,如王伟东[11]表达了thanatin杂合肽,发现其抗菌效果较thanatin有很大下降。而共表达则更大程度上保证了原抗菌肽的功能,将不同目的基因间用2A剪切肽连接,转译时核糖体合成至2A肽时会将前半段已合成的肽链放出,造成“剪切”效果,即分别表达了2A肽两边的基因,使两端基因表达时互不影响,各自表达。在多顺反子中通常推荐使用P2A或T2A。
试验选定死亡素thanatin和斑点叉尾鮰β-防御素(defbl),将thanatin低浓度高抑菌活性与defbl长效广谱抗菌特性相结合,采用共表达方式,仅单次诱导即可获得2种抗菌肽,一同纯化,既方便操作,又可实现协同抑菌的目的,为后续对该抗菌肽的研究及应用奠定理论和试验基础。
1 材料与方法
1.1 菌株和质粒
大肠杆菌DH5α、毕赤酵母GS115、抑菌试验指示菌株如大肠杆菌K88、奇异变形杆菌ATCC 35659、肺炎克雷伯菌ATCC 700603、多杀性巴氏杆菌CIP 103826、金黄色葡萄球菌CMCC(B)26001、表皮葡萄球菌ATCC 12228、无乳链球菌ATCC 12386、停乳链球菌ATCC 2957等均由本实验室保存;pMD-thanatin、pMD-defbl、pMD-TD、pPICZɑA Vector(ZeocinTM)购自上海捷瑞有限公司。
1.2 主要工具酶和试剂
限制性核酸内切酶EcoRⅠ、SalⅠ、SacⅠ、T4 DNA连接酶、DNA ladder、10×Fast Digestion Buffer购自Thermo Fisher Scientific公司;Amp、Zeocin、GoldView I型核酸染色剂、Plasmid Mani Kit I试剂盒、BCA蛋白浓度测定试剂盒、无氨基酵母氮源(YNB)、生物素、山梨醇购自北京索莱宝科技有限公司;酵母基因组提取试剂盒、His标签纯化试剂盒、小鼠抗6×His单克隆抗体(一抗)、辣根过氧化物酶标记的羊抗鼠IgG(二抗)购自上海碧云天生物技术有限公司;YPD、BMGY、BMMY培养基参照Invitrogen公司毕赤酵母表达手册配制。
1.3 试验方法
1.3.1 基因合成
将The Antimicrobial Peptide Database中的thanatin序列(APD ID:AP00102)和NCBI中斑点叉尾鮰β-防御素基因标准序列(GenBank:KX211992.1)进行毕赤酵母偏好性密码子优化,同时利用T2A剪切肽(GGAAGCGGAGAGGGCAGAGGAAGTCTGCTAACATGCGGTGACGTCGAGGAGAATCCTGGACCT)连接上述基因获得共表达序列(命名为TD),序列两端添加EcoRⅠ、SalⅠ酶切位点、6×His标签、终止密码子后由上海捷瑞生物有限公司构建至pMD19-T载体上,获得pMD-thanatin、pMD-defbl、pMD-TD。
1.3.2 引物设计
根据目的基因序列和表达载体pPICZɑA设计特异性引物,由上海捷瑞生物工程有限公司合成(引物信息见表1)。

表1 引物序列
1.3.3 重组表达载体的构建
用EcoRⅠ、SalⅠ双酶切pMD-thanatin、pMD-defbl、pMD-TD和表达载体pPICZαA,回收并纯化,用T4 DNA连接酶将目的基因片段和载体于16 ℃连接过夜,构建重组质粒pPICZαA-thanatin、pPICZαA-defbl、pPICZαA-TD并转化DH5α感受态细胞,利用Zeocin筛选阳性菌株,进行PCR、双酶切等鉴定。
1.3.4 重组酵母工程菌株的获得
将重组表达载体质粒10 μg经SacⅠ线性化后,与80 μL毕赤酵母GS115感受态细胞均匀混合,于预冷的电转杯中冰浴5 min进行电击,电击条件为:1.5 kV、25 μF、200 Ω。电击后立即加入1 mL 1 mol/L预冷的山梨醇,28 ℃摇床培养1 h后,分别涂布于含1 000、500、300和100 μg/mL Zeocin的YPD平板上,培养2~4 d至单菌落长出,筛选高拷贝高耐受Zeocin转化子菌株,提取基因组,以通用引物3′AOX1/5′AOX1进行PCR鉴定,以pPICZɑA空载体质粒同上处理作为阴性对照,以线性化的重组质粒PCR产物为阳性对照。
1.3.5 重组蛋白的诱导表达
筛选到的阳性单克隆菌株接种于10 mL BMGY培养基中,28 ℃、250 r/min培养至OD600 nm值为3,以4 000 r/min离心5min后收集菌体重悬于100 mL新鲜的BMMY培养基中至OD600 nm值为1,利用1%甲醇进行诱导培养,每24 h补加甲醇至终浓度为1%,诱导72 h后收集培养基上清液,冻干浓缩纯化后进行Western blot检测及浓度测定,分析重组抗菌肽的表达情况。
1.3.6 重组蛋白的抑菌效果分析
制备浓度为105CFU/mL的各指示菌悬液,利用牛津杯法[12]分析各重组蛋白抑菌活性。每杯中加入200 μL浓度为200 μg/mL的各重组蛋白,以ddH2O和空载体组上清液做对照组,37 ℃培养过夜后测量其抑菌圈直径,试验重复3次。
通过二倍稀释培养法计算各重组蛋白抑菌率。96孔板各孔加入100 μL无菌LB培养基,取100 μL浓度为200 μg/mL的各重组蛋白,自第1孔倍比稀释到第6孔,前7孔加入10 μL菌悬液,第8孔只加液体培养基作为阴性对照,37 ℃孵育12 h,用酶标仪检测各孔OD600 nm值,试验重复3次,计算抑菌率[13]。
抑菌率=[(阳性OD值-试验组OD值)/(阳性OD值-阴性OD值)]×100%
1.3.7 重组蛋白的溶血性检验
利用2%兔红细胞悬液进行各重组抗菌肽的溶血性试验[14]。96孔板各孔加入100 μL无菌PBS缓冲溶液,每排第1孔加入100 μL浓度为300 μg/mL的各重组蛋白,倍比稀释至10号孔,11号孔加入10% Triton-X-100作为阳性对照,此时的红细胞溶解值为100%,12号孔为PBS阴性对照;每孔加入100 μL 2%兔红细胞悬液,37 ℃作用4 h,3 000 r/min离心10 min,测各孔上清液OD540 nm处的吸光值,试验重复3次,计算溶血率。
溶血率=[(试验组OD值-阴性OD值)/(阳性OD值-阴性OD值)]×100%。
2 结果与分析
2.1 重组表达载体的构建
重组表达载体转化DH5a感受态细胞,提取质粒进行PCR扩增,结果显示,经1.2%琼脂糖凝胶电泳检测,PCR扩增出75 bp的thanatin片段、213 bp的defbl片段和357 bp的TD片段,因TD片段为thanatin片段和defbl片段经T2A剪切肽连接的片段,所以片段长度大于thanatin片段和defbl片段之和,与预期大小相符(见图1);双酶切鉴定结果显示,通过1.2%琼脂糖凝胶电泳检测,重组表达载体经EcoRⅠ、SalⅠ双酶切后,在3 487 bp、357 bp、75 bp、214 bp处存在高亮条带,与预期相符(见图2);结合进一步测序结果表明,重组表达载体pPICZαA-thanatin、pPICZαA-defbl、pPICZαA-TD构建成功。

M.DL0501 Marker;1. pPICZαA-thanatin;2. pPICZαA-defbl;3. pPICZαA-TD

M.DL2502 DNA Marker;1. pPICZαA-thanatin;2. pPICZαA-defbl;3. pPICZαA-TD
2.2 重组酵母工程菌株的获得
重组表达载体质粒电转毕赤酵母GS115感受态细胞后,经1 mg/L的Zeocin抗性筛选获得阳性菌落,提取其基因组DNA,以3′AOX1/5′AOX1为引物进行PCR验证。结果显示,有阳性菌株在549、690、834、589 bp处存在条带,与预期大小相符(见图3)。
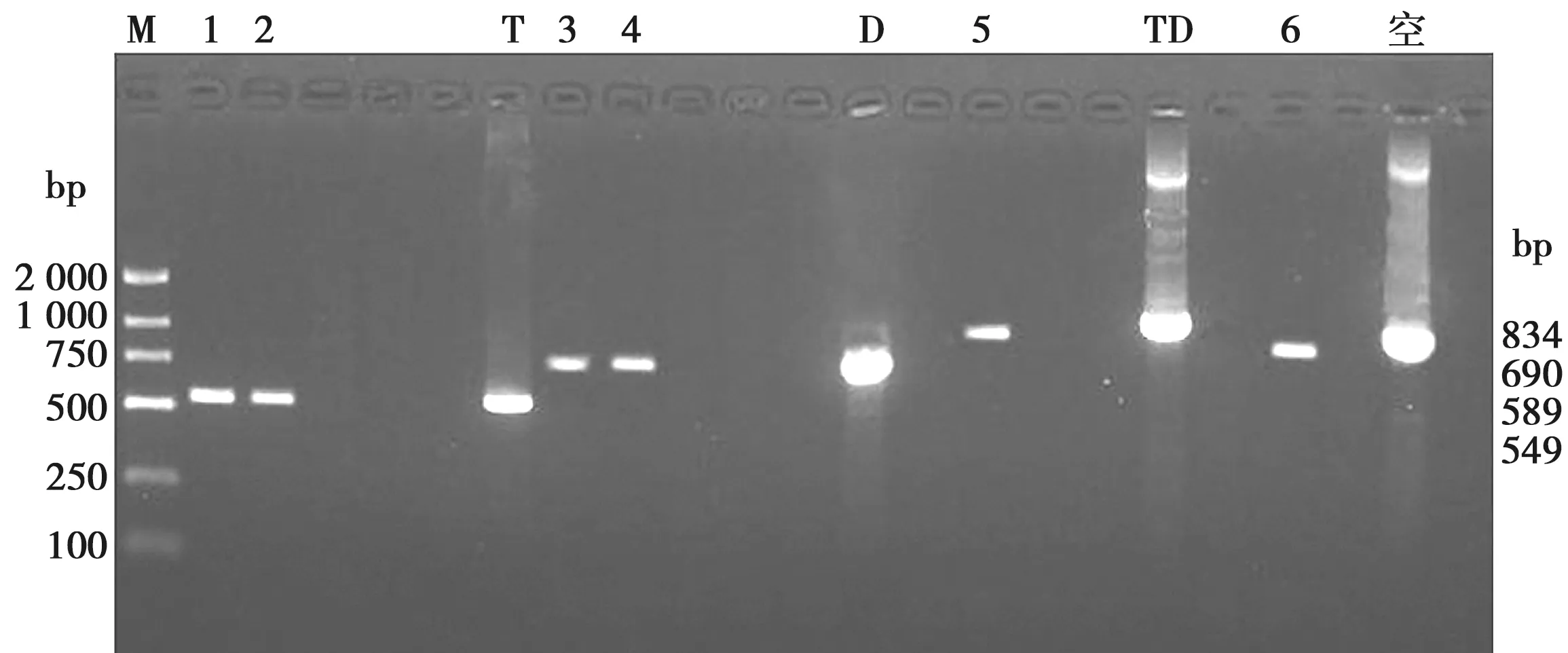
M.DL2501 Marker;1~2. GS115-pPICZɑA-thanatin;3~4. GS115-pPICZɑA-defbl;5. GS115-pPICZɑA-TD;6. GS115-pPICZɑA;T. pPICZɑA-thanatin;D. pPICZɑA-defbl;TD. pPICZɑA-TD;空. pPICZɑA质粒
2.3 重组蛋白的诱导表达
重组毕赤酵母工程菌株经1%甲醇诱导培养72 h后,收集培养基上清液,冻干浓缩、纯化后进行Western blot检测,结果显示,GS115-pPICZɑA-TD诱导培养基上清液在分子质量为2.3 kDa和7.8 kDa处存在与His-tag抗体特异性结合条带;GS115-pPICZαA-defbl诱导培养基上清液在分子质量为7.8 kDa 处存在与His-tag抗体特异性结合条带;GS115-pPICZαA-thanatin诱导培养基上清液在分子质量为2.3 kDa处存在与His-tag抗体特性结合条带;空载体组在2.3~7.8 kDa范围内无特异性结合His-tag抗体条带(见图4)。测定各组蛋白浓度分别为:thanatin 600 μg/mL,defbl 300 μg/mL,TD 700 μg/mL。
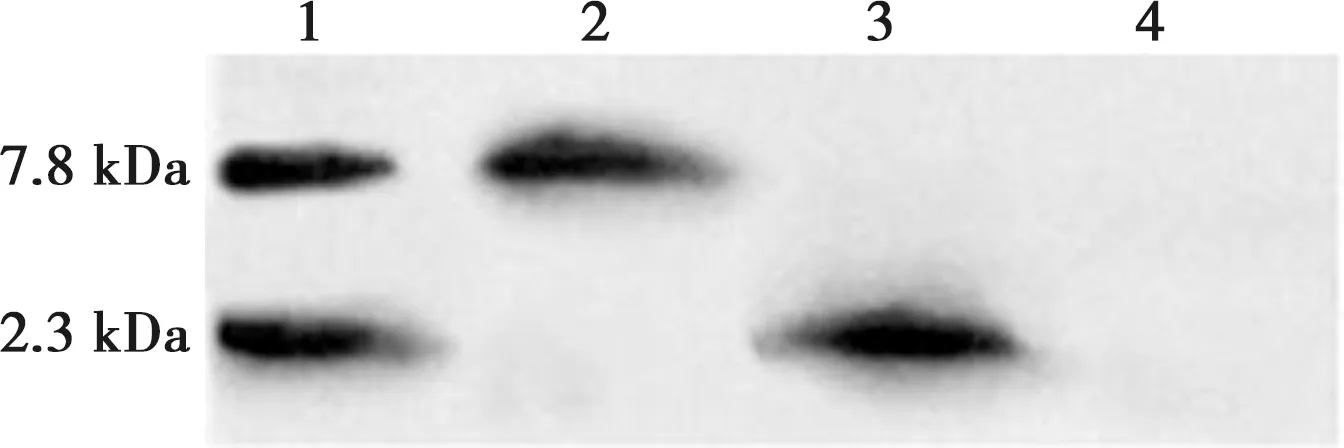
1. GS115-pPICZɑA-TD诱导培养基上清液;2. GS115-pPICZɑA-defbl诱导培养基上清液;3. GS115-pPICZɑA-thanatin诱导培养基上清液;4. pPICZɑA诱导培养基上清液
2.4 重组蛋白抑菌活性检测
牛津杯法分析各重组蛋白抑菌活性,结果显示,thanatin、defbl及TD组所表达蛋白对8种指示菌株均具有抑制作用,ddH2O和空载体组对指示菌无抑制效果(见表2)。

表2 目的蛋白对各菌株的抑菌效果(抑菌圈直径) mm
各重组蛋白二倍稀释法处理至终浓度为100、50、25、12.5、6.25和3.125 μg/mL后分别对各受试菌株作用12 h,计算抑菌率结果见图5~图7。试验各组表达的thanatin、defbl、TD蛋白对试验选用的8种指示菌株均具有抑菌作用。其中,thanatin组在蛋白浓度为25 μg/mL时,对各菌株的平均抑菌率在30%~70%之间,对金黄色葡萄球菌、无乳链球菌的抑菌率在50%左右;当蛋白浓度达到50 μg/mL时,对除无乳链球菌外的受试菌株的平均抑菌率均在95%以上,且抑菌率不随蛋白浓度的增加而增加;蛋白浓度超过50 μg/mL后,对金黄色葡萄球菌、停乳链球菌、奇异变形杆菌的抑菌率反而下降,但不低于90%;对于无乳链球菌,蛋白浓度为50 μg/mL时,平均抑制率为77%,随着蛋白浓度的增加,抑菌率继续增加,蛋白浓度为100 μg/mL时,平均抑菌率在95%以上。

图5 thanatin蛋白抑菌率

图6 defbl蛋白抑菌率

图7 TD蛋白抑菌率
defbl组蛋白浓度为25 μg/mL时,其对大肠杆菌(K88)、多杀性巴氏杆菌、肺炎克雷伯菌的平均抑菌率均在75%以上,针对奇异变形杆菌、金黄色葡萄球菌、表皮葡萄球菌、停乳链球菌的平均抑菌率均在50%~75%之间,针对无乳链球菌的平均抑菌率在50%左右;蛋白浓度为50 μg/mL时,defbl对各受试菌株的平均抑菌率均在95%以上,此后虽增加蛋白浓度,但抑菌率并不增长。
对于TD组蛋白,当浓度为25 μg/mL时,TD对肺炎克雷伯菌的抑制率可达到90%以上,对无乳链球菌的抑菌率在75%以上,均明显优于同浓度的thanatin、defbl组蛋白对这2种菌的抑制效果;蛋白浓度为50 μg/mL时,TD组对除无乳链球菌外的受试菌株抑菌率均在90%以上,对无乳链球菌的平均抑菌率也较同浓度thanatin组对无乳链球菌的平均抑制率高,在75%以上,而后增加蛋白浓度,TD组对停乳链球菌的平均抑菌率有所下降,但也在80%以上。
总体来看,TD组作为thanatin和defbl基因共表达组,与单独thanatin组、单独defbl组相比,同一浓度下,蛋白TD较蛋白thanatin、蛋白defbl的针对金黄色葡萄球菌、肺炎克雷伯菌、无乳链球菌的抑制作用显著提高,且对所有指示菌株的平均抑菌率均在80%以上,对部分菌株抑制率甚至超过95%。综上,TD蛋白的抑菌效果更优。
2.5 重组蛋白溶血活性检测
测定纯化后各重组蛋白的溶血活性,试验结果见图8。结果显示,各试验组thanatin、defbl、TD蛋白在最高浓度150 μg/mL时的溶血率均低于5%,参考医用溶血判断标准,溶血率小于5%为阴性反应,无溶血现象;溶血率大于5%为阳性反应,有溶血现象[15]。说明本试验所获重组抗菌肽对红细胞的溶血能力均较弱。

图8 重组蛋白溶血性
3 讨论
抗菌肽是生物天然免疫的重要活性分子,广泛存在于各种动物、植物、细菌、真菌甚至人体中,是生物天然免疫的第一道防线[15],具有抑菌效果好,不易使细菌等产生耐药性的特点。抗菌肽在生物体内含量极微,直接提取工艺复杂、产量低,人工合成费用昂贵且可能与天然抗菌肽存在差异,这极大地制约着抗菌肽的发展与应用[16]。利用基因工程、微生物发酵技术微生产抗菌肽具有明显优势,在节省大量的人力物力的同时又可获得大量的抗菌肽[17]。相较于原核表达系统,酵母真核表达系统具有相对完善的基因表达调控机制,表达产物的后修饰使目的蛋白的结构和功能更接近于天然,同时酵母表达系统表达量高,已有大量外源基因通过酵母获得表达,表达量可达到g/L水平[18]。
昆虫死亡素thanatin和斑点叉尾鮰的β-防御素均为广谱抗菌肽,已受到广泛研究。苏鹏[19]、张文杰等[20]、Tanhaeian等[21]都曾对thanatin进行了原核、真核的异源表达。王莎莎等[22]利用酵母X-33菌株表达了斑点叉尾鮰β-防御素,获得的抗菌蛋白对金黄色葡萄球菌、单增李斯特菌、铜绿假单胞菌都具有很好的抑菌效果。
本试验选用昆虫死亡素thanatin和斑点叉尾鮰β-防御素基因,构建了重组表达载体pPICZαA-thanatin、pPICZαA-defbl、pPICZαA-TD,利用酵母GS115获得了重组毕赤酵母工程菌株GS115-pPICZαA-thanatin、GS115-pPICZαA-defbl、GS115-pPICZαA-TD;通过甲醇诱导,获得了相应的重组抗菌肽蛋白,纯化后进行体外抑菌试验及溶血性试验。在试验设计上,为尽量避免2种抗菌肽基因的相互干扰,选择了共表达方式,2个基因各自表达,尽可能保证抗菌肽本身功能又可一次性获得2种抗菌肽,弥补单抗菌肽抗菌谱窄或者抗菌效力不足的缺憾。一同纯化,方便操作。同时试验设计单基因表达组进行对照,探讨共表达组在蛋白表达量、抑菌效果上是否具有实际优势。试验结果表明,本试验构建获得的3组重组抗菌肽都明显具有抑制大肠杆菌(K88)、奇异变形杆菌、肺炎克雷伯菌、多杀性巴氏杆菌、金黄色葡萄球菌、表皮葡萄球菌、无乳链球菌、停乳链球菌的作用,且在150 μg/mL浓度时均不产生红细胞溶血作用,相较而言,共表达TD组蛋白在抑菌效果上具有优势,较单蛋白组对金黄色葡萄球菌、肺炎克雷伯菌、无乳链球菌的抑制活性明显提高。
综上,本试验首次开展昆虫死亡素thanatin和斑点叉尾鮰β-防御素在毕赤酵母GS115菌株中的重组表达,获得了表达量分别为thanatin组 600 μg/mL,defbl组 300 μg/mL、TD组 700 μg/mL的重组抗菌肽蛋白,溶血性均较低,在抑制革兰阴性及革兰阳性细菌活性方面,均表现出广谱抗菌性,且共表达TD组重组蛋白具有明显优于thanatin、defbl组重组蛋白的抑菌活性。本试验为后期重组抗菌肽的临床应用提供理论和试验基础。

