新型植物源天然产物杀虫剂研究进展
董小绮, 康兆勇, 刘胜男*,,2, 高清志*,
(1.天津大学 合成生物学前沿科学中心,天津大学 药物科学与技术学院,天津市现代药物传递及功能高效化重点实验室,天津 300072;2.天津大学 分子 + 研究院,天津 300072)
农业病虫害是影响植物生长和导致作物减产的主要因素。有机氯、磷、氮等化学合成农药起效快,抗病虫谱系广,杀虫效果好,在农业生产中发挥着关键作用[1]。然而,化学农药的大量使用也对人类健康和环境产生了负面影响,由此产生的“3R”问题 (即抗性Resistance、再增猖獗Resurgence 和农药残留Residue) 已成为全世界公认的亟待解决的难题。因此,研制和开发新的环保型绿色农药对保障农业生产及粮食安全、减少环境污染至关重要。
与化学杀虫剂相比,植物源天然产物杀虫剂的有效成分主要为天然化合物,施用后较易降解为无毒物质,对环境无不良影响[2]。植物源杀虫剂与有害生物之间的相互作用是自然演化形成的生化过程,不易产生耐药性[3]。植物源杀虫剂有效成分一般具有特定目标和靶向特异性,因此对非靶标生物安全[4]。此外,根据植物来源的不同,在有效施用浓度条件下,植物源杀虫剂一般不会对农作物产生异株克生 (植化相克) 作用[5]。综上所述,植物源杀虫剂的重要性和优越性不仅归因于它们的功效、易降解性、作用模式多样性和低毒性,其在促进建立有机农业生产模式和保障农业可持续发展方面具有不可替代的应用价值和重要作用。
研究者针对植物源杀虫剂已发表多篇综述文章,分别就植物源杀虫剂的分类和作用机理[6-7]、现有产品的优缺点[8-10]、国内生产和登记情况[11]以及开发现状[12-13]等信息进行了总结。本文在对国内外相关文献调研的基础上,结合植物源杀虫剂的最新研究进展,从药物化学角度出发,介绍了2015 年之后以植物源杀虫剂活性成分为先导化合物进行结构改造的研究现状,并对该领域目前面临的挑战、未来的发展趋势和研发方向进行了展望,以期为今后更好地开发与利用植物源杀虫剂提供依据。
1 植物源天然产物杀虫剂的种类与作用机制
植物源天然产物杀虫剂 (简称植物源杀虫剂)是从植物中提取分离或衍生得到的具有杀虫作用的活性物质及其相关的农药制剂。图1 展示了目前企业及科研机构发现新型杀虫活性成分的一般方法[14-15]。商业化植物源杀虫剂的发现和发掘主要源自于对各种天然产物的活性筛选、结构衍生以及后期药效试验与安全性评估。这些天然产物多为植物在长期适应不良环境或抵御病原物侵害过程中产生的次生代谢物,包括各种植物激素和抗生物质等,在植物对环境胁迫的适应、植物与植物之间的相互竞争与协同进化、植物对昆虫等病虫害的防御中起着至关重要的作用[16]。大量的植物源次生代谢产物已发展成为目前和未来害虫防治中很有前途的化学农药替代品。按活性成分的化学结构差异,植物源杀虫剂可分为以下7 类:①生物碱类、②萜烯类、③黄酮类、④蒽醌类、⑤香豆素类、⑥木脂素类、⑦其他类,其中以生物碱类和萜烯类化合物最为常见。

图1 植物源杀虫剂的发现途径Fig.1 Approaches to the discovery of new botanical insecticides
植物源杀虫剂对害虫的作用方式多种多样,包括毒杀、驱避、拒食、抑制生长发育等。植物源杀虫剂通过几种不同的作用机制影响害虫的一个或多个生物活性,包括神经、消化、呼吸和内分泌系统等。在分子水平上植物源杀虫剂一般通过作用于昆虫细胞信号通路中的某些重要靶点,干扰其神经系统的信号传递 (如神经递质的合成、储存、释放、结合和再摄取等) 或阻断生物代谢途径而发挥杀虫活性[17]。例如在鳞翅目幼虫中,萜烯类化合物能阻断昆虫口器化学感应受体对营养成分的感应和识别,精油中的几种重要单萜类化合物 (D-柠檬烯、肉豆蔻烯、松油醇、芳樟醇和胡薄荷酮等) 则能够作用于乙酰胆碱酯酶等而发挥神经毒性[18]。前人已对植物源杀虫剂的种类与作用机制进行了详细的论述,本文将不再举例说明[19-20]。
2 植物源杀虫剂的最新活性成分
植物在长期与昆虫协同进化过程中自身产生一系列活性代谢物来防御昆虫的侵害,这些活性代谢产物是目前和未来害虫防治过程中具有潜在开发和应用前景的绿色杀虫剂。科研工作者通过对不同种属的植物开展研究,源源不断地从植物的根、茎、花、叶及果实中发现和分离出具有杀虫活性的新物质。表1 列举了近年来从植物中分离提取的具有杀虫作用的代表性化合物。

表1 从植物中发现的新型杀虫活性化合物及其生物活性Table 1 Novel insecticide compounds and their biological activities discovered from plants
3 植物源杀虫剂新衍生物
3.1 生物碱类
生物碱类植物源杀虫剂是一类含氮的碱性有机化合物,大多数有复杂的环状结构,具有很强的生物活性。目前植物体内提取发现的生物碱有12 000 多个结构,多分布在茄科植物的种子、果实、花、茎等部位。按照结构可以分为喹啉类生物碱、哌啶类、吡啶类、吲哚类、嘌呤类和甾体类等,大多数生物碱在低浓度时表现出理想的杀虫活性。本综述着重针对2015 年至今所报道的生物碱类新衍生物作总结说明。
3.1.1 喹啉类生物碱 喜树碱 (camptothecin, CPT)(图式1) 是一类从喜树Camptotheca acuminataDecne 中分离的碱性含氮有机化合物,该类天然产物一般既具有抗癌药物活性,又具有杀虫活性。2019 年,Yang 等[33]报道了通过CPT 酯化衍生获得的含2-硝基氨基咪唑啉侧链系列衍生物CA-1,与CPT 相比该类化合物明显增加了对甜菜夜蛾Spodoptera exigua幼虫的触杀毒性,同时发现该类化合物对拓扑异构酶I (DNA-topoisomease I, Top1) 的抑制活性大大降低。CPT 的A 环引入1-氯-2-异氰酸乙烷得到的喜树碱衍生物CA-2,则通过靶向抑制Top1 对S.exigua具有高效接触致死活性。Wu 等[34]将尿素、硫脲和酰基硫脲等基团引入到CPT 的B 环,获得的所有衍生物对甘蓝蚜虫Brevicoryne brassicae均显示出良好的活性,CA-3 对甘蓝蚜虫的LC50值为0.059 mmol/L,远高于CPT (LC50= 0.146 mmol/L)。Wang 等[35]将喜树碱C-20 位引入t-Boc 氨基酸得到一系列衍生物,CA-4 对S.exigua的接触毒性高于CPT。Li等[36]根据类同合成法和亚结构连接法,通过在CPT 的C-7 位进行结构修饰,得到了新型7-(1-酰基哌嗪-4-基)甲基喜树碱衍生物CA-5,对松材线虫Bursaphelenchus xylophilus的LC50值可达到6.34 mg/L,远高于CPT (LC50= 18.84 mg/L)。进一步研究发现,昆虫II 组和h 组几丁质酶是CPT及其衍生物的新型分子靶点,其杀虫活性与化合物的分子结构和害虫的中肠环境密切相关,这些发现为开发基于CPT 的杀虫剂提供了有益的思路[37]。

图式1 喜树碱新型衍生物及其杀虫活性Scheme 1 Novel camptothecin derivatives and their insecticidal activities
奎宁 (quinine,图式2) 是金鸡纳树皮中提取的主要生物碱,表现出良好的杀虫和抗菌活性。奎宁丁 (quinidine)、辛可尼 (cinchonine) 和辛可尼定 (cinchonidine) 是奎宁的类似物,具有与奎宁相似的生物活性。Che 课题组[38-40]将奎宁、奎宁丁、辛可尼和辛可尼定C-9 位羟基部分与苯甲酸衍生物酯化获得了高活性系列化合物。其中QU-1、QU-2、QU-3 和QU-4 在1 mg/mL 的质量浓度下对东方粘虫Mythimna separataWalker 的触杀致死率分别是57.1%、75.0%、75.0% 和75.0%。因此,奎宁类化合物作为杀虫剂的构效关系可以总结为:① C-9 位羟基是非活性必需基团,羟基经酰氧基修饰后,杀虫活性显著提高;② C-8/9 位构型对杀虫活性很重要,其中C-9 位S构型最优;③ C-10,11 位双键的修饰是可以接受的,双键的还原衍生增强了杀虫活性;④ 奎宁环是活性必需基团,打开奎宁环后活性降低;⑤ 6′-OCH3是非活性必需基团,去除该基团活性仍然可以保持。

图式2 奎宁类生物碱新型衍生物及其杀虫活性Scheme 2 Novel quinine alkaloid derivatives and their insecticidal activities
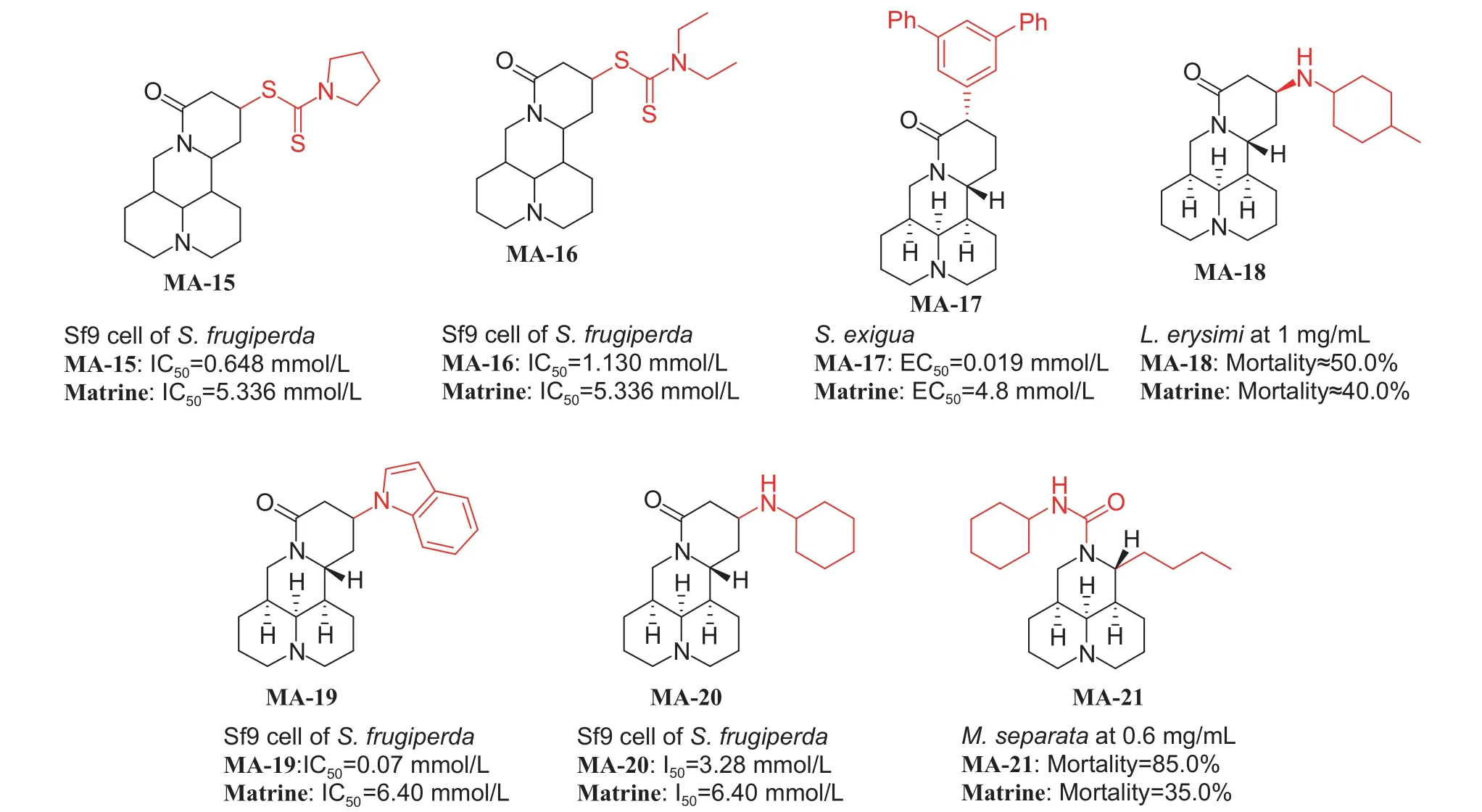
3.1.2 哌啶类生物碱 苦参碱 (matrine, 图式3) 是从苦参属植物 (豆科植物) 中分离出来的一类生物碱,杀虫活性以触杀为主,胃毒为辅,活性相对较低,多与其他杀虫剂配伍使用。目前,苦参碱的结构修饰主要集中在C-11、C-12、C-13、C-14和C-15 位。徐晖课题组针对苦参碱开展了一系列改构及衍生研究。将苦参碱的内酰胺环打开,合成了胆固醇-苦参碱偶联物,化合物MA-1 对M.separata的杀虫活性分别是胆固醇和苦参碱的3.0 倍和2.6 倍;化合物MA-2 在20 μg/nymph 的剂量下对P.xylostella口服毒性分别是胆固醇和苦参碱的2.8 倍和2.0 倍[41];此外,在胆固醇-苦参碱偶联物的基础上,引入N-苯基磺酰基,MA-3 对M.separata亦具有良好的杀虫活性[42]。将苦参碱的内酰胺环打开后,引入噻唑、单糖和磺酸等不同片段,MA-4 对M.separata的杀虫活性是苦参碱的2.4 倍[43],MA-5 对M.separata的杀虫活性是苦参碱的2.6 倍[44],化合物MA-6 在1 mg/mL 下对M.separata致死率可达到65.5%[45]。该课题组制备的另一系列苦参碱15-氯-18-肟基醚衍生物,化合物MA-7 对M.separata在1 mg/mL 的致死率可达到70%,远高于苦参碱[46];通过在C-15 引入螺-1,2,4-噁二唑啉片段,化合物MA-8 对M.separata的拒食活性是苦参碱的两倍[47];在C-15位引入亚胺类取代基,化合物MA-9 对M.separata拒食活性是苦参碱的3.9 倍[48];在C-14 和C-15 位引入喹啉环,21-氯喹啉苦参碱MA-10 对M.separata表现出良好的杀虫活性[49];在C-14 和C-15 位分别引入甲酰基和芳氧基/甲氧基,化合物MA-11 表现出比苦参碱更好的生长抑制活性[50]。Cheng 等[51]将卤代吡唑基团引入苦参碱的C-13 位,氟代吡唑基团 (MA-12) 的引入可显著提高苦参碱对M.separata、P.xylostella和草地贪夜蛾Spodoptera frugiperda的杀虫活性。Ni 等[52]合成了14-羟甲基-15-脱氧苦参碱的酯类衍生物,大多数衍生物对M.separata和P.xylostella表现出良好的杀虫活性,MA-13 在600 μg/mL 下对M.separata的致死率为65%,MA-14 在0.1 mg/mL 下对P.xylostella的致死率为40%。He 等[53]合成了含二硫代碳酸酯取代的苦参碱衍生物MA-15 和MA-16,与苦参碱 (IC50= 5.336 mmol/L) 相比,这两种新化合物对Sf9 细胞的IC50分别降至0.648 mmol/L 和1.130 mmol/L,细胞生物学实验说明了诱导细胞凋亡从而抑制昆虫细胞增殖可能是苦参碱发挥杀虫作用的机制。Huang 等[54]使用Pd(OAc)2/NiXantphos催化了苦参碱C-14 位直接芳基化,3,5-二苯基苯类似物MA-17 表现出最有效的杀甜菜夜蛾活性(EC50= 0.019 mmol/L),是苦参碱的25 倍。Cheng等[55-56]将吲哚和环己氨基引入苦参碱的13 位,MA-18 对萝卜蚜Lipaphis erysimi的杀虫活性明显强于苦参碱,MA-19 和MA-20 对草地贪夜蛾Sf9 昆虫细胞系的活性均优于苦参碱,表明芳香环和脂肪环的引入可显著提高苦参碱的生物活性。Ni 等[57]合成了N-取代-11-丁基苦参碱衍生物MA-21,该化合物在600 μg/mL 下对M.separata致死率可达到85%,远高于苦参碱。
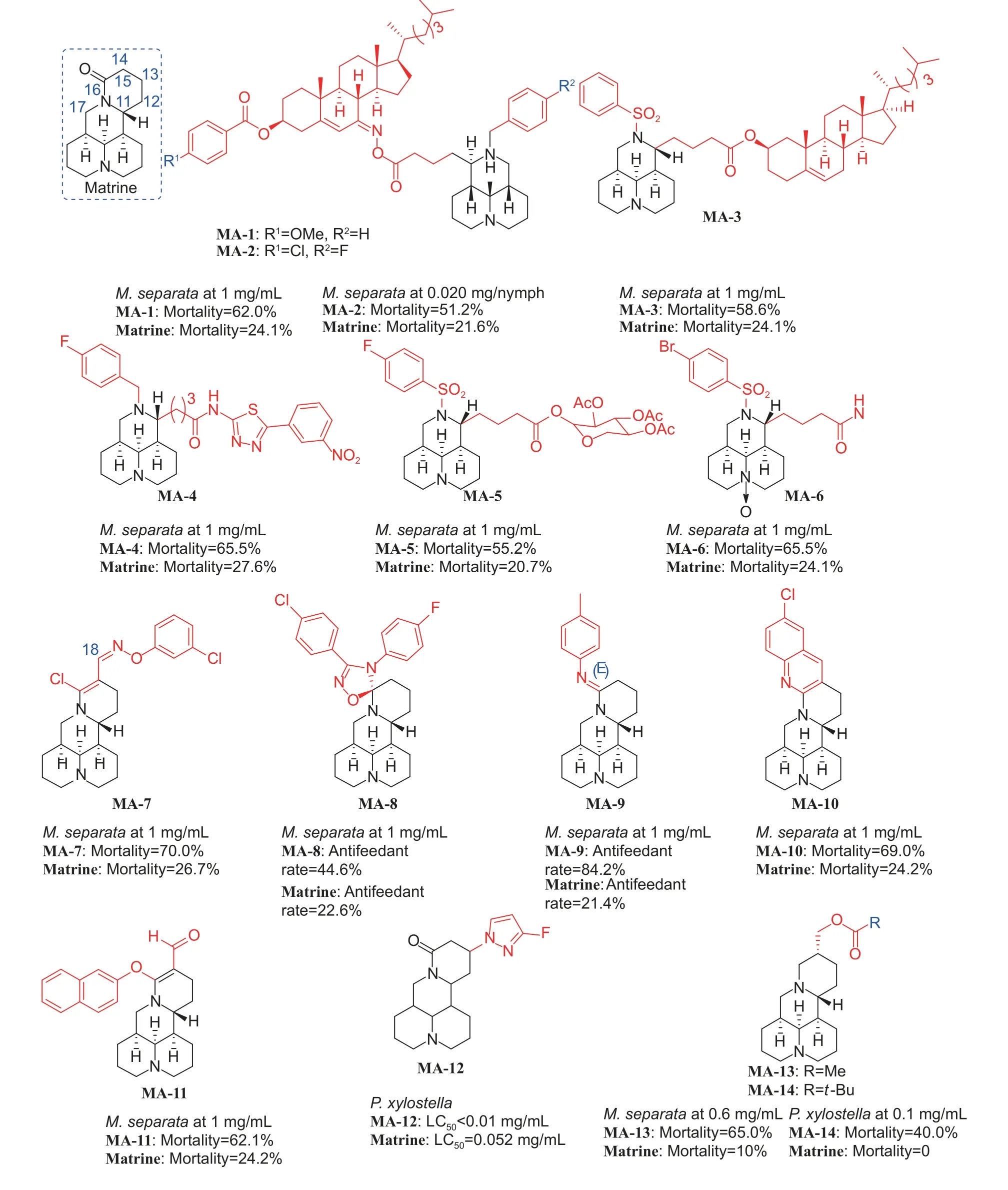
图式3 苦参碱其衍生物Scheme 3 Structures of matrine and its derivatives
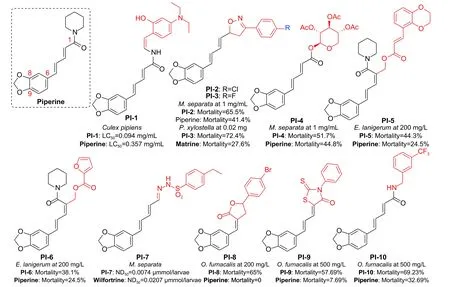
图式4 胡椒碱及其衍生物Scheme 4 Structures of piperine and its derivatives
胡椒碱 (piperine, 图式4) 是胡椒科植物特有的一种生物碱,具有良好的抗炎、杀菌和杀虫作用。Tantawy 等[58]设计并合成了一系列基于胡椒碱的二烯酰肼衍生物,例如化合物PI-1 (LC50= 0.094 mg/mL) 表现出比胡椒碱 (LC50= 0.357 mg/mL) 和溴氰菊酯 (LC50= 1.457 mg/mL) 更高的杀淡色库蚊Culex pipiens活性。Yang 等[59]合成了含异噁唑啉/吡唑啉侧链的胡椒碱类似物,其中,化合物PI-2 对M.separata表现出比川楝素更强的生长抑制活性,化合物PI-3 对P.xylostella的口服毒性与川楝素相比明显提升。Huang 等[60]制备了一系列单糖-胡椒酸/类胡椒酸结合物,在所有的衍生物中,PI-4 对M.separata表现出最好的杀虫活性。Li等[61-62]应用Vilsmeier-Haack-Arnold (VHA) 反应得到了胡椒碱的关键中间体醛,由此衍生出一系列胡椒碱类似物,化合物PI-5 对苹果绵蚜Eriosoma lanigerum的杀虫活性是胡椒碱的1.8 倍,PI-6 对E.lanigerum的杀虫活性是胡椒碱的1.6 倍。Qu等[63]合成了一系列基于胡椒碱的苯磺酰腙衍生物,其中,PI-7 对M.separata表现出强效麻醉活性,其半数麻醉剂量 (ND50) 为每只幼虫0.0074 μmol,其活性远高于雷公藤春碱和雷公藤吉碱。此外,PI-7 显示出对M.separata乙酰胆碱酯酶 (AchE)选择性抑制活性。杨青课题组[64-66]发现,胡椒碱对3 种几丁质酶OfChtI、OfChtII 和OfChi-h 均有抑制活性 (Ki= 43.78~83.03 μmol/L),该课题组基于这3 种酶的结构,分别设计了含丁烯内酯、罗丹宁和苄胺基团等不同系列的新型胡椒碱衍生物,PI-8、PI-9 和PI-10 对亚洲玉米螟Ostrinia furnacalis的杀虫活性明显高于胡椒碱。
3.2 萜烯类
萜烯类化合物是天然产物中结构最多、种类最丰富的化合物,可根据异戊二烯原则,即不同碳数及组成结构进行线性排列,形成多个异戊二烯单元组成的头尾相连的异戊二烯聚合体,少部分萜类化合物也会以各种含氧衍生物的形式存在。早期研究表明具有杀虫活性的萜烯化合物主要包括蒎烯、单萜类、倍半萜、二萜类、三萜类等,这类杀虫剂作用方式主要有驱避、拒食、抑制生长发育,破坏害虫信息传递和交配,兼有触杀和胃毒作用。最受关注的有印楝素 (azadirachtin)、川楝素 (toosendanin) 和苦皮藤素 (celangulin) 等,已经开发为商业植物源杀虫剂。21 世纪以来,我国开发出各种剂型和不同含量的印楝素、川楝素、苦皮藤素杀虫制剂用于农业生产。随着绿色农药发展需求的不断增加,近年来很多新型的具有杀虫活性的萜烯类化合物被报道,如单萜 (梣酮、栀子醛)、倍半萜 (诺卡酮、吉马酮) 和二萜类(穿心莲内酯) 等。
3.2.1 单萜 梣酮 (fraxinellone, 图式5) 是一种柠檬苦素,主要从楝Melia azedaach和川楝M.toosendan中分离出来,已被用于低毒性的商业植物农药,以控制鳞翅目昆虫害虫。Dong 等[67]在梣酮的C 环上进行溴代修饰的衍生物对M.separata的杀虫活性明显提高,尤其在C-2′ 位置的溴代,随后与萘酚进行Suzuki-Miyaura 偶联反应生成FR-1,对M.separata表现出更强的杀虫活性。梣酮的呋喃环 (C 环) 对于展示其杀虫活性至关重要,当C 环的C-5′ 位被乙酰化后 (FR-2, 57.1%) 对M.separata的致死率明显高于卤素取代[68]。Yang 等[69]在呋喃环C-2′ 位进行结构修饰,得到了一系列酯类衍生物,FR-3 对M.separata杀虫活性高于川楝素。Guo 等[70-73]分别在C 环的C-2′ 位和C-5′ 进行结构修饰,发现在C-2′ 和C-5′ 分别延伸出一个N-(1,3-噻唑-2-基) 甲酰胺 (FR-4)、新型噁二唑基硫醚(FR-5)、N-苯基吡唑 (FR-6) 和肟酯 (FR-7 和FR-8)能明显提升其对M.separata和P.xylostella的杀虫活性,FR-5 在所有衍生的结构类似物中对M.separata的致死率最高 (75.9%),FR-4 和FR-6 对P.xylostella的杀虫活性也比川楝素更有效。Guo等[74]制备了一系列新型N-苯基吡唑杂环化合物,化合物FR-9 在1 mg/mL 的浓度时,对M.separata的致死率可达到75.9%。Yang 等[75]在C 环的C-4′,5′ 的双键上进行Rh (II) 催化的环丙烷化,半合成了其环丙基类似物FR-10 (37.5%),其显示出比川楝素 (33.3%) 略高的M.separata致死率。Li 等[76]在梣酮C-4 或C-10 位引入羰基或肟取代基,化合物FR-11 和FR-12 对M.separat显示出比川楝素更强的杀虫活性。
栀子醛 (cerbinal) 和栀子苷 (geniposide) 是一类环烯醚萜类天然产物,具有抗真菌活性和抗病毒活性,Li 等[77]将栀子醛结构中的环烯醚替换为N-取代的环戊基[c]吡啶,发现CE-1 对P.xylostella具有与栀子醛和鱼藤酮相当的杀虫活性。Xia 等[78]在栀子苷的C-1 位糖苷部分或C-10 位进行结构修饰,GE-1 对P.xylostella具有与鱼藤酮相当的杀虫活性。
3.2.2 倍半萜 倍半萜烯是一种含量丰富的天然产物,通常存在于植物精油中。诺卡酮 (nootkatone,图式6) 是一种从阿拉斯加黄雪松Chamaecyparis nootkatensis中分离出的倍半萜类化合物,具有抗菌、杀虫、抗癌等多种药理活性,对各种白蚁、蚊类、蟑螂、黑腹果蝇、M.separata和P.xylostella等杀虫效果显著[79]。研究表明,诺卡酮对乙酰胆碱酯酶 (acetylcholinesterase, AChE) 抑制活性较弱,其是一种GABA 门控氯离子通道拮抗剂,以类似于苦味毒素的方式拮抗昆虫GABA 受体以诱导致死[80]。Galisteo Pretel 等[81]在诺卡酮的C-3 位引入双键 (NO-1),对M.separata的杀虫活性提高了40%以上。Yang 等[82]在诺卡酮的C-13 位引入含有卤代苯基的1,3,4-噁二唑/噻二唑硫醚,相较于诺卡酮而言,合成的部分化合物表现出对M.separata和P.xylostella更高的杀虫活性,NO-2 表现出对M.separata最有效的生长抑制活性(71.4%),NO-3 对P.xylostella的杀虫活性是川楝素的3.37 倍 (LC50= 0.270 mg/mL vs 0.910 mg/mL),略高于乙螨唑 (LC50= 0.280 mg/mL)。他们通过与1,3-噻唑进行分子杂交制备了N-(1,3-噻唑-2-基)甲酰胺融合的诺卡酮,合成出用于害虫管理的天然衍生杀虫剂,其中NO-4 对M.separata的致死率是印楝素的1.87 倍,NO-5 也表现出比印楝素高1.37 倍的3 龄P.xylostella杀虫活性[83]。此外,在诺卡酮的C-11 位置与不同的N-羟基苯甲酰氯进行[3 + 2]环加成,合成出一种含有异噁唑啉部分的诺卡酮衍生物,其中NO-6 和NO-7 对M.separata的生长抑制活性均为73.3%,比川楝素高23%以上。NO-8 显示出明显的P.xylostella幼虫杀虫活性 (LC50= 0.230 μmol/mL),更接近于阳性对照乙螨唑 (LC50= 0.080 μmol/mL)[84]。大量诺卡酮的结构衍生物被合成,表现出广泛的生物活性,将有利于其进一步开发为天然衍生杀虫剂[85]。同样具有杀虫活性的倍半萜物质吉马酮 (germacrone, 图式6)是从大天竺葵Geranium macrorhyzum的精油中分离获得的具有抗蚜虫和抗蜱虫作用的化合物。Galisteo Pretel 等[86]以吉马酮为起始原料进行结构修饰,化合物GE-1 对禾谷缢管蚜Rhopalosiphum padi的拒食活性远高于吉马酮。从卫矛科植物苦皮藤Celastrus angulatus中分离出的苦皮藤素V(Celangulin V, 图式6) 也是一种倍半萜类杀虫剂,研究表明其通过抑制昆虫中肠杯状细胞膜囊泡中的V-ATPase 而发挥作用[87]。

图式6 新型倍半萜类植物源杀虫剂及其衍生物Scheme 6 Structures of sesquiterpene-derived insecticides and their new derivatives
3.2.3 二萜类 穿心莲内酯 (andrographolide, 图式7)是从穿心莲Andrographis paniculata中分离出来的二萜类化合物,具有广泛的生物学特性,如抗菌、抗炎、抗肿瘤和杀虫活性[88-89]。为开发更多基于天然产物的杀虫剂,徐晖课题组近年来制备了一系列穿心莲内酯结构衍生物,并测试了其对M.separata等农业害虫的杀虫活性,结果显示穿心莲内酯衍生物可能具有作为杀虫剂的应用潜力[90]。AN-1 是借鉴鬼臼毒素的酯化衍生物设计策略合成的一种14-脱氧-11,12-二脱氢穿心莲内酯衍生物,并在C-19 位酯化,具有显著的M.separata生长抑制活性 (69.0%)[91]。在合成的12α-(取代)苄氨基-14-脱氧穿心莲内酯衍生物中,AN-2 表现出比川楝素更有效的M.separata生长抑制活性 (62.1%)[92]。此外,Hao 等[93]在穿心莲内酯的C-7 位氧化合成了7β-羟基穿心莲内酯衍生物后,进一步酯化生成系列衍生物,其中AN-3 具有良好的M.separata生长抑制活性 (57.1%)。
3.3 苯酚类
植物中酚类物质丰富,具有多种生理活性,一些苯酚类天然产物也表现出效果显著的抗菌、杀虫活性。丹皮酚 (paeonol, 图式8) 是从牡丹Paeonia suffruticosa根皮中提取分离的酚类物质,具有抗炎、抗癌、免疫调节、抑制植物病原真菌、抗植物寄生线虫以及利用熏蒸和接触作用杀虫驱卵等广泛的药理作用和生物活性,可作用于乙酰胆碱酯酶 (AChE),并显著影响突触中神经递质的正常传递[94]。近年来,Chen 等[95]在开发硝基取代的腙丹皮酚衍生物过程中,合成了一类3/5(3,5) -硝基取代的化合物,发现5-硝基取代的PA-1具有显著的杀线虫活性 (LC50= 32.331 mg/mL),高于随后衍生的腙类似物和丹皮酚 (LC50= 50.804 mg/mL)。他们同时合成了一类丹皮酚酯类衍生物,其中PA-2 表现出最有效的M.separata杀虫活性,比川楝素提高了18.5%,是丹皮酚的2.19 倍[96]。苯磺酰腙修饰的丹皮酚类衍生物对M.separata的杀虫活性也有明显提高,PA-3 和PA-4 对M.separata的杀虫活性均为53.6%,比丹皮酚提高了21.5%。
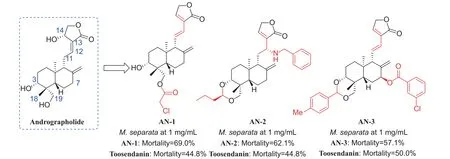
图式7 穿心莲内酯及其衍生物Scheme 7 Structures of andrographolide and its derivatives

图式8 苯酚类植物源杀虫剂及其衍生物Scheme 8 Structures of phenolic compounds-derived insecticides and their derivatives
和厚朴酚 (honokiol, 图式8) 是一种从传统中药厚朴Magnolia officinalis中分离出的联苯多酚型化合物,对其进行结构修饰以获得具有优异生物活性的候选药物或农药的研究已有报道。Yang 等[97]合成了和厚朴酚的新型苯并噁唑衍生物,发现含有8-乙酰氧基苯基的HO-1 对M.separata的杀虫效果显著。Zhi 等[98]制备了两个系列的8/8′-烷基硫醇-苯并噁唑和N-烷基/磺酰基苯并噁唑酮的和厚朴酚衍生物,并测试了对M.separata和P.xylostella幼虫的杀虫活性。HO-2 对M.separata表现出最有效的杀虫活性,最终死亡率为58.6%,同时,HO-3 和HO-4 (均为65.3%) 显示出比植物源杀虫剂川楝素 (40.5%) 对P.xylostella更高的杀虫活性。Ren 等[99]将广泛存在于天然产物和药物 (如鱼藤酮、雷米替尼) 中的苯并二氢呋喃核心骨架引入和厚朴酚的结构修饰中,制备了一系列新的和厚朴酚单酯/二酯衍生物,其中HO-5 和HO-6 (均为72.7%) 显示出比和厚朴酚 (33.4%) 高2.1 倍的M.separata杀虫活性。此外,他们还合成了一类和厚朴酚芳基甲胺衍生物,HO-7 对M.separata的杀虫活性最终死亡率可达58.6%[100]。Yang 等[101]合成了一系列和厚朴酚/厚朴酚偶氮衍生物,化合物HO-8 和HO-9 (均为63.3%) 对M.separata杀虫活性高于阳性对照川楝素 (53.3%)。
半棉酚 (hemigossypol, 图式8) 是棉酚(gossypol) 的生物合成前体,同时也是一种倍半萜类天然产物,从接种白黄萎病菌Verticillium alboatrum棉花茎的去皮组织中分离出来,具有抗真菌活性,但它暴露在空气中的稳定性差,极大地限制了其进一步的开发利用。Li 等[102]对半棉酚进行结构衍生,醛基氧化和酚羟基甲基化的产物HE-1 具有显著的杀虫活性,对M.separata的杀虫活性为70%。同时,半棉酚酸内酯具有良好的空气稳定性。他们进一步简化了半棉酚酸内酯的结构,通过打开半棉酚的萘环合成了一系列结构更简单的苯酞和香豆素衍生物,对烟草花叶病毒显示出良好的活性[103]。苯酞衍生物HE-2 对P.xylostella的杀虫效果显著,在100 mg/L 时对P.xylostella的致死率高于商业植物杀虫剂鱼藤酮40%,而且该化合物对多种农业害虫均显示出优异的杀虫活性。
3.4 香豆素类
蛇床子素 (osthole, 图式9) 是一种天然存在的香豆素化合物,广泛分布于伞形科和芸苔科植物中,在蛇床子Cnidium monnieri(L.) Cusson 果实中的含量很高[104]。蛇床子素具有广泛的生物活性,在我国长期作为农药,对埃及伊蚊Aedes aegypti和淡色库蚊Culex pipiens pallens等多种蚊子幼虫表现出杀虫活性[105]。近年来,许多蛇床子素衍生物被合成并作为对抗某些农作物害虫的杀虫候选剂。郭勇课题组[106]在O-1 位进行O-酰基羟胺改造,筛选出OS-1 对P.xylostella的杀虫活性比川楝素更强 (LC50= 0.64 μmol/mL vs 0.94 μmol/mL),且在质量浓度为1 mg/mL时,P.xylostella幼虫的死亡率 (89.7%) 比蛇床子素 (51.7%) 和川楝素(51.7%) 提高了38%。随后在C-2′,3′位的双键上引入异噁唑啉合成了蛇床子素的异噁唑啉衍生物,其中OS-2 对M.separata的致死率为96.4%,是蛇床子素和川楝素的1.8 倍,但对P.xylostella幼虫的致死率并没有优势,而OS-3 显示出比鱼藤酮(rotenone) 更强的P.xylostella杀虫活性 (LC50=0.220 mg/mL vs 0.410 mg/mL)[107]。在蛇床子素C-3′位引入N-苯甲酰硫脲,OS-4 表现出最强的M.separata生长抑制作用 (82.1%),同时OS-5 和OS-6 具有更有效的P.xylostella杀虫活性和更低的毒性[108]。他们在C-8 位衍生出含肟酯片段和酰基腙结构的蛇床子素衍生物并测试了对M.separata的生长抑制作用,其中OS-7 显示出最明显的生长抑制作用 (70.4%)[109],另一个衍生物OS-8 对M.separata的杀虫活性比蛇床子素 (34.5%) 提高了1.6 倍[110]。徐晖课题组在C-4′位进行结构修饰,引入异噁唑啉或酰胺片段,在质量浓度为1 mg/mL时,OS-9 对M.separata幼虫的致死率为62.0%[111],OS-10 对苹果绣线菊蚜Aphis citricolaVan der Goot的杀虫活性是蛇床子素的1.9 倍[112]。此外,徐晖课题组将蛇床子素的内酯结构打开,设计合成了酰胺/酯衍生物,化合物OS-11 和OS-12 对M.separata显示出更明显的生长抑制活性,在1 mg/mL下最终死亡率分别为68.9%和64.3%[113,114]。Li 等[115]开发出一种格氏试剂高效合成蛇床子素衍生物的新方法,化合物OS-13 显示出对淡色库蚊C.pipiens pallens比蛇床子素更强的杀虫活性 (LC50= 1.14 mg/L vs 6.60 mg/L)。
3.5 木脂素类
木脂素是由两分子苯丙素单元氧化聚合而成的植物次生代谢产物。其中,鬼臼毒素是典型的一种木脂素类植物源杀虫剂。鬼臼毒素 (podophyllotoxin,图式10) 是从柏科植物中分离到具有广泛生物活性的天然产物,是一种五环体系芳基四氢萘木脂素。

图式9 蛇床子素及其衍生物Scheme 9 Structures of osthole and its derivatives
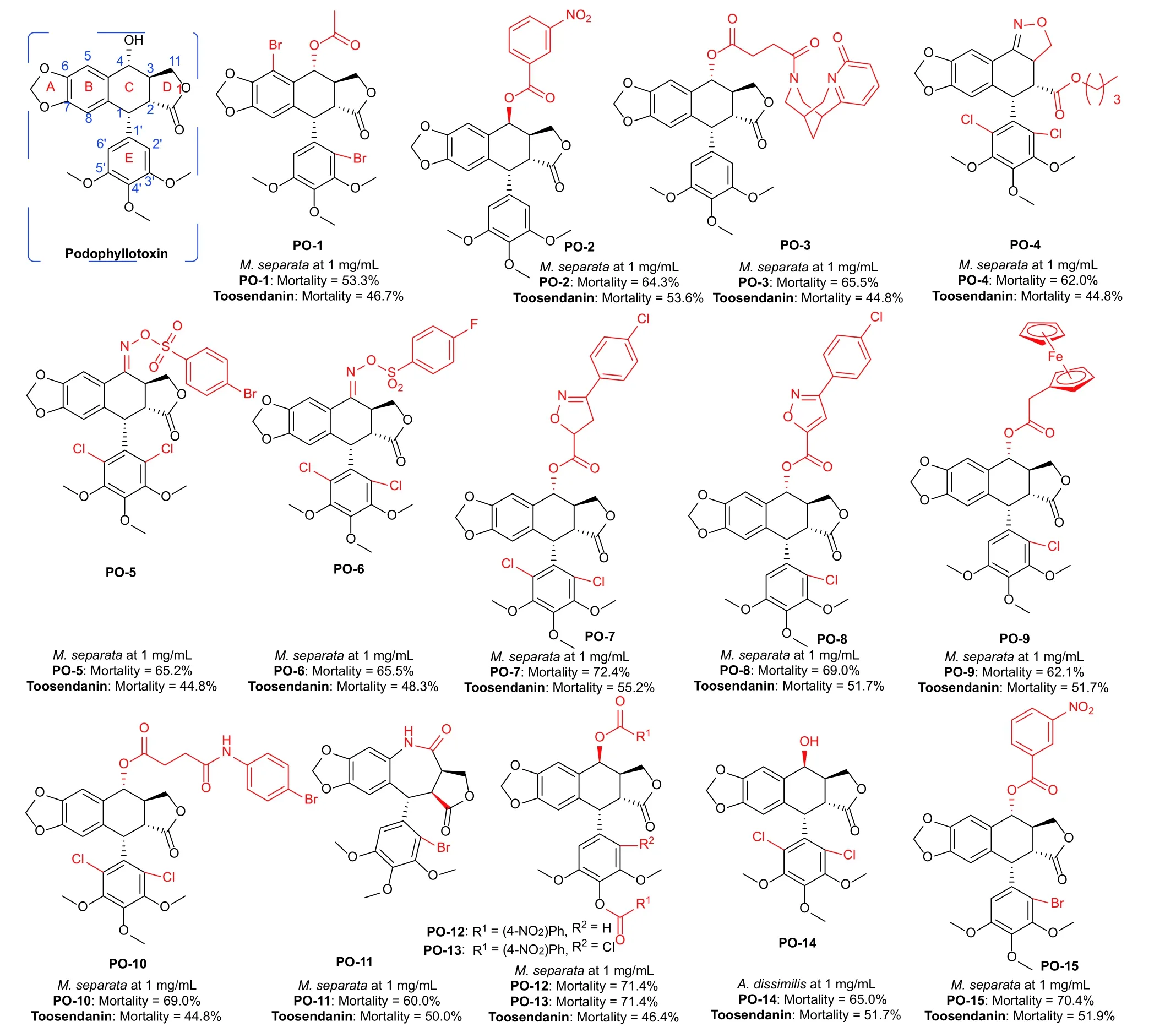
图式10 鬼臼毒素及其衍生物Scheme 10 Structures of podophyllotoxin and its derivatives
为了提高鬼臼毒素杀虫活性,研究人员针对A-E 环进行了结构修饰:① A 环的结构修饰:C-6 位和C-7 位的亚甲二氧基桥对于杀虫活性至关重要。② B 环的结构修饰:C-5 位引入溴原子可以增强杀虫活性。徐晖课题组合成了一系列2′-氯-5-溴或2′,5-二溴4α-酰氧基鬼臼毒素衍生物,化合物PO-1 对M.separata表现出的杀虫活性高于鬼臼毒素[116]。③ C 环的结构修饰:C-4 位是修饰的主要位置,4 位β 构型是提高杀虫活性的最佳构型,在C-2 位引入卤素原子可以有效提高活性。Che 等[117]合成了一些4α/β-酰氧基鬼臼毒素衍生物,发现4β-酰氧基部分对于获得更有效的化合物具有重要意义,化合物PO-2 显示出比鬼臼毒素更高杀虫活性。徐晖课题组在C-4 位修饰,将金雀花碱引入鬼臼毒素4α 位得到化合物PO-3,表现出比川楝素更高的杀虫活性[118]。此外,他们将C 环引入异噁唑啉与肟磺酸酯,并测试了这些衍生物在1 mg/mL 下对M.separata的杀虫活性。结果发现,化合物PO-4 对M.separata的致死率为62.0%,PO-5 的致死率达65.2%[119],PO-6 的致死率为65.5%[120],化PO-7 的致死率为72.4%[121],PO-8 的致死率为69.0%[122]。该课题组在C-4 位引入二茂铁基甲酰基或2-二茂铁基乙酰氧基后,发现化合物PO-9 对M.separata表现出的杀虫活性高于川楝素[123]。另外,徐晖课题组半合成了一系列鬼臼毒素的琥珀酸衍生物,发现化合物PO-10 在1 mg/mL 下对M.separata的杀虫活性是鬼臼毒素的2.1 倍[124]。他们通过亚硫酰氯介导的贝克曼重排反应制备了鬼臼毒素7 元内酰胺环衍生物,发现化合物PO-11 对M.separata表现出比川楝素更强的杀虫活性[125]。④ D 环的结构修饰:反式内酯是活性必需基团,打开D 环引入合适的基团可以得到高活性的衍生物。⑤ E 环的结构修饰:E 环的C-4′位引入卤素 (氯或溴) 原子或吩嗪杂环可以得到活性更高的化合物,E 环3,4,5-三甲氧基到3,5-二甲氧基的轻微变化也可以增强杀虫活性。徐晖课题组合成了4'-去甲氧基表鬼臼毒素和2'-氯-4'-脱甲氧基表鬼臼毒素的两个系列酯衍生物,化合物PO-12 和PO-13 表现出最有效的杀虫活性,对M.separata的致死率为71.4%[126]。Che等[127]评估了一系列鬼臼毒素衍生物对双委夜蛾Athetis dissimilisHampson 幼虫的杀虫活性,发现2′,6′-二氯鬼臼毒素 (PO-14) 的杀虫活性最为显著,在1 mg/mL 下对A.dissimilis的致死率为65.0%。同时,徐晖课题组还发现鬼臼毒素衍生物PO-15 通过阻断胰岛素受体1 酪氨酸磷酸化,诱导M.separata残翅并且降低其繁殖力,由此推测昆虫胰岛素受体可以作为一种新的靶点用于设计新型绿色杀虫剂[128]。
3.6 其他类
3.6.1 羧酸酯类 除虫菊素 (pyrethrins, 图式11)是从菊科菊属除虫菊亚属中提取的一类羧酸酯代谢物。Kawamoto 等[129]已实现了多种除虫菊素天然产物的手性全合成,并比较其对蚊虫的杀虫活性 (KD50和IC50),得出结论:①除虫菊酯Ⅰ > 除虫菊酯Ⅱ;②除虫菊酯Ⅰ和Ⅱ > 瓜叶菊酯Ⅰ和Ⅱ >>茉酮菊素Ⅰ和Ⅱ。以除虫菊素为先导化合物,科研工作者合成了一大批拟除虫菊酯类农药活性化合物。Zhang 等[130]通过亚乙基链的连接,将拟除虫菊酯杀虫剂的环丙烷羧酸酯的关键药效团引入甲基黄嘌呤骨架,PY-2 对M.separata表现出良好的杀虫活性,PY-1 (LC50= 0.8441 mg/L) 对P.xylostella的杀虫活性优于天然甲基黄嘌呤化合物咖啡因,与商品化杀虫剂四氰菊酯相当 (LC50=0.8507 mg/L)。
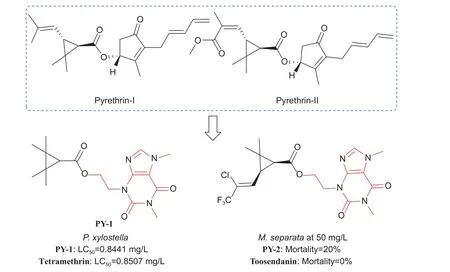
图式11 除虫菊素及其新型结构衍生物Scheme 11 Structures of pyrethrins and its new derivatives
3.6.2 蒽醌类 蒽醌类化合物是天然醌类化合物中种类最多也是最重要的一类结构,其中大黄酸、芦荟大黄素和大黄素甲醚等具有较好的抑菌活性。Zhu 等[131]将大黄酸 (rhein, 图式12) 的1,8 位羟基和羧基衍生化,合成的化合物RH-1、RH-2和RH-3 对斜纹夜蛾Spodoptera litura均显示出较强的杀虫活性。
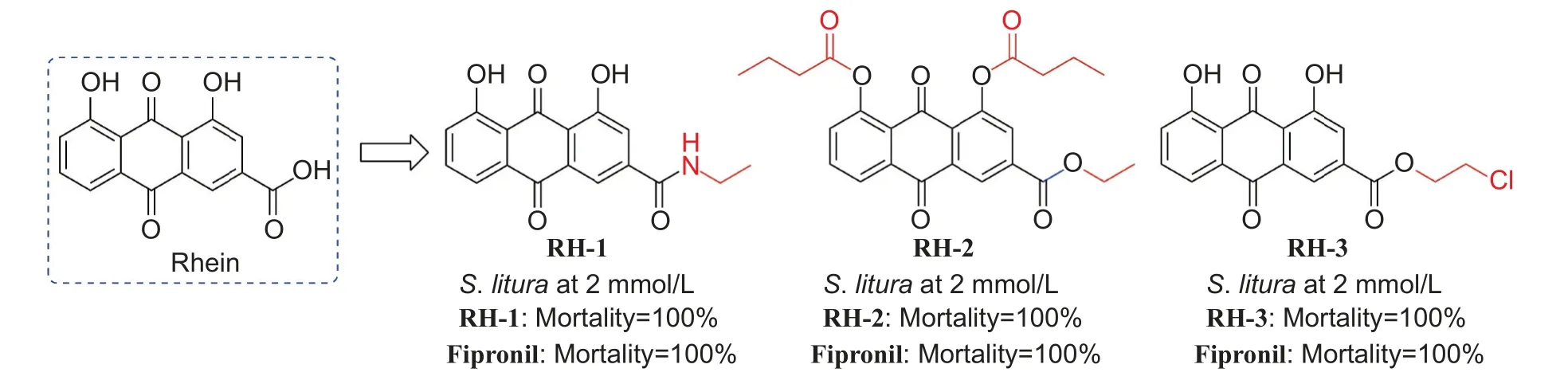
图式12 大黄酸及其衍生物Scheme 12 Structures of rhein and its derivatives
4 总结与展望
本文对新型植物源天然产物杀虫剂的来源、种类和作用机制以及最新发现的活性成分和结构修饰的研究进展作了分类论述。我国拥有丰富的植物资源,目前已发现具有农药活性的植物约4000 多个品种,开发潜力巨大。但长期以来,我国对植物源杀虫剂的研究与开发主要集中在筛选和发现更多的植物源上,在对新型有效成分的发现和发掘、药效机制的深入探索和稳态化制剂的开发利用等方面存在不足。为解决上述开发应用过程中面临的诸多问题,一方面需要强有力的政策支持和产学研用一体化科技创新合作,另一方面,在基础研究方面,利用我国植物资源丰富的优势继续深入开展高活性杀虫剂成分的发掘、鉴定和药效机制研究尤为重要。此外,应基于植物源天然产物特异性强和环境友好等特点通过结构衍生发现和发掘绿色杀虫剂及其他农药新产品。随着计算机技术的不断进步,定量结构活性关系研究、计算机辅助分子设计乃至人工智能机器学习等技术的应用已成为开发新型杀虫剂和了解药物作用机制的主流方法。
同时,影响植物源杀虫剂商业化开发的另一关键因素是活性化合物的来源问题。目前仍存在以下挑战性:1) 从资源角度,多数天然产物在植物中积累缓慢,可获得的活性化合物含量较低。2) 从成本角度,某些植物生长周期长,达到可用于制备植物源杀虫剂的时间较长,所投入的成本与化学合成杀虫剂相比较大,失去优越性;同时,制备和生产植物源杀虫剂过程中对材料的仓储、加工和产品保存需进行大规模的投资。3) 从环境保护角度,在提取和合成植物源杀虫剂过程中使用的大量有机溶剂也会带来环境污染问题。大多数天然产物具有复杂的结构和多个手性中心,化学合成过程复杂,转化率低。近年来,合成生物学的快速发展有望突破这些瓶颈,通过应用合成生物学技术进行活性物质的生物合成研究,可实现植物源杀虫剂活性物质的高效、低成本、绿色和规模化制备与生产。综上所述,为实现我国生态农业、有机农业的可持续发展目标,通过对植物源杀虫剂深入广泛的科学研究,不断开发高效、安全、低成本的植物源杀虫剂新产品具有重要的经济意义、生态意义和社会意义。

