麸炒苍术对脾虚大鼠结肠组织MEK/ERK 信号通路的影响
谢慧臣,冉云,张云,欧阳瑜,唐浪,吴广阳(. 湖北民族大学,湖北 恩施 445000;. 恩施德元升中医医院,湖北 恩施 445000)
脾虚证是一组以消化系统功能障碍及不同程度的病理改变为主要表现的全身性病理状态,其发病与多种急慢性应激密切相关。丝裂原活化细胞外信号调节激酶(丝裂原活化蛋白激酶激酶,MEK)/细胞外信号调节激酶(ERK)信号级联通路在胃肠道疾病的发生发展过程中发挥重要的调控作用,可激活肌球蛋白轻链激酶(MLCK),导致内皮细胞收缩,增大细胞间隙,从而间接调控肠黏膜屏障,影响肠黏膜修复及肠道功能的恢复[1]。
中药苍术具有燥湿健脾、祛风散寒的功效,常被用来治疗胃肠疾病。研究[2]发现,苍术炮制(麸炒)前后,其化学成分及药理作用发生了明显变化,炮制后健脾作用增强而燥性降低。本课题组前期研究[3]表明,相较于生品,麸炒苍术可更好地改善脾虚模型大鼠的脾虚相关证候及小肠组织病理变化,其机制可能与苍术麸炒后可更好地调节小肠转运相关蛋白载体的表达及各种消化酶的分泌,从而恢复小肠吸收转运功能有关。故本研究拟通过慢性束缚、苦寒破气联合饥饱失常法复制脾虚大鼠模型,进一步观察麸炒苍术对脾虚大鼠结肠组织MEK/ERK 信号通路的影响,以期从结肠黏膜屏障的损伤与修复角度进一步阐明麸炒苍术发挥健脾功效的深层次机制。
1 材料与方法
1.1 动物3月龄雄性SD大鼠60只,SPF级,体质量(150±20)g,购自武汉塞维尔生物科技有限公司,动物质量合格证号:56007500 034292;实验动物使用许可证号:SYXK(鄂)2018-0101,动物实验方案经湖北民族大学伦理委员会审批,批文号:2020043。
1.2 药物及主要试剂厚朴(批号:200401)、枳实(批号:200203)、大黄(批号:200301)、麸炒苍术(批号:200304),均购自湖北省恒信医药有限公司;上述饮片均经湖北民族大学药学院胡华副教授鉴定,符合2020 年版《中华人民共和国药典(一部)》相关规定。苦寒破气方药液制备方法:厚朴、枳实、大黄的组方质量比为5∶3∶4,常规煎煮2 次,每次45 min;滤过,合并药液,加热浓缩至生药质量浓度为1 g·mL-1。麸炒苍术药液制备方法:麸炒苍术饮片先后加入10、8 倍量蒸馏水,常规煎煮2 次,每次45 min;滤过,合并药液,浓缩至生药质量浓度为1 g·mL-1。
复方谷氨酰胺肠溶胶囊,地奥集团成都药业股份有限公司,批号:20190508。密封蛋白2(Claudin-2,批号:B2022)、密封蛋白3(Claudin-3,批号:B2019)、黏蛋白(MUC2,批号:B2305)、基质金属蛋白酶9(MMP-9,批号:B2117)ELISA 检测试剂盒,均购自上海信帆生物科技有限公司;一抗磷酸化肌球蛋白轻链激酶(p-MLCK,批号:G4109)、磷酸化丝氨酸/苏氨酸蛋白激酶(p-Raf)兔多克隆抗体(批号:G3301)、HE 染色液套装(批号:G1009)、RNA 提取液(批号:J253479),均购自武汉塞维尔生物科技有限公司;Trizol 提取试剂盒(批号:J521013)、RevertAid First Strand cDNA Synthesis Kit(批号:J397452),均购自美国Thermo科技公司。
1.3 主要仪器D3024R 型台式高速冷冻型微量离心机,大龙兴创实验仪器(北京)股份公司;Rt2100c型酶标检测仪,深圳雷杜生命科学股份有限公司;NE600 型光学显微镜,深圳西尼科光学仪器有限公司;NanoDrop2000 型超微量分光光度计,美国Thermo 科技公司;Stepone plus GC-1500 型实时荧光定量PCR仪,美国ABI 公司;alphaEaseFC灰度分析软件,美国Alpha Innotech 公司;Adobe PhotoShop 图像分析软件,美国Adobe 公司;H-600 型透射电镜,日本日立公司。
1.4 分组、模型复制及给药大鼠适应性喂养1 周后,随机分为6组:正常组、模型组、复方谷氨酰胺组(9 mg·kg-1)及麸炒苍术高、中、低剂量组(10.0、5.0、2.5 g·kg-1),每组10 只。参考相关研究[3-4]方法采用慢性束缚、苦寒破气联合饥饱失常法复制脾虚大鼠模型:除正常组外,其余各组大鼠每日以束缚架捆绑束缚3 h,并以苦寒破气方10 g·kg-1灌胃1 次;隔日喂饲1次,且饲料量为常规量的一半;自由饮水,持续21 d。模型复制结束后的第2天开始按照上述设定剂量灌胃给药,正常组和模型组给予蒸馏水灌胃(10 mL·kg-1),每日1次,持续14 d。
1.5 大鼠一般状态观察实验期间每日观察动物的宏观表征、摄食情况,记录每日体质量增加情况。定期收集大鼠6 h的粪便,记录烘干(50 ℃)前后的质量(g),计算:粪便含水率(%)=(湿粪质量-干燥粪便质量)/湿粪质量×100%。依据《中药治疗脾虚证的临床研究指导原则》[5]对大鼠脾虚证进行评分。
1.6 结肠组织病理形态学观察(1)将部分大鼠结肠组织用4%多聚甲醛溶液固定后,经取材、脱水、包埋后制备4 μm 石蜡切片;常规HE 染色,中性树脂封片,光镜下观察结肠组织病理改变。(2)另取部分结肠组织,置于2.5%戊二醛溶液中,经固定、漂洗、脱水、包埋后制备超薄切片,铀、铅染色后,于透射电镜下观察结肠组织细胞超微结构病理学变化。
1.7 ELISA 法检测结肠黏膜组织中Claudin-2、Claudin-3、MUC2、MMP-9 含量低温下取部分结肠组织,用冰生理盐水洗净并滤干,加9倍体积生理盐水匀浆,以4 ℃、3 500 r·min-1(离心半径8.7 cm)离心10 min,收集上清液。严格按照试剂盒说明书步骤操作,采用ELISA双抗体夹心法检测结肠黏膜组织中Claudin-2、Claudin-3、MUC2、MMP-9含量。
1.8 免疫组化法检测结肠组织中p-MLCK、p-Raf蛋白表达水平取结肠组织石蜡切片(4 μm),脱蜡至水,经过消除内源性过氧化氢酶活性、抗原修复、BSA 封闭,一抗4 ℃孵育过夜,二抗37 ℃孵育30 min,DAB显色、苏木素复染、乙醇脱水、中性树脂封片、干燥后,光镜下观察结肠组织中p-MLCK、p-Raf蛋白表达情况。阳性染色为棕色或棕黄色,运用Image-Pro Plus 软件分析平均光密度值,对免疫组化结果进行半定量分析。
1.9 Real-time PCR 法检测结肠组织中MEK、ERK、MLCK mRNA 表达水平取匀浆管加入1 mL Trizol Reagent,预冷;取100 mg 结肠组织,置于匀浆管中充分研磨,离心取上清;加入250 μL 三氯甲烷,充分混匀,静置;取上清加入异丙醇,混匀、离心;乙醇洗涤,加水溶解RNA,孵育5 min;检测RNA 浓度及纯度。取10 μL RNA 溶液,加入1 μL oligo(dT)18 和1 μL RevertAiM-MuLV 逆转录酶,按照逆转录试剂盒说明书步骤进行反转录。取0.2 mL PCR管,配制反应体系;以cDNA为模板进行PCR扩增反应:预变性95 ℃、10 min,95 ℃、15 s,60 ℃、60 s。根据扩增曲线读取Ct 值,以β-actin 为内参,采用2-△△Ct法计算目的基因的相对表达水平。引物由美国Thermo科技公司提供,引物序列见表1。

表1 PCR 引物序列Table 1 Primer sequences of PCR
1.10 统计学处理方法采用SPSS 19.0统计软件进行数据分析;计量资料以均数± 标准差(±s)表示;多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD检验,方差不齐采用Dunnett’s T3检验;以P<0.05为差异有统计学意义。
2 结果
2.1 麸炒苍术对脾虚大鼠一般状态的影响结果见表2。与正常组比较,模型组大鼠的脾虚证积分、粪便含水率显著升高(P<0.01),每日体质量増加量显著降低(P<0.01)。与模型组比较,各给药组大鼠的脾虚证积分、粪便含水率明显降低(P<0.05,P<0.01),每日体质量増加量明显升高(P<0.05,P<0.01)。结果表明,麸炒苍术能改善脾虚大鼠的一般症状,具有燥湿健脾作用。
表2 麸炒苍术对脾虚大鼠粪便含水率、每日体质量増加量及脾虚证积分的影响( ±s,n=10)Table 2 Effects of bran-fried Atractylodes Rhizoma on daily mass gain,moisture content of faeces and integral of spleen deficiency syndrome in spleen deficiency rats( ±s,n=10)
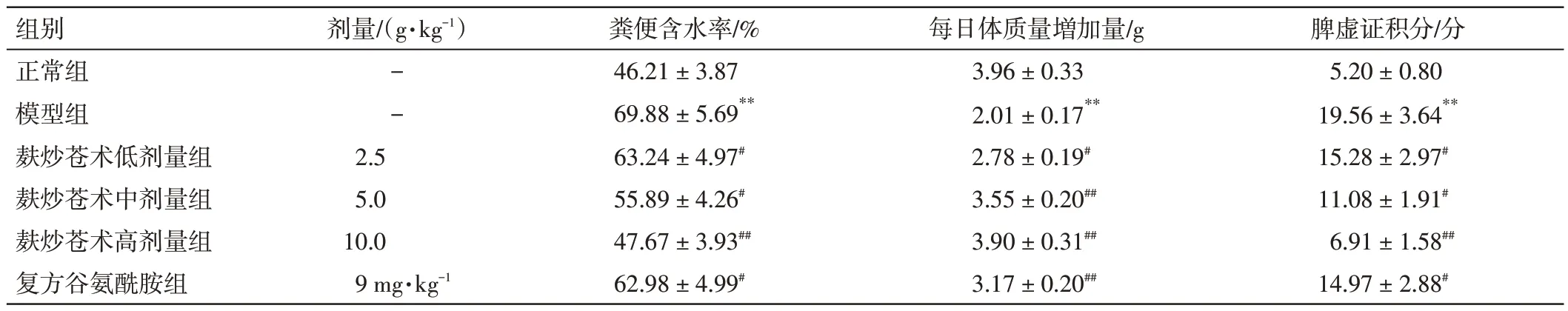
表2 麸炒苍术对脾虚大鼠粪便含水率、每日体质量増加量及脾虚证积分的影响( ±s,n=10)Table 2 Effects of bran-fried Atractylodes Rhizoma on daily mass gain,moisture content of faeces and integral of spleen deficiency syndrome in spleen deficiency rats( ±s,n=10)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
脾虚证积分/分5.20±0.80 19.56±3.64**15.28±2.97#11.08±1.91#6.91±1.58##14.97±2.88#组别正常组模型组麸炒苍术低剂量组麸炒苍术中剂量组麸炒苍术高剂量组复方谷氨酰胺组剂量/(g·kg-1)--2.5 5.0 10.0 9 mg·kg-1粪便含水率/%46.21±3.87 69.88±5.69**63.24±4.97#55.89±4.26#47.67±3.93##62.98±4.99#每日体质量増加量/g 3.96±0.33 2.01±0.17**2.78±0.19#3.55±0.20##3.90±0.31##3.17±0.20##
2.2 麸炒苍术对脾虚大鼠结肠组织病理变化的影响结果见图1、图2。HE染色结果显示,正常组大鼠结肠黏膜上皮及固有层完整。与正常组比较,模型组大鼠结肠组织黏膜层上皮细胞出现不同程度的萎缩,黏膜表面结构疏松水肿,固有膜结构被破坏,可见炎性细胞浸润,杯状细胞减少。与模型组比较,麸炒苍术各剂量组大鼠结肠黏膜表面结构明显改善,水肿减轻,杯状细胞排列形态渐趋整齐,数量明显增多,以麸炒苍术高剂量组修复效果最明显。
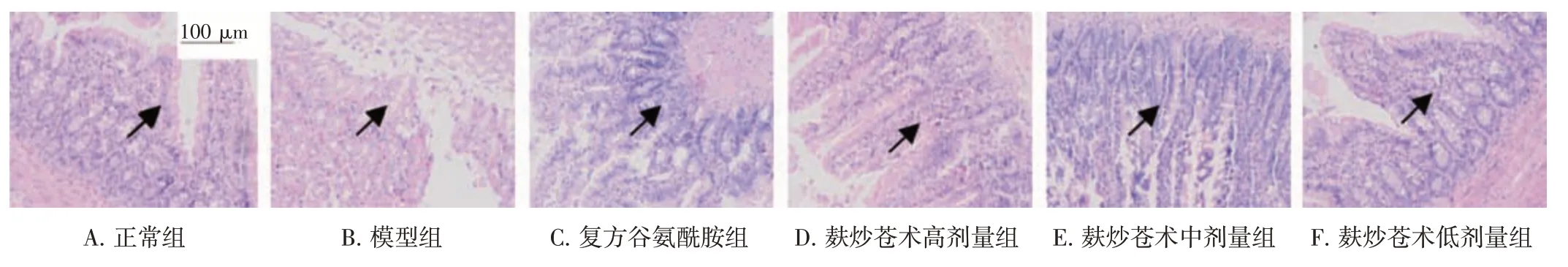
图1 麸炒苍术对脾虚大鼠结肠组织病理学变化的影响(HE 染色,×200)Figure 1 Effect of bran-fried Atractylodes Rhizoma on intestinal histopathology of spleen deficiency rats(HE staining,×200)

图2 麸炒苍术对脾虚大鼠结肠组织细胞超微结构病理学变化的影响(透射电镜,×8 000)Figure 2 Effect of bran-fried Atractylodes Rhizoma on ultracellular pathology in colon tissue of spleen deficiency rats(TEM,×8 000)
透射电镜结果显示,正常组大鼠结肠壁细胞胞膜及胞核正常,结构及体积无明显异常,胞核及胞质饱满充盈,外膜完整,线粒体在胞质中分布较多,线粒体基质分布均匀。与正常组比较,模型组大鼠结肠上皮细胞结构及体积明显异常,体积变小,核固缩变形,染色质及核仁形态模糊不清,线粒体数量明显减少且结构明显异常。与模型组比较,麸炒苍术各剂量组大鼠结肠组织细胞超微结构有不同程度修复,其中以麸炒苍术高剂量组修复效果最为明显,大部分线粒体排列整齐,嵴密,结构完整。结果表明,麸炒苍术能够修复脾虚大鼠受损的肠黏膜及其组织细胞超微结构,缓解肠黏膜炎性改变。
2.3 麸炒苍术对脾虚大鼠结肠黏膜组织Claudin-2、Claudin-3、MUC2、MMP-9 含量的影响结果见表3。与正常组比较,模型组大鼠结肠黏膜组织中Claudin-3、MUC2含量显著降低(P<0.01),Claudin-2、MMP-9含量显著升高(P<0.01)。与模型组比较,各给药组大鼠结肠黏膜组织中Claudin-3、MUC2含量明显升高(P<0.05,P<0.01),Claudin-2、MMP-9含量明显降低(P<0.05,P<0.01)。结果表明,麸炒苍术能够上调结肠组织紧密连接相关蛋白Claudin-3、MUC2表达,下调Claudin-2、MMP-9蛋白表达。
表3 麸炒苍术对脾虚大鼠结肠黏膜组织中Claudin-2、Claudin-3、MUC2、MMP-9 含量的影响( ±s,n=10)Table 3 Effects of bran-fried Atractylodes Rhizoma on contents of Claudin-2,Claudin-3,MUC2、MMP-9 in colonic mucosal tissue of spleen deficiency rats( ±s,n=10)

表3 麸炒苍术对脾虚大鼠结肠黏膜组织中Claudin-2、Claudin-3、MUC2、MMP-9 含量的影响( ±s,n=10)Table 3 Effects of bran-fried Atractylodes Rhizoma on contents of Claudin-2,Claudin-3,MUC2、MMP-9 in colonic mucosal tissue of spleen deficiency rats( ±s,n=10)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
MUC2/(ng·mL-1)41.36±2.83 19.29±1.05**26.50±1.39#33.34±1.85##40.91±2.55##33.76±1.90##组别正常组模型组麸炒苍术低剂量组麸炒苍术中剂量组麸炒苍术高剂量组复方谷氨酰胺组剂量/(g·kg-1)--2.5 5.0 10.0 9 mg·kg-1 Claudin-2/(ng·mL-1)16.38±1.05 34.28±3.88**28.04±2.57#23.01±2.33##16.99±1.82##22.48±2.44##Claudin-3/(ng·mL-1)57.57±3.88 24.19±1.02**33.73±2.09#45.58±2.88#56.73±3.65##34.16±2.11#MMP-9/(ng·mL-1)20.39±2.31 51.21±4.93**42.18±4.06#31.28±3.38#21.09±2.77##40.43±4.01#
2.4 麸炒苍术对脾虚大鼠结肠组织中p-MLCK、p-Raf 蛋白表达的影响结果见图3、图4、表4。与正常组比较,模型组大鼠结肠组织p-MLCK、p-Raf蛋白表达显著上调(P<0.01)。与模型组比较,各给药组大鼠结肠组织p-MLCK、p-Raf 蛋白表达明显下调(P<0.05,P<0.01)。结果表明,麸炒苍术对脾虚大鼠结肠组织p-MLCK、p-Raf 蛋白表达具有抑制作用。
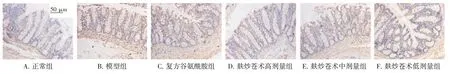
图3 麸炒苍术对脾虚大鼠结肠组织中p-MLCK 蛋白表达的影响(免疫组化,×400)Figure 3 Effect of bran-fried Atractylodes Rhizoma on protein expression of p-MLCK in colon tissue of spleen deficiency rats(IHC,×400)
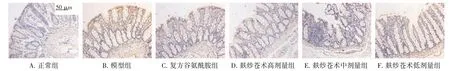
图4 麸炒苍术对脾虚大鼠结肠组织中p-Raf 蛋白表达的影响(免疫组化,×400)Figure 4 Effect of bran-fried Atractylodes Rhizoma on protein expression of p-Raf in colon tissue of spleen deficiency rats(IHC,×400)
表4 麸炒苍术对脾虚大鼠结肠组织中p-MLCK、p-Raf蛋白表达的影响( ±s,n=10)Table 4 Effects of bran-fried Atractylodes Rhizoma on protein expressions of p-MLCK and p-Raf in colon tissue of spleen deficiency rats( ±s,n=10)
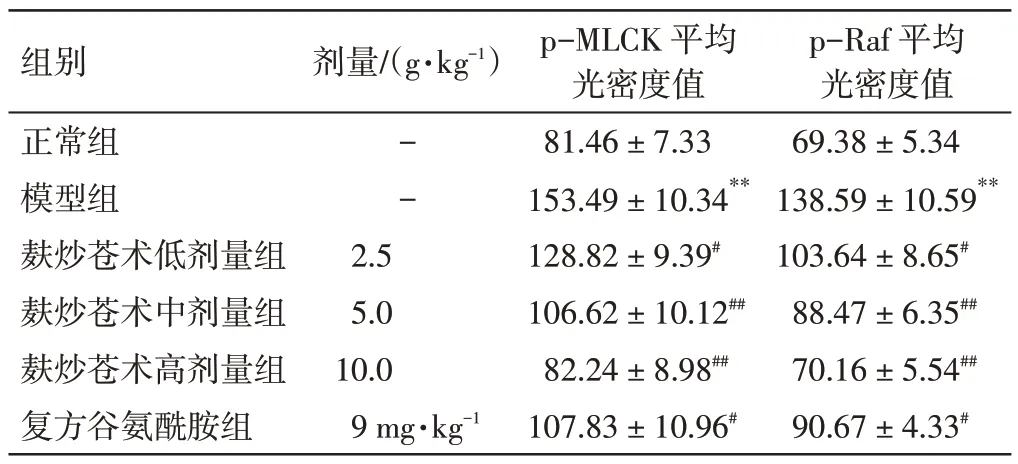
表4 麸炒苍术对脾虚大鼠结肠组织中p-MLCK、p-Raf蛋白表达的影响( ±s,n=10)Table 4 Effects of bran-fried Atractylodes Rhizoma on protein expressions of p-MLCK and p-Raf in colon tissue of spleen deficiency rats( ±s,n=10)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
p-Raf 平均光密度值69.38±5.34 138.59±10.59**103.64±8.65#88.47±6.35##70.16±5.54##90.67±4.33#组别正常组模型组麸炒苍术低剂量组麸炒苍术中剂量组麸炒苍术高剂量组复方谷氨酰胺组剂量/(g·kg-1)--2.5 5.0 10.0 9 mg·kg-1 p-MLCK 平均光密度值81.46±7.33 153.49±10.34**128.82±9.39#106.62±10.12##82.24±8.98##107.83±10.96#
2.5 麸炒苍术对脾虚大鼠结肠组织MEK、ERK、MLCK mRNA 表达的影响结果见表5。与正常组比较,模型组大鼠结肠组织MEK、ERK、MLCK mRNA 表达均显著上调(P<0.01)。与模型组比较,各给药组大鼠结肠组织中MEK、ERK、MLCK mRNA表达均明显下调(P<0.05,P<0.01)。结果表明,麸炒苍术对脾虚大鼠结肠组织MEK、ERK、MLCK基因表达具有抑制作用。
表5 麸炒苍术对脾虚大鼠结肠组织中MEK、ERK、MLCK mRNA 表达的影响( ±s,n=10)Table 5 Effect of bran-fried Atractylodes Rhizoma on mRNA expressions of MEK,ERK and MLCK in colon tissue of spleen deficiency rats( ±s,n=10)

表5 麸炒苍术对脾虚大鼠结肠组织中MEK、ERK、MLCK mRNA 表达的影响( ±s,n=10)Table 5 Effect of bran-fried Atractylodes Rhizoma on mRNA expressions of MEK,ERK and MLCK in colon tissue of spleen deficiency rats( ±s,n=10)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
MEK mRNA 相对表达量1.09±0.05 5.32±0.19**3.81±0.20#2.98±0.26##1.25±0.11##3.09±0.24#组别正常组模型组麸炒苍术低剂量组麸炒苍术中剂量组麸炒苍术高剂量组复方谷氨酰胺组剂量/(g·kg-1)--2.5 5.0 10.0 9 mg·kg-1 MLCK mRNA 相对表达量1.67±0.07 6.96±0.36**5.05±0.24#3.40±0.21##1.71±0.11##4.90±0.22#ERK mRNA 相对表达量1.08±0.07 4.67±0.24**3.54±0.23#2.60±0.36##1.21±0.13##2.98±0.24#
3 讨论
脾虚证是以消化系统功能障碍为主,涉及神经内分泌免疫网络功能异常的全身性病理状态,与许多疾病的发生发展都有密切关系[6]。研究[7-8]认为,多因素复合的脾虚证动物模型制备方法与临床真实情况更加接近,较单因素模型复制方法更为科学。为全面反映脾虚证本质,本研究采用慢性束缚、苦寒破气联合饥饱失常三因素复合方法构建脾虚证动物模型。模型复制过程中,造模大鼠逐渐表现出倦怠疲乏、食少、运动迟滞、大便溏薄、形体消瘦、体质量增加缓慢、肛温下降明显、被毛枯槁等比较典型的脾虚症状。通过病理学观察显示,模型大鼠结肠组织黏膜层上皮细胞出现不同程度的萎缩,黏膜表面结构疏松水肿,炎性细胞浸润明显,杯状细胞减少,核固缩变形,线粒体数量明显减少且结构明显异常。而麸炒苍术干预可以明显改善脾虚大鼠一般状况,降低脾虚宏观证候积分,并修复受损的肠黏膜及其组织细胞超微结构,缓解肠黏膜炎性改变。
机械屏障、化学屏障是构成肠道屏障的重要组成部分。肠黏膜上皮细胞间的紧密连接是肠黏膜机械屏障的主要结构,其组成包括Occludin、Claudins等跨膜蛋白和蛋白支架[9-12]。紧密连接骨架蛋白Claudin-3 在肠黏膜细胞中高表达,参与结肠上皮细胞的紧密连接[13]。Claudin-2 是一种孔道形成蛋白,可上调内皮及上皮细胞的通透性并调节肠道屏障,其高表达可致肠黏膜功能障碍[14]。MMP-9 属于蛋白裂解酶,在结肠黏膜上皮损伤中发挥重要作用,可降解结肠黏膜细胞外基质,损坏结肠紧密连接结构,破坏黏膜通透性[15]。结肠化学屏障主要由肠上皮杯状细胞所分泌的黏液构成,肠黏液层发挥着至关重要的肠屏障功能,其主要成分是黏蛋白MUC2[16]。本研究发现,脾虚证模型大鼠结肠组织中Claudin-3、MUC2表达水平均显著下降,提示脾虚大鼠肠黏膜上皮细胞间的紧密连接关键蛋白低表达,同时肠道化学屏障亦被破坏;Claudin-2、MMP-9 表达水平显著升高,提示肠黏膜机械屏障被破坏,结肠上皮通透性增加。而麸炒苍术干预可上调模型大鼠结肠组织中Claudin-3、MUC2 表达水平,同时下调Claudin-2、MMP-9 表达,提示麸炒苍术可双相调节结肠紧密连接相关蛋白表达,改善肠道屏障功能,从而降低结肠细胞间通透性并修复受损肠黏膜。
Raf/MEK/ERK 信号通路可调节胃肠黏膜上皮细胞迁移、增殖/凋亡、分化等多种生物学反应[17-18]。Ras 作为上游激活蛋白,能够和Raf 结合后激活Raf,并与MEK结合后激活MEK[19]。ERK是将信号从表面受体传导至细胞核的关键,MEK1/2 双特异性激酶可以催化ERK1、ERK2 在苏氨酸和酪氨酸残基上的磷酸化。磷酸化激活的ERKl/2 由胞质转位到核内,参与细胞增殖与分化、细胞形态维持等多种生物学反应[20]。Raf/MEK/ERK 信号级联通路可调控激活MLCK,MLCK磷酸化激活形成p-MLCK[21]。Raf/MEK/ERK 信号通路异常活化可诱导多种疾病如消化性溃疡、溃疡性结肠炎、克罗恩病、消化道肿瘤等[22]。本研究发现,脾虚证模型大鼠结肠组织p-MLCK、p-Raf 蛋白表达及MEK、ERK、MLCK 基因表达均明显上调,提示脾虚证结肠病变过程存在Raf/MEK/ERK信号级联通路及下游MLCK信号通路的激活。而麸炒苍术干预可以下调脾虚大鼠结肠组织p-MLCK、p-Raf 蛋白表达,下调MEK、ERK、MLCK 基因表达,提示麸炒苍术可能通过调控Raf/MEK/ERK 信号通路发挥治疗脾虚证相关胃肠疾病的作用。
综上所述,麸炒苍术能够降低脾虚大鼠结肠黏膜炎症水平,保护结肠上皮,改善结肠组织细胞的病理状态,其机制可能与干预Raf/MEK/ERK 信号通路,双相调节肠黏膜Claudin-2、MMP-9、Claudin-3等紧密连接蛋白及黏蛋白MUC2的表达,从而增强肠道屏障功能有关。

