基于液滴微流控技术选育超高浓酿造啤酒酵母菌株
贺秀丽,侍亚敏,谢鑫,郭立芸,付晓芬
(北京燕京啤酒股份有限公司技术中心,啤酒酿造技术北京市重点实验室,北京,101300)
基于降低成本、节能降耗,高浓酿造技术已成为啤酒酿造领域的一个重要研究方向[1],其中,高浓酵母的获取对酿造的成功与否起到至关重要的作用,由于发酵初期较高的麦汁浓度以及发酵后期的高乙醇浓度,酵母活力降低、发酵缓慢或受阻、发酵周期延长[2],从而要求高浓酵母具备较高的抗逆性能。目前,高浓酵母的研究大多集中在提高对渗透压的耐受性及酒精的产量方面[3-5],高浓酵母多通过诱变获得,而传统的诱变选育存在筛选工作量大、所用试剂多、周期长、筛选出的目标菌株较少、效率低下等缺陷。液滴微流控是新兴的菌种筛选方法[6],其利用互不相溶的两液相产生分散的微液滴,并对微液滴进行操作,是一种非连续流微流控技术[7],可以在短时间内生成大量液滴,这些液滴大小均匀、互不干扰、性能稳定且一致,每个液滴可作为独立的单位进行微生物的培养[8]。该技术在医疗领域得到广泛应用[9],在微生物的高通量培养[10]、驯化[11]、筛选[12-13]等方面也展现出重要的应用潜力,也有研究证明其可应用于体外诊断装置的开发[14]。本研究建立针对高浓菌株的液滴微流控筛选体系,结合常压室温等离子体(atmospheric room temperature plasma,ARTP)诱变技术,对出发菌株进行诱变筛选,以期获得1株性能稳定的高浓酿造菌株,并进行中试规模验证,为后续菌株在工业生产中的应用提供基础。
1 材料与方法
1.1 材料
1.1.1 菌株与培养基
酿酒酵母Saccharomycespastorianus02菌株由实验室菌种保藏中心提供。
液体麦汁培养基:取自产14 °P麦汁,115 ℃灭菌15 min备用。
固体麦汁培养基:液体麦汁中加入20 g/L琼脂粉,115 ℃灭菌15 min备用。
高浓麦汁培养基:在18 °P麦芽汁中分别加入2、3、4 g/L葡萄糖及麦芽糖的混合物(葡萄糖∶麦芽糖=1∶6,质量比)调节麦芽汁浓度至20~22 °P,115 ℃灭菌15 min备用。
1.1.2 实验试剂
葡萄糖、麦芽糖,国药集团化学试剂有限公司;α-葡萄糖苷酶(α-glucosaccharase,α-GC)试剂盒、乙醇脱氢酶Ⅱ(alcohol dehydrogenase Ⅱ,ADH Ⅱ)活性检测试剂盒,索莱宝科技有限公司。
1.1.3 仪器与设备
MMC-B1全自动高通量微生物液滴培养仪、ARTP-ⅡS常压室温等离子体诱变育种仪,无锡源清天木生物科技有限公司;IY1200自动细胞计数仪,上海睿钰生物科技有限公司;UVmini-1280型紫外-可见光分光光度计,日本岛津公司;WFJ 2100型酶标仪,上海尤尼柯仪器有限公司;200 L中试规模糖化及发酵配套生产线,克朗斯股份有限公司。
1.2 实验方法
1.2.1 ARTP诱变
从斜面上挑取出发菌株于10 mL麦汁培养基试管中活化,18 h后取10 μL菌液均匀涂布在载片表面,将涂好的载片以及洗脱液(1.5 mL EP管中加入1 mL无菌水)转移到ARTP诱变仪中,设置功率120 W,气量8 L/min,时间梯度0、10、20、30、40、50、60 s[15],等离子照射处理后将载片放至装有生理盐水的EP管中,进行振荡洗脱,并制成新的菌悬液,适当稀释后取100 μL涂布于平板上,25 ℃条件下培养,计算致死率,选择致死率85%~95%的处理时间为最适诱变时间。
1.2.2 全自动高通量微生物液滴培养仪驯化
挑取出发菌株于16 °P麦汁培养基中(10 mL/试管),25 ℃静置培养约18 h,按5%接种量进行转接,将培养基转入微生物液滴培养仪中,设定温度梯度(12、13、14、15 ℃)、麦汁培养基浓度(18、20、21、22 °P)、乙醇体积分数(0%、5%、8%、10%、12%),每个条件下生成10个液滴,分别测定不同条件下菌株的生长曲线,根据生长情况确定菌株的最优驯化条件。
将诱变后的菌液收集在5 mL新鲜的22 °P麦汁培养基中,转入微生物液滴培养仪中,设定参数如表1,于最佳驯化条件下对诱变菌进行培养,培养约4周后,选取生长情况最好的10个液滴进行斜面保存。

表1 实验参数的设定Table 1 Setting of experimental parameters
1.2.3 酶活力测定
突变菌细胞内的α-GC和ADHⅡ活力采用相应的试剂盒进行检测,测定方法详见试剂盒使用说明。
1.2.4 发酵实验
用接种环挑取优选菌株于10 mL麦汁试管中,25 ℃培养24 h后转接至100 mL麦汁中(随发酵体系的增大,种子液的培养量适当增加),25 ℃培养48 h后,取适量酵母泥接种至22 °P高浓新鲜麦汁中,接种量控制在1.8×107~2.0×107个/mL,14 ℃恒温发酵至糖度为6 °P时,封罐自然升压至(0.15±0.20) MPa,发酵8 d检测双乙酰,当双乙酰≤0.08 mg/L开始降温,24 h降至(0±0.5) ℃,贮酒7 d。
1.2.5 发酵液理化风味指标检测
酒精度、原麦汁浓度、发酵度、苦味值、双乙酰、残糖、总酸和pH等发酵液基本理化指标的检测均参照GB/T 4928—2008《啤酒分析方法》进行检测[16],风味物质参照王莉娜等[17]的方法测定。
1.2.6 数据处理
数据处理及作图使用 IBM SPSS Statistics 26.0和Excel软件完成。
2 结果与分析
2.1 ARTP诱变联合微生物液滴培养高通量筛选体系的建立
2.1.1 ARTP诱变参数确定
将对数生长中期的出发菌株进行ARTP诱变,如图1所示,随着离子束照射时间的增长,酵母细胞的存活率迅速下降。当照射时间达到60 s以上时,酵母细胞死亡率为100%;处理时间为35 s左右,致死率为87.9%。因此我们选定出发菌株进行ARTP诱变的照射处理时间为35 s。
2.1.2 微生物液滴培养驯化参数确定
对不同温度、麦汁浓度、乙醇体积分数条件下菌株02的生长曲线进行测定,如图2所示,随着温度的升高,菌株增殖速率加快;不同麦汁浓度下菌株生长情况差异不大,其中低浓度麦汁中菌株生长OD值偏高一些,但优势并不明显;菌株02在高浓环境下生长主要受到乙醇的抑制,乙醇体积分数达到10%,对菌株生长有明显的抑制,5%和8%时有轻微抑制;综合考虑,微生物液滴培养驯化参数为:培养温度为15 ℃;培养基为22 °P麦汁;驯化压力乙醇体积分数为5%~10%。
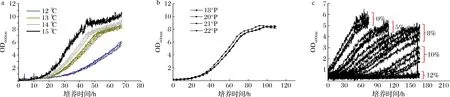
a-温度;b-麦汁浓度;c-乙醇浓度
2.2 高浓菌株的诱变选育
2.2.1 诱变及微生物液滴培养初筛
将出发菌株在ARTP诱变仪上处理35 s后,制成悬浮液转入微生物液滴培养仪中,选择“适应性进化”功能模块,按照设定参数运行。如图3,出发菌株经ARTP诱变后转入微生物液滴培养仪中,在不添加乙醇的麦汁中培养2代后转入5%乙醇体积分数的麦汁培养基;培养7代后提取生长状态较优的液滴然后转入7%乙醇体积分数的麦汁培养基,重复操作直到9%乙醇体积分数。
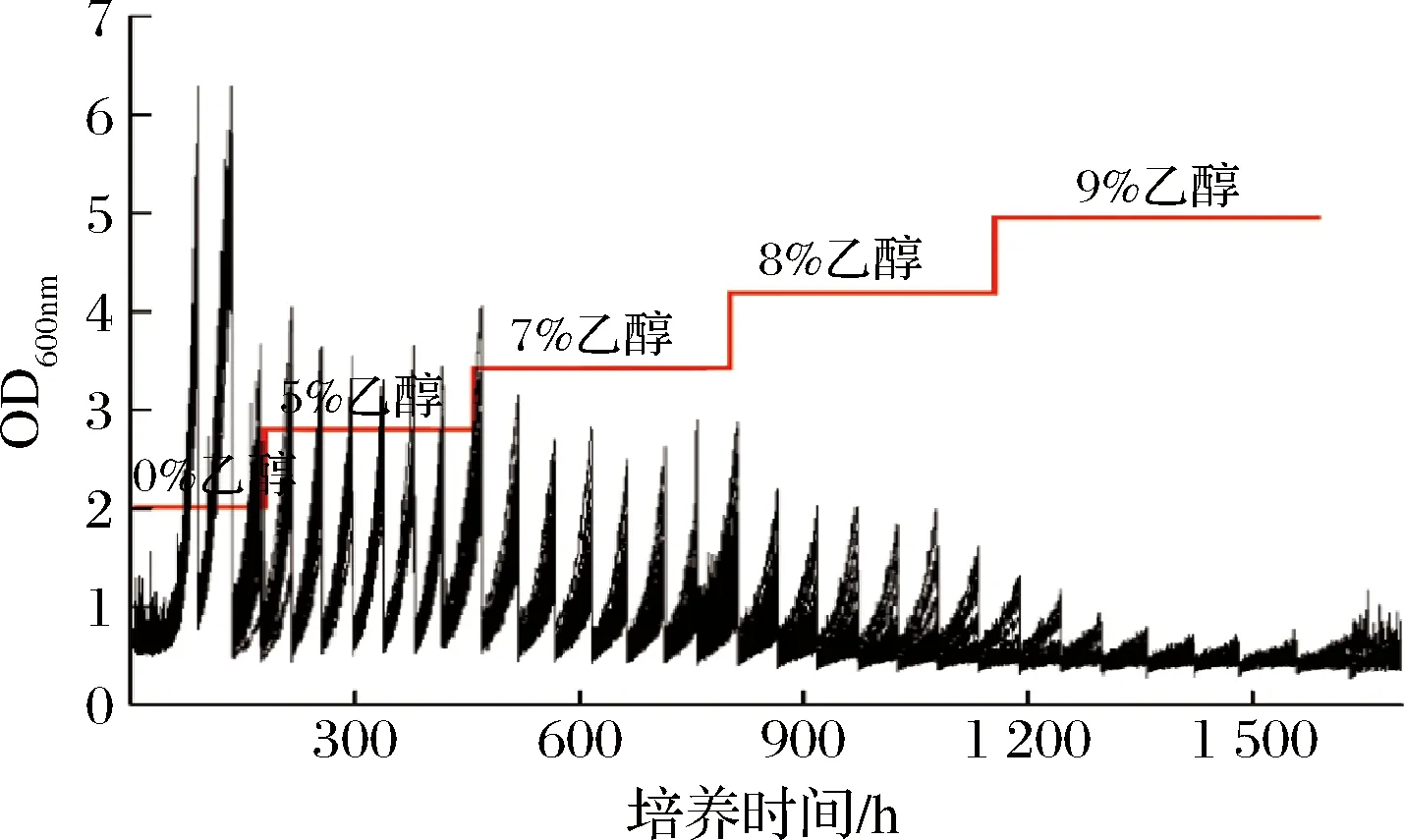
图3 微生物液滴培养驯化实验结果图Fig.3 Results of MMC domestication experiment
如图4所示,伴随乙醇体积分数的升高,菌株生长均受到抑制,生物量逐渐降低,各诱变菌在同一乙醇体积分数下的生长状态不尽相同,根据不同乙醇体积分数下分选液滴的状态,筛选出40株生物量较高的诱变菌株(如图4红点所示)。
2.2.2 糖代谢能力复筛
α-GC与ADHⅡ是酵母糖代谢与乙醇代谢过程中重要的酶,α-GC能够将麦芽糖、蔗糖、麦芽三糖等低寡聚糖分解为单糖,促进酵母对糖的吸收;乙醇在ADHⅡ作用下转化为乙醛,进而在乙醛脱氢酶的作用下生成乙酸,有助于缓解乙醇对酵母的毒害。检测α-GC和ADHⅡ的活性对监测酵母糖代谢过程是否正常以及筛选高乙醇耐受菌株具有重要意义[18-19]。对2.2.1节中获得的初筛菌α-GC及ADHⅡ活力进行检测,结果如图5所示。各诱变菌株的α-GC活力与乙醇梯度关联不明显,随着乙醇梯度的升高,酶活力并没有呈现明显的正相关或负相关,而ADHⅡ活力与乙醇梯度呈正相关,即随着乙醇体积分数的升高,酶活力数值也逐渐变大。综合酶活力和各菌株生长结果,筛选出7株糖代谢力强、耐高乙醇体积分数、生长优势明显的菌株。
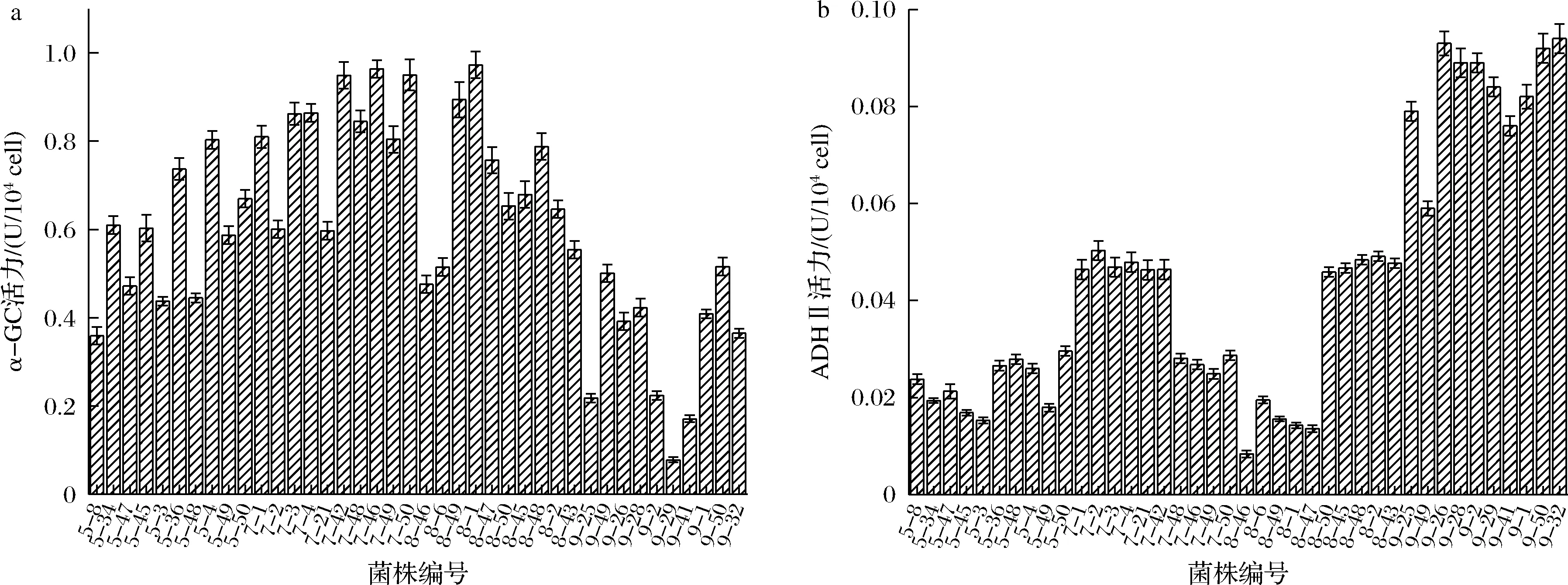
图5 各诱变菌株的α-GC(a)和ADHⅡ(b)活力结果Fig.5 Enzyme activity of α-GC(a) and ADHⅡ(b) of each mutant strain
2.2.3 实验室发酵
对2.2.2节中获得的7株诱变优良菌株进行2 L量筒发酵实验,检测发酵过程及发酵结束后的关键指标,结果见表2及表3。菌株8-2和9-50的增殖倍数更高,降糖速率更快,回收酵母泥的死亡率较低,这说明其在22 °P麦汁条件发酵时的细胞活性较好,耐受高浓能力更强。发酵结束后,菌株9-50的发酵度达到68.4%,发酵更完全,醇酯香气浓郁,口感更协调,所以选择菌株9-50进行中试规模测试。
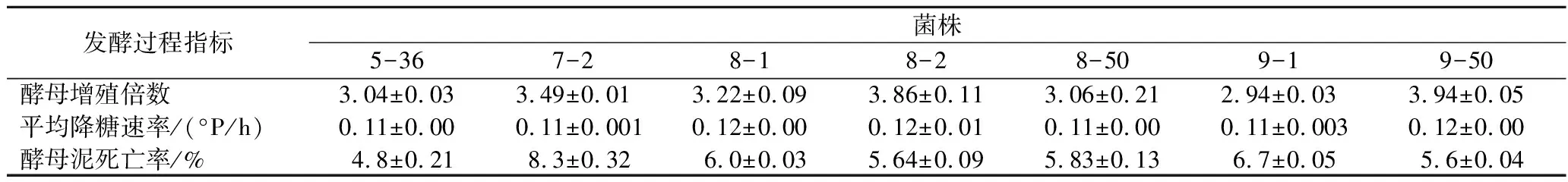
表2 诱变菌株的发酵过程指标Table 2 Indicators of fermentation process of mutant strains
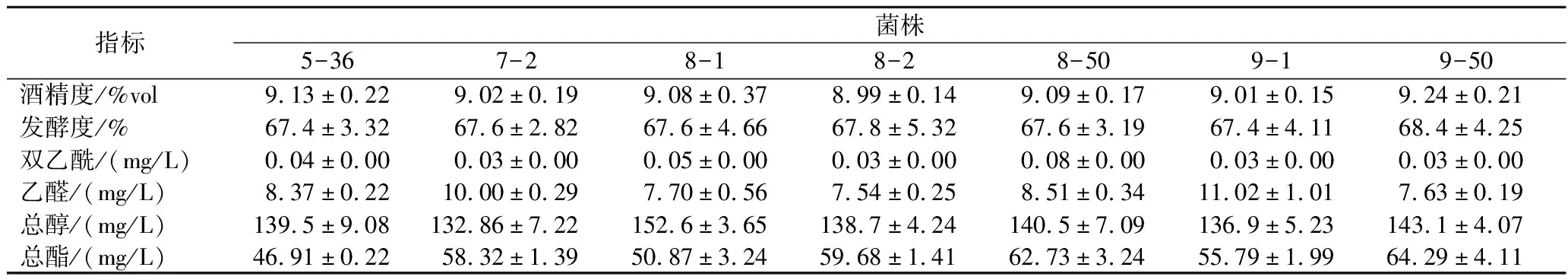
表3 发酵结束后的理化指标与风味指标Table 3 Physicochemical and flavor indexes of mutant strain at the end of fermentation
2.3 中试规模发酵
如图6所示,中试发酵过程中,菌株9-50的酵母增殖旺盛,无明显迟滞期,细胞死亡率低于5%,达到特定酒精度的发酵周期缩短42 h,而且后期酵母沉降较快,有利于酵母泥的回收传代,可见优选菌株能够快速适应高浓环境,迅速起酵,并且在高渗透压环境下表现出较好的细胞活性。吴卓凡[20]的研究也发现高浓酿造菌株M14在发酵后期糖利用较强,细胞性能下降较少,平板死亡率更低的现象,且与出发菌株相比,M14中与碳代谢及氨基酸代谢的基因发生了显著变化。郭璇[21]发现,高浓环境下酵母为抵抗高渗透压高乙醇,可能会抑制某些胞内蛋白的合成,从而造成发酵性能的改变。
从理论上讲,发酵性能良好的酵母泥,可使用多代。在实际生产过程中,由于酵母菌种本身的变化及外界微生物的污染,随着酵母使用代数的增加,其发酵性能和活力等会降低,死亡率、衰老比例等会有所上升,一般啤酒厂的优良菌种回收的酵母泥需控制在能连续使用5~7代[22]。表4展示了9-50与对照酵母泥的主要性能,2组的电导率、活力和自溶系数无显著性差异,菌株9-50的死亡率比对照菌低64%,与发酵过程中死亡率情况相对应,在凝聚性方面,9-50的凝聚性比对照菌高48.1%,符合发酵后期酵母沉降较快情况。

表4 回收酵母泥的相关指标Table 4 Indicators of yeast mud
发酵结束后贮酒7 d的成品酒理化风味指标检测结果(表5)显示,与对照菌相比,菌株9-50在原麦汁浓度略低于出发菌株的情况下,发酵度比对照组提高了约2%,这表明优选菌株9-50能更好的适应高浓环境,发酵更完全。乙醛是影响啤酒风味组成和风味稳定性最重要的醛类化合物,乙醛含量过高时会带来不愉快的青苹果味、青草味和氧化味等,进一步引起“上头”等不适生理反应[23],一般优质成熟的工业啤酒中乙醛质量含量在2~10 mg/L[24],菌株9-50发酵后的成品酒乙醛含量低于对照28.8%,这表明该菌株具有较好的乙醛还原能力。本次实验2组的总酯含量均偏高,主要是因为酯的形成与麦汁浓度息息相关,12 °P以下的麦汁一般不存在酯多的问题,但是超过一定限度(如>15 °P)时,即便接种量也按比例增加,由于代谢产物的增加,使脂肪酸的合成减少,酯的形成增加[25]。同时,发酵在14 ℃的高温下进行,有利于酯的生成,但优选菌株的总酯含量显著低于出发菌株11%。

表5 成品酒理化指标与风味物质含量Table 5 Physicochemical indexes and flavor content of finished beer
2.4 遗传及发酵稳定性实验
诱变选育获得的菌株易发生优势性状的回复突变,其稳定性需要进行长时间的针对性驯化和适宜的保藏方法来维持。对优选菌株9-50持续进行4个月的高浓麦汁驯化实验,连续传代20次后,分别取第0、1、2、5、10、15、20代进行发酵验证。由图7可知,经过多次传代后,菌株的增殖倍数稳定在4左右,降糖时间稳定在160 h,且随着驯化传代次数的增加,细胞死亡率在10代之后显著降低,维持在2%~3%之间,具有良好的遗传稳定性。发酵结束后的关键理化风味指标结果显示(表6),各代菌株发酵后的酒精度、发酵度无明显差别,酒精度可达到10%vol,发酵度基本在65%左右,高级醇(总醇)波动在160~180 mg/L,挥发酯(总酯)含量在10代以后呈现小幅增加,但整体维持在60~80 mg/L,具有较好的发酵稳定性。
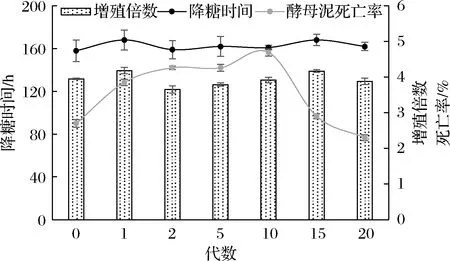
图7 不同代数的发酵过程指标Fig.7 Fermentation process index of different algebras
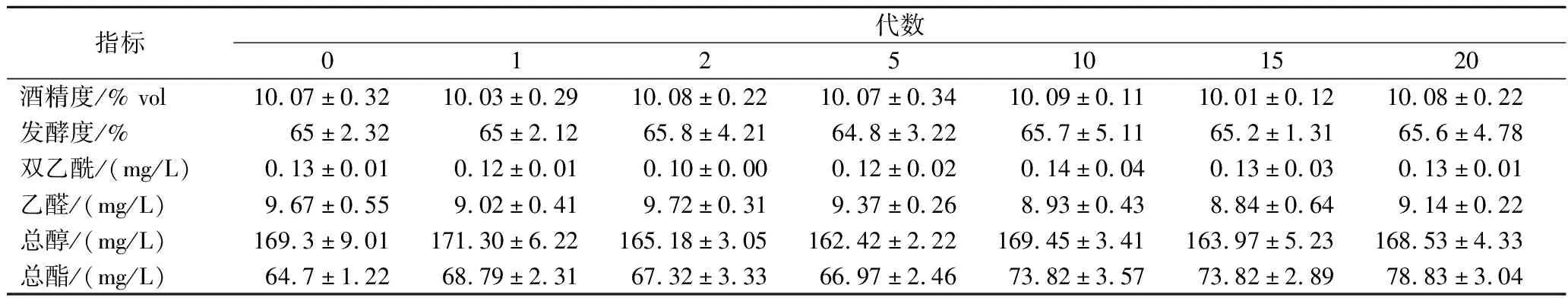
表6 发酵结束后理化指标与风味物质含量Table 6 Physicochemical index and flavor content after fermentation
3 结论
本研究基于微液滴培养技术选育超高浓酿造菌株,建立了ARTP诱变联合液滴微流控技术选育高浓酿造菌株的方法,确定了微流控选育的最佳驯化条件:培养温度为15 ℃,麦汁浓度22 °P,驯化的乙醇体积分数为5%~10%,应用该方法选育得到高浓酿造菌株9-50,该菌株乙醇脱氢酶活性高,可以耐受9%的乙醇体积分数。在22 °P,14 ℃条件下发酵,与出发菌株相比,增殖旺盛,降糖时间缩短42 h,发酵度>66%,双乙酰含量0.06 mg/L,乙醛含量降低28.8%,挥发酯含量降低11%,醇酯香气较协调,具有良好的工业应用前景。

