加热温度对鳜鱼肌原纤维蛋白凝胶特性的影响
李苓,杨明柳,周迎芹,殷俊峰,陈小娥,谢宁宁*
1(浙江海洋大学 食品与药学学院,浙江 舟山,316022)2(安徽省农业科学院农产品加工研究所,安徽 合肥,230031)3(崇左幼儿师范高等专科学校 经济贸易系,广西 崇左,530022)
肌原纤维蛋白是鱼肉中的主要蛋白质,主要由肌球蛋白、肌动蛋白、肌动球蛋白组成,其热诱导凝胶与肉制品的理化和功能特性均有密切关系[1]。肌原纤维蛋白具有良好的胶凝潜力,在加热过程中,该蛋白变性、展开和聚集形成新的稳定的高分子蛋白体系,并产生良好的质构和口感[2]。在这种热不可逆凝胶形成过程中,蛋白质天然结构解体展开,其巯基[3]、二级结构[4]和水分状态[5]发生重要变化,而肌原纤维蛋白凝胶的功能特性与这些变化有特定的关联性。
鳜鱼(Sinipercachuatsi)属于鲈形目、鳜属,别名桂鱼,是我国特有的淡水鱼类,其肉质鲜美,鱼体肉多刺少、营养丰富,深受消费者喜爱。随着中国经济发展和人民生活水平提高,名特优鱼类消费市场日益扩大,相关渔业养殖产业得到快速发展。而鳜鱼季节性强,大多以鲜活销售,暂养耗氧量大不易存活,这导致了大量鳜鱼不能被市场及时消化、积压于市,一旦失去食用价值将造成极大的经济损失,严重时还会污染环境破坏水质[6]。鳜鱼的精深加工是实现鳜鱼系列化、多样化和高附加值方向发展的根本途径。肌肉的来源和类型影响其凝胶特性。目前,针对镜鲤[7]、大黄鱼[8]和鱿鱼[9]等肌原纤维蛋白凝胶特性的研究较多,然而,对鳜鱼肌原纤维蛋白凝胶特性的研究非常缺乏。本团队前期开展了谷氨酰胺转胺酶对鳜鱼鱼糜凝胶中肌原纤维蛋白影响的研究[10],积累了一定的研究基础。
因此,本研究以鳜鱼肌原纤维蛋白为研究对象,利用凝胶强度、质构和巯基含量检测指标,运用凝胶电泳、低场核磁共振和拉曼光谱技术手段,研究不同加热温度下肌原纤维蛋白凝胶的蛋白特性、二级结构和水分迁移状态的规律性变化,探讨加热过程中鳜鱼肌原纤维蛋白胶凝的机理,以期为鳜鱼制品的工业化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜活鳜鱼购买于安徽省合肥市庐阳区谊品生鲜超市。
NaCl、NaH2PO4、Na2HPO4、尿素、EDTA、SDS、HCl、KCl、无水乙醇,所有试剂均为分析级或更高等级,国药集团化学试剂有限公司。
1.2 仪器与设备
高速分散乳化仪,上海弗鲁克公司;HH-6数显恒温水浴锅,上海力辰邦西仪器科技有限公司;In Via-Reflex拉曼光谱仪,法国Renishaw公司;MesoMR23-060H-I 纽迈低场核磁共振分析仪,上海纽迈电子科技有限公司;TA XT Plus质构仪,英国Stable Micro System公司。
1.3 实验方法
1.3.1 鳜鱼肌原纤维蛋白质的提取和凝胶制备
参照WANG等[11]的方法稍作修改。取鳜鱼背部肌肉,置于绞肉机中,低速搅拌30 s,得到鳜鱼碎肉,加入4倍体积的缓冲溶液(50 mmol/L NaH2PO4/Na2HPO4,100 mmol/L NaCl,2 mmol/L MgCl2,1 mmol/L EDTA,pH 6.8)于高速匀浆机均浆,4 ℃、3 500×g离心15 min,保留沉淀物重复2次。在沉淀物中加入4倍体积的100 mmol/L的NaCl溶液匀浆2 min,离心15 min,重复该操作1次,在最后1次洗涤中匀浆液通过4层滤布过滤,除去结缔组织,离心前用0.1 mol/L HCl溶液调pH值至6.0,4 ℃、3 500×g离心15 min,沉淀即为肌原纤维蛋白。参考张顺治等[12]的方法,将上述蛋白质加入20 g/L NaCl溶液,调节水分含量为76%,搅拌均匀,加入50 mL离心管中,然后将其置于相应设定温度(40、50、60、70、80、90 ℃)的恒温水浴锅中加热30 min。加热完立即放入冰水中转至室温,4 ℃冰箱中保存过夜后进行指标测定。
1.3.2 凝胶强度的测定
将鳜鱼凝胶样品切成2.0 cm高的圆柱体,置于质构仪上,用直径5 mm的球形探针(p/5 s)测定凝胶强度。测定破断力(g)和破断距离(cm),凝胶强度(g·cm)为两者的乘积。
1.3.3 质构的测定
参考杨明柳等[10]的方法。将凝胶样品切成1.5 cm 高的圆柱体,使用直径35 mm的圆柱形探头(p/50)放在质构仪上测定,具体参数设定:触发类型Auto(Force)、触发力5.0 g,测试前速度1.0 mm/s,测试中速度5.0 mm/s,测试后速度5.0 mm/s,变形量10 mm。
1.3.4 巯基含量测定
参考ZHANG等[13]的方法稍作修改。称取2 g凝胶样品,切碎后与10 mL 0.6 mol/L NaCl+8 mol/L尿素混合,高速匀浆 2 min,4 ℃下静置1 h,10 000×g离心15 min,测定上清液中蛋白质的含量,将0.5 mL(4 mg/mL)上清液加入4.5 mL 0.2 mol/L Tris-HCl缓冲液(pH 8.0, 8 mol/L尿素、5 mmol/L EDTA、10 g/L SDS)中,混合均匀。随后,取4 mL混合物添加0.4 mL的10 mmol/L DTNB(溶解在10 mmol/L Tris-HCl pH 8.0),40 ℃加热30 min。在412 nm测量吸光度(空白为0.6 mol/L KCl)。巯基含量计算如公式(1)所示,结果表达为mol/105g蛋白。
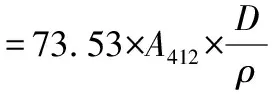
(1)
式中:73.53,106/13 600(13 600为Ellman试剂的摩尔消光系数)计算得出;A412,412 nm处的吸光度;D,稀释倍数;ρ,蛋白质浓度。
1.3.5 SDS-PAGE分析
每2 g凝胶样品中加入18 mL 50 g/L SDS,均质2 min,80 ℃加热1 h,冷却至室温,8 000×g、4 ℃离心20 min,弃沉淀留上清液,取10 μL 5×上样缓冲液,20 μL上清液,95 ℃加热10 min,6 000×g离心2 min,样品制备完成,选用体积分数15%分离胶和体积分数5%浓缩胶进行电泳。电泳全程电压250 V,待溴酚蓝到达底部时结束。置于摇床上用考马斯亮蓝R250染色过夜,用乙醇-醋酸脱色液脱色4 h后采集图像。
1.3.6 拉曼光谱分析
参照FENG等[14]的方法,取约1.5 g样品置于载玻片上,激光器波长532 nm,激光功率100 mW,扫描范围3 300~400 cm-1,光谱分辨率2.0 cm-1,扫描样本次数3次,曝光次数60次,采集数据1 cm-1,速度120 cm-1/min。测试完成后以苯丙氨酸(1 003 cm-1)为标准进行归一化。使用 Peakfit 4.12 进行蛋白质酰胺Ⅰ带(1 600~1 700 cm-1)的分析,依次进行基线校正、去卷积、二阶导数拟合,根据各子峰面积计算肌原纤维蛋白二级结构相对含量。
1.3.7 低场核磁共振测定水分状态
按照GUO等[15]报道的方法使用低场核磁共振分析仪测定了凝胶的弛豫时间。平衡至室温下的2 g的鳜鱼肌原纤维蛋白凝胶放置在核磁管中,T2的测量参数主要包括:共振频率 20 MHz,TW=4 500 ms,TE=0.5 ms,NS=4,NECH=18 000。
1.4 数据统计与分析
使用Excel 2010和 Origin 2017软件处理数据并绘图,SPSS 21.0进行单因素ANOVA判断(邓肯检验),P<0.05表示具有显著性差异。
2 结果与分析
2.1 加热温度对鳜鱼肌原纤维蛋白凝胶强度的影响
如图1所示,鳜鱼肌原纤维蛋白凝胶强度随着温度的升高而增加,其中50~80 ℃变化不显著(P>0.05),40~50 ℃与80~90 ℃的凝胶强度升高显著(P<0.05),总之,90 ℃与40 ℃相比变化显著,前者是后者的4倍左右。肌原纤维蛋白是凝胶形成的核心蛋白,有研究表明肌球蛋白变性温度为46.56~54.78 ℃[16],肌动蛋白的变性温度为70 ℃左右[17]。在50 ℃时,肌球蛋白分子通过其球状头部形成初始聚集体,尾部向外辐射[1]。即加热温度50 ℃左右时肌球蛋白变性,空间结构展开后部分蛋白分子重新聚集,从而逐渐形成稳定的蛋白质凝胶,在70 ℃加热处理后,大量球状物质通过肌球蛋白尾部结合发生交联,形成稳定的蛋白质凝胶结构[18],此时,水与蛋白质形成稳定的相互作用,维持肌原纤维蛋白凝胶结构的稳定,因此50 ℃时的凝胶强度较40 ℃显著增加,并且随着加热温度继续升高,肌原纤维蛋白凝胶的强度进一步增加,可能是由于肌球蛋白与肌动蛋白不断发生变性和聚集,并且高温作用使部分水分溢出,进一步强化了凝胶强度[19]。
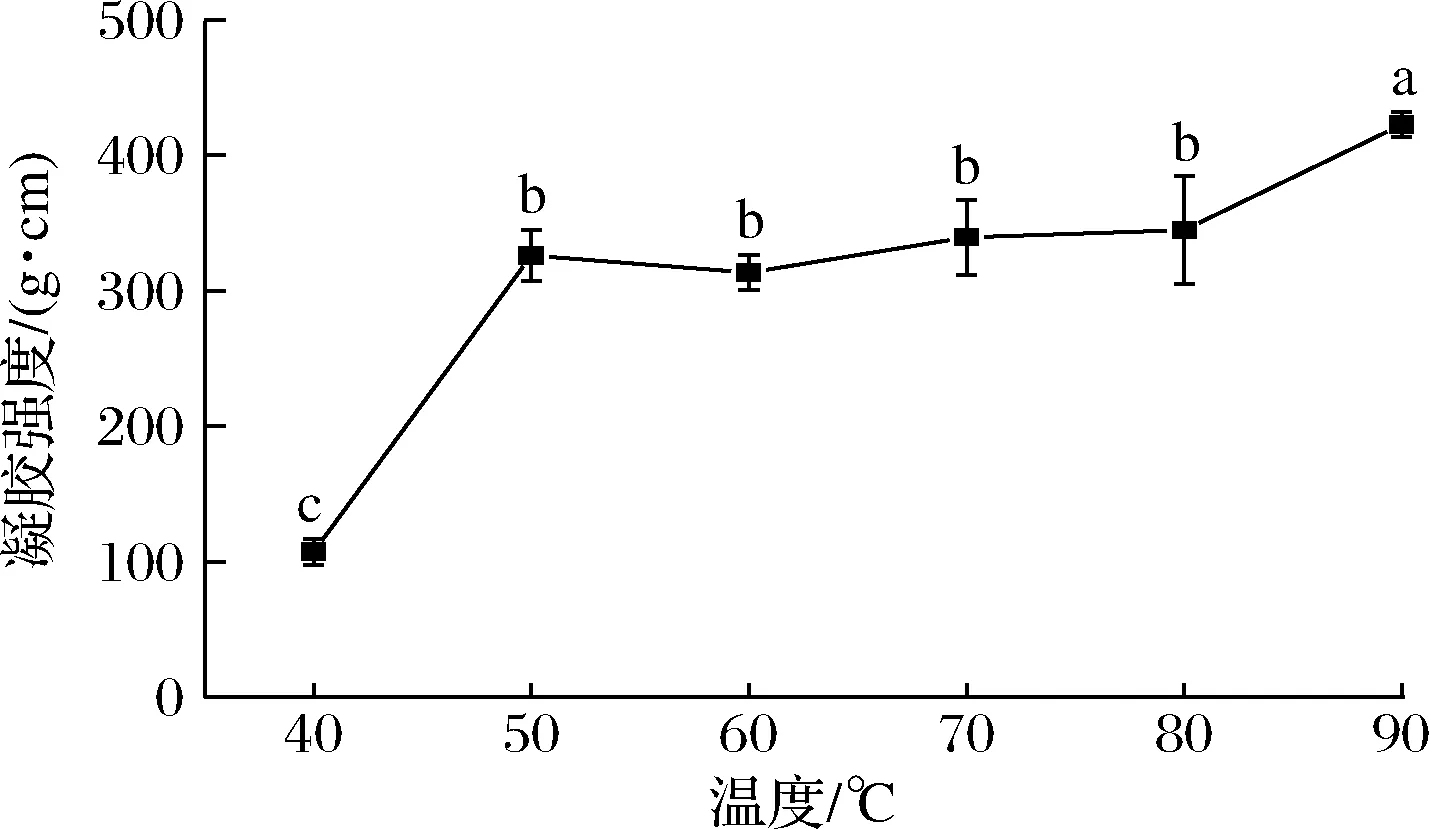
图1 加热温度对鳜鱼肌原纤维蛋白凝胶强度的影响Fig.1 Effect of heating temperature on the gel strength of mandarin fish myofibrillar protein注:不同小写字母表示具有显著性差异(P<0.05) (下同)。
2.2 加热温度对鳜鱼肌原纤维蛋白凝胶质构的影响
如图2-a,硬度随着温度的升高呈现先增加后降低的趋势,其中40~50 ℃的增加量大于50~80 ℃,前者是后者的4倍左右,90 ℃的值略低于80 ℃,弹性(图2-b)具有与硬度类似的变化规律,这与童今柱[20]研究结果相一致。说明加热会使鳜鱼肌原纤维蛋白凝胶硬度和弹性逐渐变大,可能是由于鳜鱼肌原纤维蛋白的内部结构随着温度的升高而变化,暴露出更多的官能团,使蛋白质变性和聚集形成不可逆的凝胶,从而使凝胶的硬度和弹性增加。在80 ℃下肌原纤维蛋白凝胶硬度和弹性达到最大值,原因可能是肌球蛋白和肌动蛋白的内部亚基完全暴露出来,亚基之间的重新相互作用形成了稳定的蛋白质凝胶结构[21]。而在 40 ℃时硬度、弹性、黏聚性、胶黏性、咀嚼性和回弹性都显著低于其他温度(P<0.05),蛋白内部亚基包埋没有暴露,蛋白与水之间未能进行相互作用,可能还没有形成凝胶的过程。在50~70 ℃时蛋白开始逐渐变性、结构展开,但还有一部分蛋白相互之间交联重新聚集不完全。在90 ℃时肌原纤维蛋白凝胶由于高温破坏了蛋白本身结构,未能在变性后相互之间充分聚合,凝胶的硬度和弹性也就相对降低[22]。胶黏性(图2-d)随着温度的升高而升高,其中,40~50 ℃时涨幅很大(P<0.05),50~90 ℃变化不明显(P>0.05),咀嚼性(图2-e)具有与胶黏性类似的变化规律。回弹性(图2-f)随着温度的升高呈现出先增加后降低又增加的规律,黏聚性(图2-c)具有与回弹性类似的变化规律。总的来说,肌原纤维蛋白凝胶在40 ℃时未形成凝胶的网络结构,质构数值很小,随着温度升高凝胶的稳定结构开始逐渐形成,质构整体数值增大,在80 ℃时凝胶最好。

a-硬度;b-弹性;c-黏聚性;d-胶黏性;e-咀嚼性;f-回弹性
2.3 加热温度对鳜鱼肌原纤维蛋白凝胶巯基含量的影响
巯基是蛋白质中大量活性功能基团的重要组成部分,疏基总量的变化反映了二硫键的形成情况。如图3所示,巯基含量在40~90 ℃升温过程中随着温度的升高而显著降低(P<0.05),一方面可能是温度的升高导致蛋白质结构展开,内部巯基基团暴露出来,暴露的巯基基团易被氧化形成二硫键;另一方面可能是加热使蛋白质变性后形成聚集体,堆积在蛋白表面,形成屏障,使之前暴露的总巯基重新包埋,检测到的总巯基含量降低[23]。这与上述凝胶强度的结果相对应,并证明了二硫键是引起蛋白质聚集体形成的主要作用力之一[24]。BUAMARD等[3]研究加热温度对沙丁鱼蛋白总巯基的影响发现,蛋白总巯基含量随着加热温度的升高而降低。畅鹏等[25]研究加热温度对镜鲤鱼巯基的影响也得到同样结论。

图3 加热温度对鳜鱼肌原纤维蛋白凝胶巯基含量的影响Fig.3 Effects of heating temperature on the content of sulfhydryl groups in mandarin fish myofibrillar protein gel
2.4 加热温度对鳜鱼肌原纤维蛋白凝胶SDS-PAGE的影响
SDS-PAGE中的迁移速率决定了蛋白质的分子质量大小。如图4所示,依据分子质量的大小这些蛋白条带分别属于:肌球蛋白轻链(17~20 kDa)、肌原蛋白(33 kDa)的一个亚基、原肌球蛋白(36 kDa)、肌动蛋白(43 kDa)、肌球蛋白重链(220 kDa),与LAMETSCH等[26]的研究结果相一致。其中,肌球蛋白重链和肌动蛋白的电泳条带较宽,肌球蛋白轻链电泳条带很浅,表明肌原纤维蛋白的主要成分是肌球蛋白重链和肌动蛋白,这与CORTÉS-RUIZ等[27]的研究结果一致。在40~80 ℃时,肌动蛋白条带颜色逐渐加深,再继续升温到90 ℃,条带颜色变浅,原因是温度升高肌动蛋白发生聚集现象,形成聚集体,达到80 ℃时,聚集基本完成,随着温度继续升高到90 ℃,蛋白原本维持结构稳定的分子内相互作用力被破坏,蛋白降解导致条带变浅。而肌原蛋白和肌球蛋白轻链在40~50 ℃时,未有条带出现,直到温度升高到60~80 ℃,条带显示出来,而到90 ℃条带颜色变浅,原因是在40~50 ℃温度较低时,蛋白没有发生变性聚集,条带未显示,而升温促使基团暴露,条带显示出来,温度升高到80 ℃时条带基本完全暴露,再继续升温导致了蛋白降解,所以升温到90 ℃时肌原蛋白和肌球蛋白轻链条带变浅。

图4 加热温度对鳜鱼肌原纤维蛋白凝胶SDS-PAGE的影响Fig.4 Effect of heating temperature on SDS-PAGE of mandarin fish myofibrillar protein注:M为标准蛋白Marker;40~90分别为40、50、60、70、80、90 ℃。
2.5 加热温度对鳜鱼肌原纤维蛋白凝胶二级结构的影响
拉曼光谱法具有无损检测、操作简单的特点,常被用于检测蛋白的二级结构。酰胺Ⅰ区(1 600~1 700 cm-1)的变化通常用来表示蛋白质二级结构的变化,酰胺Ⅰ谱带由1 650~1 660、1 660~1 665、1 665~1 680和1 680 cm-1附近的重叠谱带组成,分别代表α-螺旋结构、无规则卷曲结构、β-折叠结构和β-转角结构[14]。肌原纤维蛋白二级结构的定量分析可以从酰胺I谱带测量如图5所示,随着加热温度的升高,α-螺旋和无规则卷曲减少,β-折叠和β-转角的比例增加。与40 ℃相比,当加热温度为 90 ℃时,肌原纤维蛋白的α-螺旋占比降至 25.69%,下降了15.30%,此时β-折叠的比例达到最大值,为46.90%,增加了14.70%,80 ℃与90 ℃相比α-螺旋含量无明显变化。α-螺旋含量的减少主要是由于加热导致蛋白质变性,使得羰基和氨基间的氢键作用被破坏,促进α-螺旋的去折叠,结构展开,导致α-螺旋转化为β-折叠和β-转角[28], 所以β-折叠和β-转角含量升高。XU等[4]研究发现半透明类型蛋白质凝胶的共同特征是α-螺旋含量的减少和β-折叠含量的增加,并且在30~70 ℃范围内诱导的肌原纤维蛋白的凝胶强度与β-折叠和β-转角的含量呈正相关,与本实验结果一致。此外,在高温处理下暴露于疏水基团和蛋白质聚集也会导致β-折叠量的增加。所以,二级结构比例的变化说明温度升高使肌原纤维蛋白的α-螺旋、无规则卷曲向β-折叠和β-转角转化。畅鹏等[25]研究了加热温度对镜鲤鱼蛋白结构与其凝胶聚集的相关性,发现蛋白β-折叠结构相对含量的增加能够提高蛋白质凝胶性,与本研究结果相似。

图5 不同温度下鳜鱼肌原纤维蛋白凝胶的二级结构Fig.5 Secondary structure of mandarin fish myofibrillar protein gels at different temperatures
2.6 加热温度对鳜鱼肌原纤维蛋白凝胶水分状态的影响
通过测量T2弛豫时间,可以获得关于肌原纤维蛋白凝胶内部水分状态、水分分布以及水与大分子的结合状态[29]。如图6所示,凝胶弛豫时间(T2)在0~10 000 ms内出现了3个峰,这与HAN等[5]研究结果一致。T2范围内相应的3个峰分别对应凝胶中水的3种状态,鳜鱼肌原纤维蛋白凝胶中具有T21(0.01~10 ms)、T22(40~300 ms)和T23(600~6 500 ms)峰,分别为结合水、不易流动水和自由水,其对应的 3个峰的面积比分别记为 PT21、PT22、PT23。凝胶中的水大部分为不可流动水(图6)。ZHUANG等[30]研究表明,弛豫时间长的水分表明其与大分子结合越松散,而弛豫时间短能使水和大分子之间更容易结合且结合更紧密。如表1所示,在40~70 ℃时,PT22峰值无明显变化,在70~90 ℃随着处理温度的升高,T22的峰值变低,T22的弛豫时间变长,这说明在70 ℃后随着温度的升高,凝胶中的水的可动性越来越强,凝胶的持水能力变差,保水性相应降低。由弛豫谱可以看出,在70 ℃出现了极少量自由水的弛豫峰,含量为0.049%,在90 ℃时比例达到最大值1.482%,并且在70~90 ℃弛豫时间逐渐变小,说明鳜鱼肌原纤维蛋白凝胶中的一部分不易流动水可能变成了自由水,这可能是提高加热温度破坏肌原纤维蛋白的凝胶结构,使肌原纤维变性和收缩失去水分,破坏氨基酸侧链基团和肽键,这就会导致肌原纤维蛋白水合能力受到影响,部分结合水可转化为自由水并逸出[31],凝胶保水性降低。所以温度升高到90 ℃时,不易流动的水相对含量降低, 自由水相对含量升高, 凝胶保水性降低。
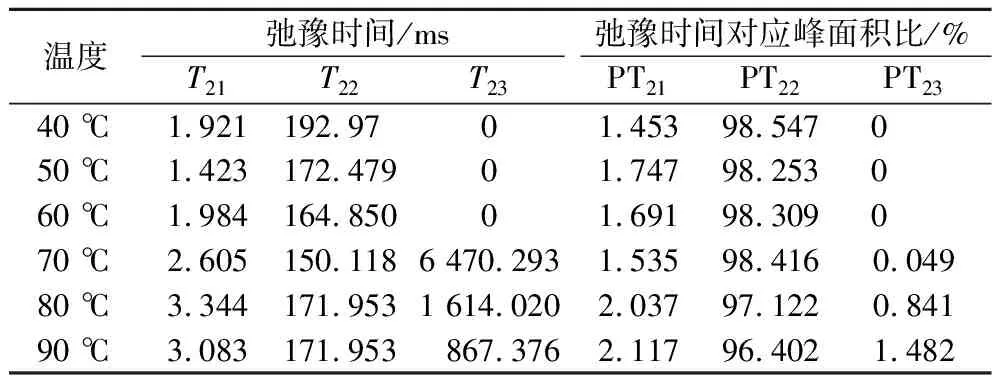
表1 不同温度下鳜鱼肌原纤维蛋白凝胶的T2峰面积比Table 1 T2 peak area ratios of mandarin fish myofibrillar protein gels at different temperatures

图6 不同温度下鳜鱼肌原纤维蛋白凝胶的T2弛豫时间Fig.6 T2relaxation times of mandarin fish myofibrillar protein gels at different temperatures
3 结论
加热温度的变化使得鳜鱼肌原纤维蛋白结构发生变化,引起蛋白质之间发生变性聚集。加热温度为40 ℃时,凝胶强度和质构值最低,巯基含量以及二级结构的α-螺旋含量最高,目前可能还没有形成凝胶的过程;从50 ℃开始,随着温度的升高,巯基含量减少,凝胶强度逐渐增强,硬度和弹性也逐渐增加,蛋白二级结构的α-螺旋含量的减少和β-折叠含量的增加同时也表明了温度升高可以提高蛋白的凝胶性;但是温度继续升高到90 ℃后,凝胶的硬度和弹性降低了,并且凝胶的水分状态有部分从不易流动水转化成了自由水逸出,保水性变差。SDS-PAGE结果也表明温度升高到90 ℃时部分条带变浅、蛋白被降解。说明在温度达到80 ℃时鳜鱼肌原纤维蛋白可能已基本完成了变性、展开和聚集过程,形成新的稳定的高分子蛋白体系,热诱导凝胶基本稳定。所以,80 ℃左右鳜鱼肌原纤维蛋白热诱导凝胶状态最佳,此结果可为以后开发高品质凝胶鳜鱼肉制品提供理论依据。

