纳米氧化锌对牛粪厌氧消化水解酸化进程的影响研究
齐路晴,刘旭娜,卢媛媛,杨 平,庞丽娜,2*
(1.四川大学 建筑与环境学院,四川 成都 610065;2.爱丁堡大学 工程学院,英国 爱丁堡 EH9 3JL)
畜禽粪便引发的环境和公共安全问题倍受关注[1]。厌氧消化是畜禽粪便常用的资源化处理方法之一,主要包括水解酸化、产氢产乙酸和产甲烷阶段[2]。其中,水解酸化是畜禽粪便厌氧消化的重要限速步骤,其进程会受众多因素的影响,包括含重金属、抗生素等的外源饲料添加剂,直接影响后续的产沼气过程[3]。纳米氧化锌(zinc oxide nanoparticles,ZnO NPs)具有较高的生物利用率,近年来常替代传统氧化锌作为饲料添加剂在畜禽养殖业中应用,若施用不当,会造成ZnO NPs在畜禽粪便中大量残留,进而可能影响水解酸化的进程[4]。程书波等[5]发现120 mg/L ZnO NPs能抑制污泥中有机物的溶出,阻碍大分子有机物的水解。再者,ZnO NPs还会降低厌氧消化体系中蛋白酶和纤维素酶的活性,抑制溶解性多糖(soluble polysaccharides,SC)和溶解性蛋白质(soluble proteins,SP)的降解,例如,前期研究指出50 mg/g总固体(total solids,TS)的ZnO NPs能够使体系中SP和SC的降解效率分别降低35.57%和28.61%[6-7]。此外,ZnO NPs(5~500 mg/L)还会抑制挥发性脂肪酸(volatile fatty acids,VFAs)的转化,造成大量VFAs在厌氧消化系统中积累,从而影响厌氧消化后续的产氢产乙酸过程及最终产甲烷效果[8]。然而,底物不同也会造成厌氧消化效果的显著差异,当前ZnO NPs对厌氧消化过程中水解酸化阶段的影响研究多集中在剩余污泥体系,对畜禽粪便厌氧消化过程中水解酸化的动态影响及深层机制尚缺乏认识。因此,本研究旨在探讨不同浓度ZnO NPs对畜禽粪便厌氧消化中水解酸化进程的影响及作用机制,为外源污染下的畜禽粪便资源化利用提供理论参考。
1 材料与方法
1.1 纳米氧化锌和畜禽粪便
ZnO NPs干燥颗粒购买于中国阿拉丁试剂有限公司,纯度为99.8%,粒径80~100 nm。试验使用的10 g/L ZnO NPs悬浮液制备步骤为:ZnO NPs与超纯水通过磁力搅拌混合30 min之后,于25 ℃、250 W、40 kHz的条件下超声1 h,备用[9]。
牛粪作为本研究中的厌氧消化基质,取自四川巴中,混合均匀后放入冰箱冷冻储存。牛粪的主要理化性质测定结果为:总固体含量(TS)为27.38%±5.23%(质量比),挥发性固体(volatile solids,VS)含量为23.97%±4.56%(质量比),总有机碳(total organic carbon,TOC)含量为352.72±25.70 mg/g TS。
1.2 试验设计
牛粪厌氧消化试验装置采用BIOPROCESS自动甲烷潜力测试仪。反应瓶均置于水浴锅中,单个反应瓶总体积为650 mL,工作体积为400±10 mL。产生的沼气经NaOH吸收瓶后通入气体计量单元。试验前,依次向反应瓶中通入氮气以实现厌氧反应条件。根据文献调研,当前锌在畜禽粪便中的浓度范围介于39.5~11 379.0 mg/kg(干重)[10-11],相当于49.2~14 180.0 mg/kg(干重)的ZnO。此外,含ZnO NPs的饲料添加剂应用或者管理不当可能导致ZnO NPs含量极高。据此,本研究共设置3个试验组G1、G2、G3和1个对照组G0。其中G1、G2和G3分别添加5、30和100 mg/g TS的ZnO NPs,涵盖了ZnO NPs在畜禽粪便中的正常水平和极端水平,可为ZnO NPs饲料添加剂应用中的畜禽粪便处理处置和重金属污染评价提供参考。牛粪厌氧消化正式试验共运行30 d,并且采集第0、1、6、14、22、30天的样品用于后续分析。试验前用3 mol/L的NaOH溶液调节初始pH。牛粪厌氧消化条件为55 ℃、TS=6%、初始pH=10。
1.3 指标测定
1.3.1 理化指标测定 牛粪厌氧消化中水解酸化进程的理化指标分析项目包括溶解性化学需氧量(soluble chemical oxygen demand,SCOD)、SC、SP、VFAs、pH、TS和VS。测定方法如表1所示。
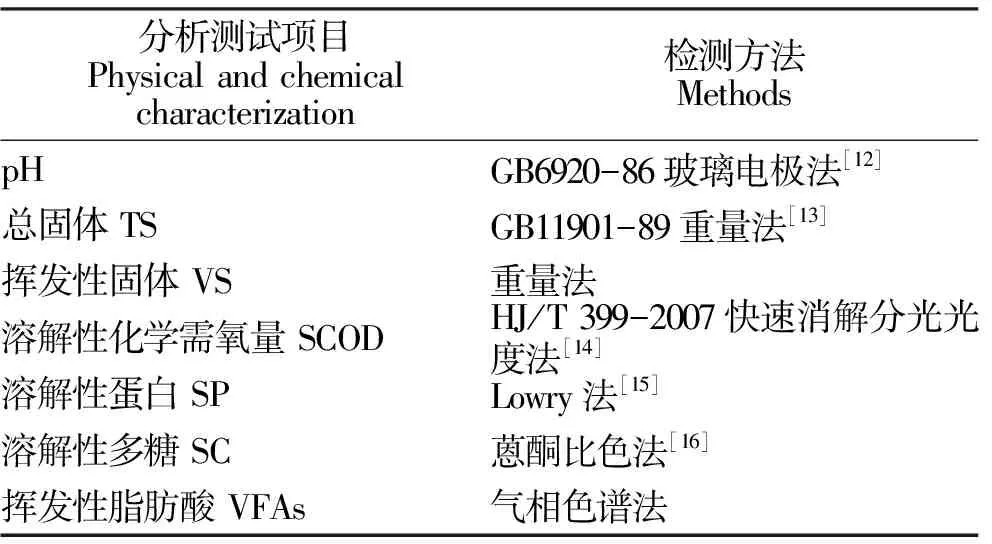
表1 理化性质测定方法
由于乙酸、丙酸和丁酸是牛粪厌氧消化水解酸化阶段产生的主要VFAs,因此对其进行定量检测以表征酸化效果。本研究中3种VFAs均使用气相色谱法进行定量分析,其色谱柱型号为DB-FFAP(30 m×0.32 mm×0.25 μm),检测器为火焰离子检测器,单次进样2 μL,每个样品测3次,取平均值分析,气相色谱法调用的方法数参考之前的研究[17]。根据3种待测VFAs在色谱柱中停留时间(出峰时间)的差异,计算对应峰面积的大小,得到样品中VFAs的含量。总挥发性脂肪酸(total volatile fatty acids,TVFAs)的浓度为乙酸、丙酸和丁酸浓度之和。考虑到上述VFAs分子量的差异,统一将单位换算为mg COD/g TS。

PCR扩增产物回收纯化并检测定量后,使用NEXTFLEX Rapid DNA-Seq Kit构建PE文库,在Illumina公司的Miseq PE300平台进行测序。测序得到的原始序列使用fastp[19]进行质控,并通过FLASH对序列进行拼接[20]。通过UPARSE[21]对质控拼接后的序列进行OTU聚类,并导出OUT表格,最后用RDP classifier进行物种注释,比对Sliva 16S rRNA的数据库(v183)得到物种的相对丰度[22]。最后通过美吉生物云平台提供的在线工具进行生物信息分析和可视化处理。
1.4 数据处理
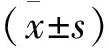
2 结果与分析
2.1 水解产物的变化
SCOD、SP和SC的浓度变化趋势如表2所示。SCOD浓度:G0组在第1天达到最高(114.49±3.86 mg/gTS)后开始下降;而第1天之后G1~G3组SCOD的含量始终高于G0,且整体呈现上升趋势,到第30天分别增加了24.16%、18.94%和20.02%。不同浓度ZnO NPs对SCOD含量的影响从第6天开始具有显著差异(P<0.05),其中G1组在第6、14、22天SCOD浓度显著高于其它3组(P<0.05)。

表2 ZnO NPs对SCOD、SC和SP浓度的影响
SC浓度:第1天之后,G0中的SC平均浓度始终低于G1~G3;第30天之前的SC平均含量在G1、G2、G3 3组间无显著差异(P>0.05),但是在第30天,相较于G1组,G2和G3中SC的浓度显著增加(P<0.05)。
SP浓度:各组SP浓度随时间变化趋势均为先下降后上升。其中,只有G0在第1天SP浓度最低(30.89±2.14 mg/g TS),试验组G1、G2和G3中SP的最低浓度均在第6天出现,而在第30天,G2中SP的含量显著高于其余3组(P<0.05)。
2.2 酸化产物的变化
牛粪厌氧消化过程中TVFAs、乙酸、丙酸、丁酸和累积产甲烷量见表3、表4。G0中TVFA的含量随时间呈现先增加后降低的趋势;而G1、G2、G3中TVFAs总体呈现上升的趋势,在第30天时浓度达到峰值。第1、6和14天,G0中TVFAs含量显著高于G2和G3组(P<0.05);第22、第30天,G0的TVFAs含量显著低于其他3个试验组(P<0.05),其中G1组TVFAs含量显著高于其他3组(P<0.05)。
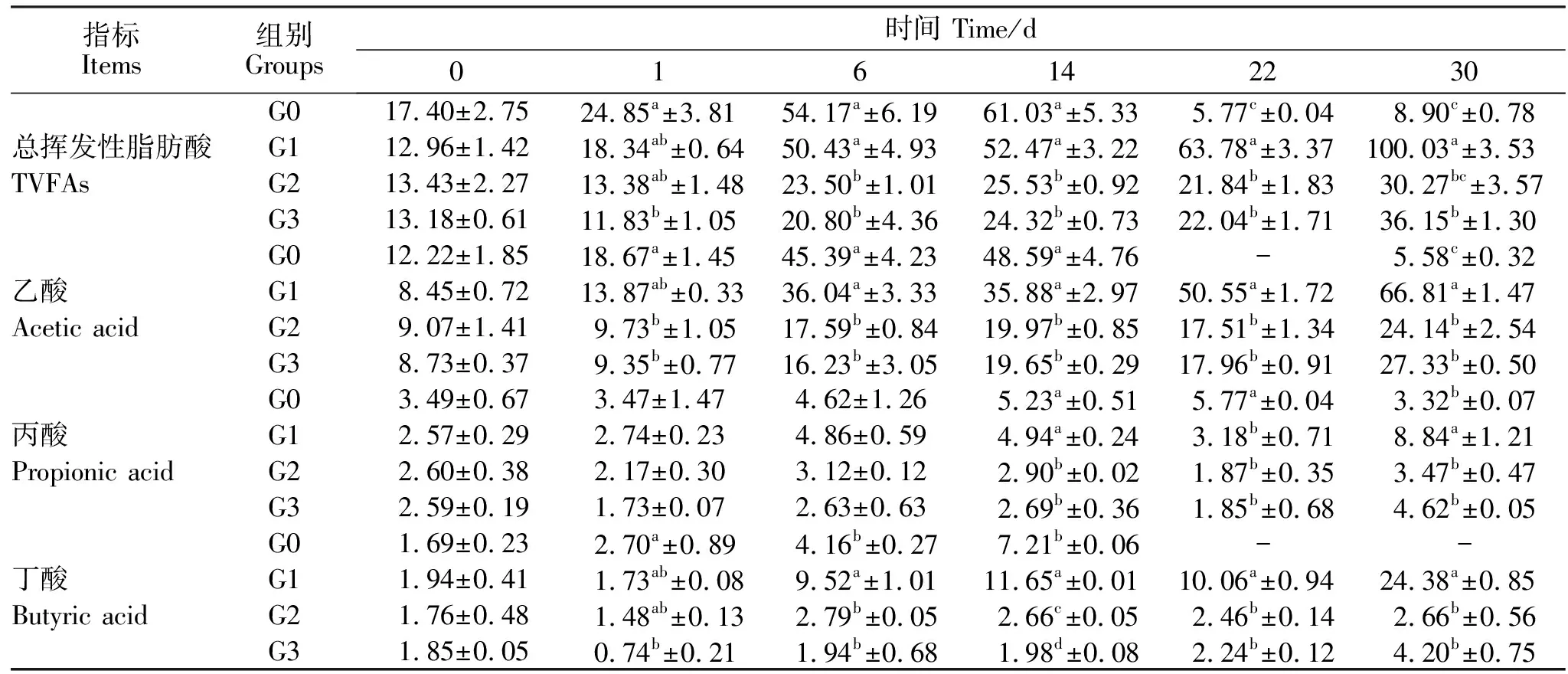
表3 ZnO NPs对VFAs浓度的影响

表4 累积甲烷产量变化
在测定的3种VFAs中,乙酸为TVFAs的主要组分,其次是丙酸和丁酸。G0中乙酸含量呈先升高再降低的趋势,在第14天达到最高,且显著高于同一时间G2和G3组(P<0.05);试验组G1、G2、和G3乙酸含量随时间不断增加,在第22和第30天显著高于G0组,其中,G1组的乙酸含量最高(P<0.05),G2和G3组没有显著差异(P>0.05)。丙酸在G0组也呈现先增加后降低的趋势,第22天浓度最高;G1、G2、G3组丙酸含量总体呈上升趋势,G1组显著高于G2和G3组(P<0.05)。丁酸含量在各组的变化趋势与丙酸类似,在第6、14、22和30天,G1组的丁酸含量显著高于其他3组(P<0.05),而G2和G3组的丁酸含量无显著差异(P>0.05)。
2.3 累积甲烷产量变化
取样当天的累计产甲烷量见表4,整体上随着ZnO NPs浓度增加,累积产甲烷量显著降低(P<0.05),但除第14天外G2和G3的累积产甲烷量无显著差异(P>0.05)。
2.4 群落结构差异
图1展示了G0~G3中细菌群落(属水平)的差异。对于G0,主要的属为Ruminiclostridium(55.67%)、Hydrogenispora(10.11%)、Ruminiclostridium_1(9.17%)、Tepidimicrobium(3.41%)和Herbinix(1.88%)。G1中相对丰度在前5的属由高到低依次是Herbinix(30.34%)、Ruminiclostridium(16.02%)、Caproiciproducenes(6.59%)、Tepidimicrobium(6.44%)和Bacillus(3.17%)。G2中主要的属为Tepidimicrobium(20.43%)、DSSF69(15.07%)、norank_f__Bacillaceae(8.31%)、Bacillus(6.60%)、Ruminiclostridium(6.51%)。G3中前五的属为Tepidimicrobium(18.72%)、Kurthia(9.96%)、Bacillus(9.22%)、Corynebacterium_1(7.16%)和Lachnoapiraceae_NK3A20_group(4.94%)。可见,G0中主要的菌群Ruminiclostridium和Riminiclostridium_1的相对丰度随着ZnO NPs的浓度增加而降低,而菌属Bacillus、Tepidmicrobium、Corynebacterium_1、Lachnoapiraceae_NK3A20_group与ZnO NPs浓度呈正相关。此外,还有部分菌属如Herbinix和Caproiciproducenes在G1中的相对丰度最高。
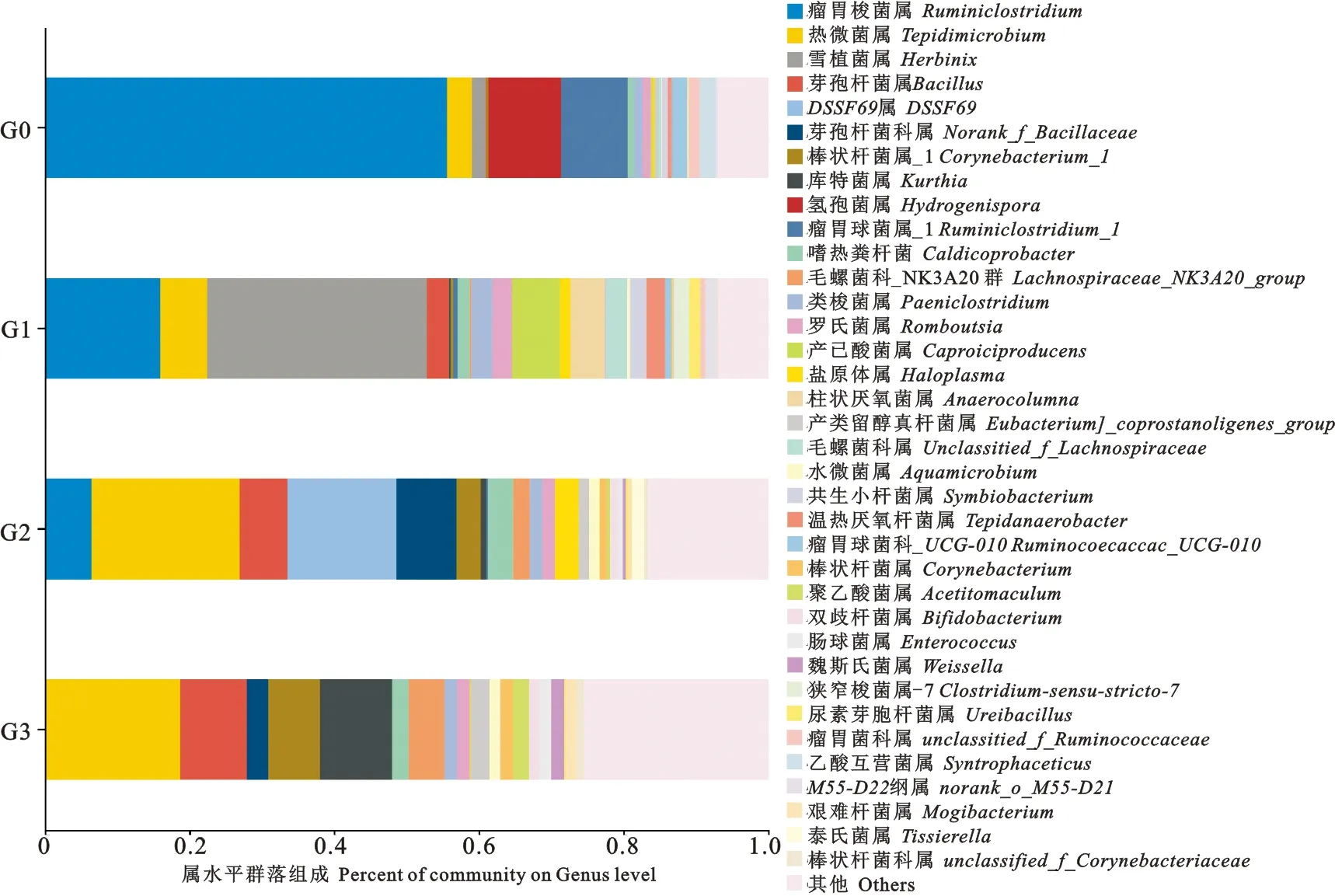
图1 ZnO NPs对细菌群落结构差异的影响
2.5 细菌与水解酸化产物的相关性分析
为了进一步分析在水解酸化阶段潜在的功能菌属对ZnO NPs的响应,本研究对细菌群落和水解酸化产物(SP、SC、乙酸、丙酸、丁酸)进行了相关性分析(基于Spearman相关系数),如图2所示。Ruminiclostridium、Herbinix、Caproiciproducens、Tepidanaerobacter、Ruminococcaceae_UCG-010、Clostridium_sensu_stricto_7、Unclassified_f__Ruminococcaceae和norank_o__M55-D21的相对丰度均与SP和SC的含量呈显著负相关关系(P<0.05)。而Tepidimicrobium、Bacillus、norank_f__Bacillaceae、Aquamicrobium、Bifidobacterium和Chelativorans的相对丰度与SP和SC的含量呈显著正相关关系(P<0.05)。对于细菌群落与酸化产物乙酸、丙酸、丁酸的相关关系,图2表明,只有Hydrogenispora、Syntropgaceticus和Ureibacillus的相对丰度与VFAs有显著相关关系(P<0.05),其中前两者与VFAs呈显著负相关关系(P<0.05),Ureibacillus的相对丰度与VFAs的浓度呈显著正相关关系(P<0.05)。

图2 细菌群落(属水平)和水解酸化产物的相关性热图
3 讨 论
3.1 纳米氧化锌对水解酸化进程关键产物的动态影响
SP、SC和VFAs都是牛粪厌氧消化水解酸化阶段的关键产物,其浓度是表征厌氧消化中水解酸化进程的重要指标。SCOD的浓度变化说明ZnO NPs促进了有机物的溶解和水解,且相较于SCOD的消耗,更有益于SCOD的积累。值得注意的是,第30天SP和SC浓度在高浓度ZnO NPs(30 mg/g TS和100 mg/g TS)的胁迫下,均有显著上升,这可能是因为ZnO NPs促进有机物水解的同时,降低了如蛋白酶和纤维素酶的活性[3]。类似的结果在含有ZnO NPs(30~150 mg/g VSS)的剩余活性污泥厌氧消化体系中也被证实,在该浓度范围下,蛋白酶、纤维素酶、乙酰化激酶的活性受到抑制[23]。此外,其释放的锌离子会破坏细胞完整性,抑制SP和SC的降解,导致系统中SP和SC出现积累[4,24]。不同的是,Zhang等[5]研究表明5~500 mg/L的ZnO NPs对污泥厌氧消化过程中SC的降解没有显著影响,这可能与消化底物、ZnO NPs浓度范围及ZnO NPs的暴露时长有关。
对于TVFAs,G1中TVFAs有显著的积累,而SP和SC的浓度与对照组G0差异不明显,并且G1中的累积产甲烷量较G0的低,这说明5 mg/g TS的ZnO NPs主要抑制了VFAs的消耗导致牛粪厌氧消化体系中VFAs的积累。这与Zhu等[25]的研究类似,其结果表明1.0 mmol/L的ZnO NPs会抑制VFAs向甲烷的转化。而在G2和G3中,30 mg/g TS和100 mg/g TS ZnO NPs严重抑制了SP和SC的降解,减少了VFAs的产出,致使整个水解酸化效果极差。
对于单一的VFAs组分,在前14 d G0中乙酸的积累量均高于G1~G3中的乙酸含量,说明该阶段ZnO NPs可能不利于乙酸的生成。丙酸是蛋白质水解酸化的重要产物之一,其在前22 d G0~G3中的浓度,进一步说明了ZnO NPs对SP降解的抑制作用。此外,ZnO NPs的浓度越高,乙酸、丙酸的浓度越低,说明ZnO NPs对生产VFAs的抑制效果与其浓度呈正相关关系。而第30天时,G1~G3中乙酸和丙酸的浓度显著高于G0中的浓度,说明ZnO NPs的存在同时还会抑制乙酸和丙酸的消耗。对于丁酸,它是生成乙酸的关键中间产物,第30天时G1中丁酸的明显积累,一方面可能是因为一定浓度ZnO NPs(5 mg/g TS)抑制了丁酸向乙酸的转化,减少了丁酸的消耗量,另一方面可能是因为5 mg/g TS的ZnO NPs促进了丁酸的产生[4,26]。
综上所述,ZnO NPs虽然有利于有机物的溶解和水解,但是抑制了SP、SC的降解过程,减少TVFAs的产生,并且对SP和SC降解的抑制效果与ZnO NPs的浓度呈正相关。此外,ZnO NPs还抑制了VFAs的消耗,且对消耗的抑制作用可能大于对VFAs产出的抑制,形成了TVFAs的表观积累。
3.2 纳米氧化锌对细菌群落结构的影响
高通量测序表征的微生物群落结果表明,ZnO NPs的存在改变了细菌在属水平的结构组成。本研究发现,Ruminiclostridium和Hydrogenispora的相对丰度均在G0中最高,并且与ZnO NPs浓度呈反比。先前研究表明Ruminiclostridium的菌株能高效降解木质纤维素,对水解过程有重要的促进作用[27],属于Hydrogenispora的菌株在有厌氧条件下能够利用不同的糖类(如葡萄糖、麦芽糖、阿拉伯糖、果糖等)进行厌氧发酵生成氢气、乙酸等物质[28]。所以Ruminiclostridium和Hydrogenispora的相对丰度随ZnO NPs浓度增加而降低很可能是试验组G1~G3中SP和SC降解受到抑制的重要原因。
Tepidimicrobium(相对丰度3.41%)是G0中的重要菌属之一,该菌属能够以多种蛋白质(如胰蛋白、酪蛋白氨基酸、酵母提取物)和多种碳水化合物(如木聚糖、木糖、葡萄糖)为底物进行发酵产生乙酸、乙醇、氢气等物质[29],其相对丰度在G2和G3中分别为20.43%和18.72%。结合水解、酸化产物变化特性,我们发现该菌的丰度与水解酸化效果相矛盾,造成这种现象的原因可能是ZnO NPs会抑制水解酸化相关功能基因的表达,导致基因组测序结果与试验结果出现矛盾[30]。此外,本研究还发现ZnO NPs促进了菌属Bacillus的富集,这可能与Bacillus对锌离子的耐受能力有关[31]。具有良好水解产酸功能的Tepidimicrobium和Bacillus在高浓度ZnO NPs组(G2和G3)中的优势丰度则表明,二者可能具有耐受、抵抗高浓度ZnO NPs胁迫的潜力,未来Tepidimicrobium和Bacillus可作为功能菌属应用于促进ZnO NPs污染的畜禽粪便的厌氧消化[29,32]。
另外,Herbinix和Caproiciproducene在G1中的相对丰度最高(分别为30.34%和6.59%),说明适当浓度的ZnO NPs(5 mg/g TS)才有利于它的富集,研究表明Herbinix和Caproiciproducene能够以纤维素和多糖为底物,生成乙酸盐、乙醇、丁酸和氢气等物质,其对G1中牛粪厌氧消化的水解酸化过程可能起到重要的作用[33-34]。ZnO NPs对水解酸化功能菌的抑制也在剩余污泥厌氧消化体系中被观测到,但与畜禽粪便不同,受抑制的菌群主要为Longilinea,Levilinea,ClostridiumXI[23]。可见,不同厌氧消化底物在群落组成上有着明显的差异,今后还需不断完善不同厌氧消化体系对外源污染物的响应。
3.3 细菌群落与环境因素的相关性分析
为了进一步探讨ZnO NPs对水解酸化阶段潜在的功能菌属的影响,本研究对细菌群落和水解酸化产物SP、SC、乙酸、丙酸、丁酸进行了相关性分析(基于Spearman相关系数)。Ruminiclostridium、Herbinix、Caproiciproducens、Tepidanaerobacter、Ruminococcaceae_UCG-010、Clostridium_sensu_stricto_7、Unclassified_f__Ruminococcaceae和norank_o__M55-D21的相对丰度均与SP和SC的含量呈显著负相关关系,说明这些菌属可能与SP和SC的降解有关,且这几类菌属相对丰度在4组中由高到低依次是G0、G1、G2、G3。这使得试验组中SP和SC降解抑制程度与ZnO NPs浓度呈正相关。并且,在上述8类菌属中,Herbinix、Caproiciproducens、Tepidanaerobacter、Clostridium_sensu_stricto_7和norank_o__M55-D21的相对丰度在G1中最高,而Ruminiclostridium、Ruminococcaceae_UCG-010和Unclassified_f__Ruminococcaceae在G0中的相对丰度最高,说明这些功能菌属对ZnO NPs浓度的响应存在差异,Herbinix、Caproiciproducens、Tepidanaerobacter、Clostridium_sensu_stricto_7和norank_o__M55-D21的菌株更适于在5 mg/g TS的ZnO NPs环境下生长富集。
对于VFAs与细菌群落的相关性,本研究中只有3种菌属(Hydrogenispora、Syntrophaceticus和Ureibacillus)的相对丰度与VFAs呈显著相关关系。其中,Ureibacillus的相对丰度与VFAs呈正相关关系,研究表明Ureibacillus对木质纤维素具有较好的降解效果,很可能对水解酸化进程有关键贡献[35]。Hydrogenispora、Syntrophaceticus的相对丰度与VFAs的浓度呈负相关,可能有利于VFAs的消耗,如Syntrophaceticus能够与产甲烷菌紧密配合,将乙酸盐氧化为CO2和H2[36]。本研究中,Ureibacillus的相对丰度在G1中最高(1.51%),在G0、G2和G3中的相对丰度均小于1%,而Hydrogenispora、Syntrophaceticus几乎只存在于G0中(相对丰度分别为10.11%和2.20%),在G1~G3中的相对丰度均小于1%。这3种与VFAs有显著关系的潜在功能菌属在各组别中的差异可能是G1中出现VFAs累积的原因之一,而G2和G3中因功能菌的缺乏使VFAs的产生和消耗均受到严重抑制。
综上所述,不同水解功能菌属对ZnO NPs的响应存在差异,并且ZnO NPs总体上不利于功能菌属的富集和表达。
4 结 论
ZnO NPs虽然促进了牛粪厌氧消化过程中有机物的溶出和水解,但是对SP和SC的降解存在抑制作用,且抑制效果与ZnO NPs浓度呈正相关关系。对于酸化效果,ZnO NPs有利于VFAs的表观积累,但是ZnO NPs对VFAs的产生和消耗均存在抑制作用,并且对VFAs消耗的抑制效果更明显。微生物群落分析表明不同水解功能菌属对ZnO NPs的响应存在差异,5 mg/g TS的ZnO NPs更有利于水解酸化功能菌属Herbinix、Caproiciproducens、Tepidanaerobacter、Clostridium_sensu_stricto_7和Ureibacillus等的生长富集,而在高浓度ZnO NPs(30和100 mg/g TS)的暴露下,水解酸化功能菌属的表现和富集均受到严重抑制。

