嵌合型PCV1-3感染性克隆的构建及病毒拯救
李佳昕,田 瑶,韩先杰,杨 莹,王 硕,时建立,李 琛,刘 畅,彭 喆,吴晓燕,韩 红,李 俊,3*
(1.青岛农业大学 动物医学院,山东 青岛 266109;2.山东省农业科学院 畜牧兽医研究所,山东 济南 250100;3.山东师范大学 生命科学院,山东 济南 250014)
猪圆环病毒(porcine circovirus,PCV)是一种很小的无囊膜单股环状动物病毒,归属于圆环病毒科[1-2]。在2016年之前猪圆环病毒只有2种血清型,即PCV1与PCV2。PCV1无致病性,但能够感染PK15细胞。PCV2是致病性的病毒,是断奶仔猪多系统衰竭综合征(postweaning multisystemic wasting syndrome,PMWS)的主要病原[3-4]。2016年,美国学者发现了一种新型猪圆环病毒,命名为PCV3[5]。PCV3的感染可引起猪的多种疾病,如母猪的繁殖障碍、多系统炎症、免疫力下降甚至引起免疫抑制等[6]。目前,PCV3的感染在世界范围内均有流行,对养猪业产生了巨大影响,虽然市场上PCV2商品化疫苗有10余种[7],但国内外还没有商品化的PCV3疫苗。而PCV2与PCV3编码诱导中和抗体的衣壳蛋白Cap基因组的同源性仅有30%左右,传统的PCV2疫苗几乎不能提供交叉保护[8]。因此,研发成本低、保护效力高的PCV3疫苗很有必要。
PCV3与PCV1的同源性仅有40%左右,但其基因组大小和组成非常相似,都具有2个主要的开放阅读框(open reading frame,ORF),其中ORF2均编码病毒衣壳蛋白,但2种病毒的衣壳蛋白之间没有抗原交叉性。由于PCV3分离培养较为困难,体外表达抗原成为疫苗制备的首选[9]。
目前,已有文献报道重组嵌合型PCV1-2是预防PCV2引起疾病的良好疫苗,其制备过程为本研究提供良好的思路[10-11]。鉴于此,本研究以PCV1的全基因组作为骨架,将其ORF2基因替换成PCV3的ORF2基因,利用PCV1的复制能力和PCV3 Cap蛋白的免疫原性,为研究低成本、高效保护力的PCV3疫苗奠定良好的基础。
1 材料与方法
1.1 细胞、质粒与载体
无PCV污染的PK-15细胞系、PCI表达载体由青岛农业大学动物医学院实验室保存,pEASY-Blunt zero-PCV3质粒、PMD18-T-PCV1质粒也由本实验室构建。
1.2 主要试剂
DL2000 DNA Marker、Prime STAR Max购自宝生物工程(大连)有限公司。DNA纯化回收试剂盒购自北京OMEGA有限公司。质粒小提试剂盒购自康宁生命科学有限公司。转染试剂Lipofectamine 3000 Transfection Kit购自Invitrogen公司。PCV3 ORF2单克隆抗体由郑州大学实验室馈赠。ACE底物显色液购自北京Solarbio公司。HRP-SPA购自abcam公司。
1.3 引物设计与合成
根据PCV1(AY193712.1)、PCV3(MG947596.1)全基因组序列设计4对引物(见表1),其中F1、R1与F3、R3用于PCV1缺失ORF2基因组扩增,F2、R2用于PCV3ORF2基因组扩增,在设计引物时添加了重叠部分序列。F4、R4用于检测嵌合病毒PCV1-3基因组部分片段。

表1 引物名称及序列
1.4 PCV1-3DNA克隆的构建
以重组质粒PMD18-T-PCV1和pEASY-Blunt zero-PCV3为模板,分别建立50 μL普通PCR反应体系:Prime STAR Max:25 μL,上游引物2 μL,下游引物2 μL,模板2 μL,加ddH2O补齐50 μL。PCR反应程序:94 ℃预变性4 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃ 终延伸7 min。反应结束经1.0%琼脂糖凝胶电泳并回收。对回收产物PCV1 ORF2与PCV3 ORF2片段进行重叠PCR,反应结束经1.0%琼脂糖凝胶电泳并回收。采用双酶切NheⅠ和NotⅠ将PCI载体线性化,采用无缝连接的方法将上述DNA线性序列与线性载体序列冰上配制反应体系(表2)。37 ℃反应30 min后转化至大肠杆菌DH5α感受态细胞,进行PCR与测序鉴定。
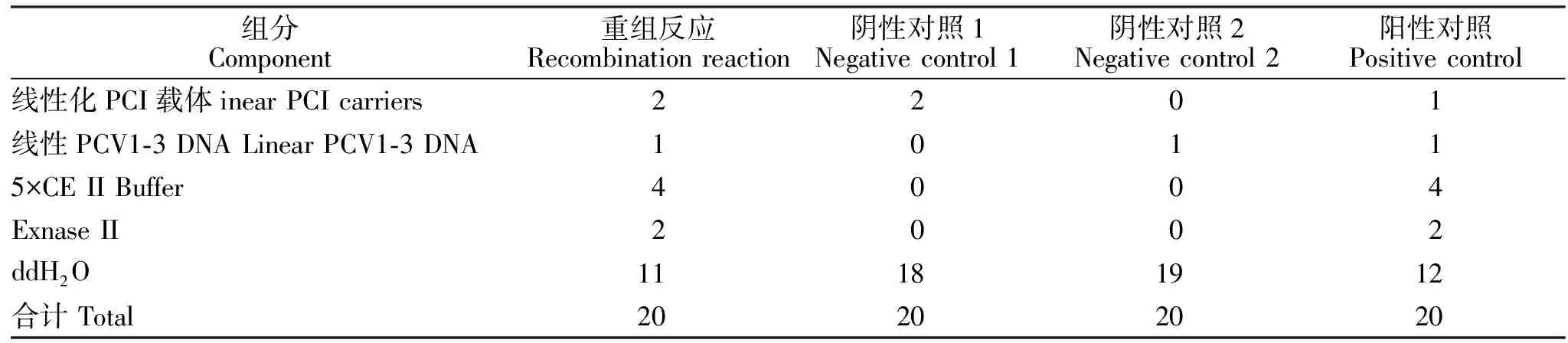
表2 配制体系
1.5 嵌合病毒PCV1-3的拯救
1.5.1 DNA的转染 使用6孔细胞培养板培养无PCV污染的PK-15细胞,待其生长至75%左右时,按照转染试剂说明书将PCV1-3转染至PK-15细胞中。72 h后收集转染后的细胞,反复冻融3次后,用滤器将细胞碎片滤除,所得滤液接种于新的PK-15细胞中,依次盲传5代。
1.5.2 PCR检测 转染细胞经5次传代后将细胞悬液提取总DNA,用引物F4、R4进行PCR扩增鉴定,步骤参照1.4,同时设正常PK-15细胞作为阴性对照。
1.5.3 免疫过氧化物酶单层试验(IPMA)检测 应用PCV3 ORF2单克隆抗体通过免疫过氧化物酶单层试验(IPMA)检测PCV3衣壳蛋白的表达,确认PCV1-3 DNA克隆在转染细胞中的感染性。将转染72 h后的细胞使用PBS洗涤3次,放入37 ℃温箱中干燥50 min后放入-20 ℃冰箱中冷冻50 min,拿出后使用4%预冷的多聚甲醛固定液在4 ℃固定45 min,用PCV3 ORF2单克隆抗体(1∶150)在37 ℃恒温箱中孵育1 h;使用PBS洗涤3次后用HRP-SPA(1∶100)在37 ℃恒温箱中孵育1 h,再使用PBS洗涤3次后加入ACE显色液避光显色15 min后在荧光显微镜下观察结果。
1.5.4 Western blot检测嵌合病毒Cap蛋白的表达 将所获嵌合病毒接种于PK-15细胞中,72 h后弃上清,加入适量裂解液,置于冰上裂解30 min,用细胞刮铲将细胞刮下,离心后收集上清。之后按照常规方法进行蛋白电泳检测,并设正常PK-15细胞作为阴性对照。
1.5.5 重组病毒滴度测定 将第4代病毒液使用无血清的DMEM培养基进行稀释(10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9),将稀释好的病毒液接种至96孔板中,每个稀释度加8个孔,并设立空细胞作为阴性对照。在细胞培养箱中培养72 h后,使用IPMA试验检测结果。
按照Reed-Muench法计算其TCID50,距离比例=(高于50%病变率的百分数-50%)/(高于50%病变率的百分数-低于50%病变率的百分数),LgTCID50=距离比例×稀释度对数之间的差+高于50%病变率的稀释度的对数。
2 结果与分析
2.1 PCR扩增产物的鉴定
经琼脂糖凝胶电泳分析,成功扩增出PCV1缺失ORF2基因和PCV3ORF2基因的PCR产物的目的条带,其大小分别为536 bp、521 bp和645 bp(图1)。经重叠PCR扩增出预期目的条带,其大小为1 702 bp(图2)。

图1 PCV1的2个片段和 PCV3 ORF2片段的扩增结果
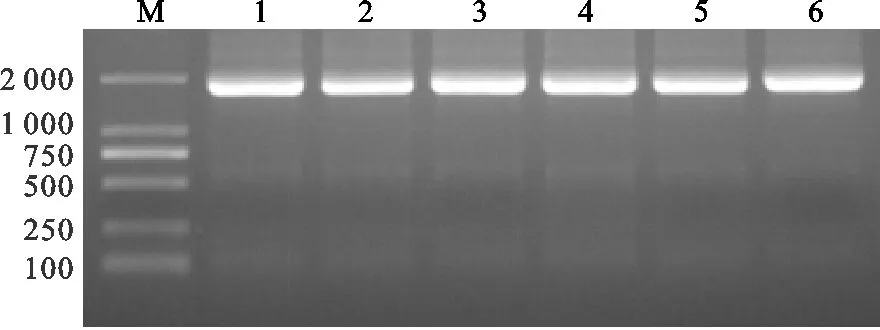
图2 PCV1-3全长片段的序列扩增
2.2 PCV1-3全基因组的PCR产物克隆入pCI-tb206-2
PCV1-3全基因组的PCR产物克隆入pCI-tb206-2载体,获得重组质粒pCI-PCV1-3,经检测引物F4/R4进行PCR检测,扩增出目的条带,大小约为1 785 bp(图3),说明PCV1-3已成功克隆入pCI-tb206-2载体。将阳性质粒送生工生物工程股份有限公司进行测序。测序结果显示重组质粒插入序列与原基因序列一致,无碱基突变(测序结果略)。
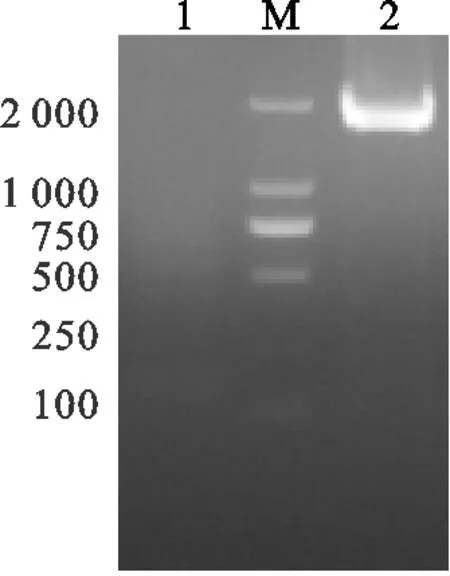
图3 重组质粒检测结果
2.3 免疫过氧化物酶单层试验(IPMA)结果
将第4代重组病毒培养72 h进行IPMA检测,并设立未接毒无污染的PK-15细胞为阴性对照。如图4所示,拯救病毒能检测到细胞被染色,呈红棕色,而未接毒无污染的PK-15细胞没有被染色。结果表明,PCV1-3 DNA感染性克隆转染PK-15细胞时都具有感染性。
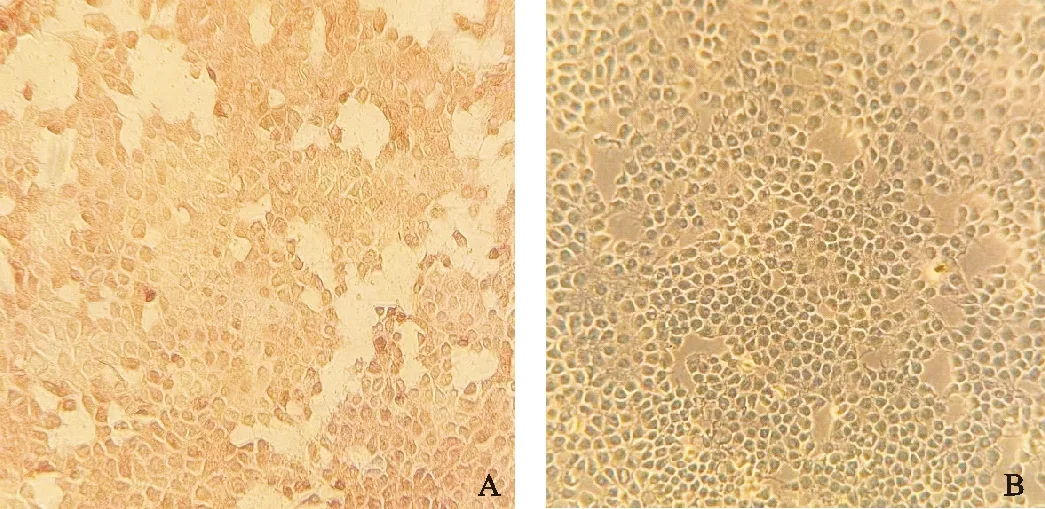
图4 质粒PCV1-3转染PK-15细胞的IPMA检测(20×)
2.4 Western blot结果
蛋白免疫印迹试验表明PCV3 Cap蛋白在28 kDa处存在特异性条带,而阴性对照未接毒的PK-15细胞中则无蛋白的表达(图5)。

图5 转染PK-15细胞后的Western blotting检测
2.5 重组病毒滴度测定结果
重组病毒滴度测定结果见表3。按照Reed-Muench法计算其TCID50,得出病毒的滴度为105.13TCID50/mL。

表3 TCID50测定结果
3 讨 论
目前在圆环病毒的4个血清型中,PCV3的研究成为关注的热点。PCV3已在多个国家的农场或养殖场中被检测到,但对于病毒的分离仍然很困难。有报道使用传染性克隆[12]拯救了整个病毒,如何有效预防PCV3的感染成为了世界养殖业共同关注的问题。有资料显示,PCV3会造成猪皮炎、肾病综合征和生殖衰竭,而且还会导致猪的免疫能力下降甚至出现免疫抑制,因此其疫苗的研制具有十分重要的经济意义。目前市场上PCV2的商品化疫苗有10余种,但还没有一种有效的疫苗来防控PCV3的感染。结合世界范围内PCV3的高感染率,很有必要研发出一种保护效力高、成本低的PCV3疫苗。
目前,国内外已有许多关于嵌合型PCV1-2的弱毒疫苗的相关报道[13-16],其构建方法是通过用PCV2的ORF2基因替换非致病性PCV1的相应片段,构建出一种嵌合病毒(PCV1-2),进而开发成为PCV2弱毒疫苗。已有报道表明,嵌合病毒PCV1-2免疫SPF仔猪后能够激发机体产生PCV2 ORF2抗体[17]。汪正亮等通过PCV-2灭活疫苗免疫商品猪,商品猪皆产生了较高的体液免疫反应[18]。宋益等[19]运用嵌合猪圆环病毒PCV1-2接种BALB/c小鼠,结果显示,接种42 d后,全部的接种的小鼠血清皆成阳性,说明该嵌合病毒PCV1-2能够激发机体产生体液免疫应答。鉴于此,本试验根据圆环病毒之间的相似性,使用相同方法将PCV3ORF2基因替换至PCV1基因中,构建出PCV1-3 DNA感染性克隆,该克隆转染进细胞后,能够在细胞表达并稳定传代。
感染性克隆拯救病毒的体外增殖能力能够受到多重因素的影响,因此必须保证构建的感染性DNA克隆序列不会发生变异,与其亲本病毒序列保持完全一致。在基因组构建过程中,最重要的就是防止碱基错配以及产物突变,本试验在重叠PCR过程中采用了高保真酶,确保了产物序列的稳定性,测序结果显示全基因组序列完全一致。重叠PCR技术被广泛应用于基因重组、基因定点突变、基因组连接等试验中[20-22]。本试验采用重叠PCR的方法将PCV3ORF2基因替换至PCV1的基因组框架中,此方法可简单迅速的将2个片段连接在一起,不需要内切酶进行酶切,再经连接酶进行连接,更加省时省力,而且操作简单,为此后的序列构建提供一种新的思路。在与载体连接时,本试验运用了无缝连接的试验方法,该方法无需连接酶依赖体系,能够有效防止载体自连,所得到的阳性克隆即为目的结果,连接成功率高达95%以上,能够快速且高效的将片段连接至载体的任意位点,无需多重复杂的操作,同时也节约了时间。
目前,对PCV3的研究还处于起步阶段,但疫苗的研制已经迫在眉睫,本研究对PCV3的弱毒疫苗研制提出了一种新思路。研究结果表明成功构建了一种新型猪圆环嵌合病毒PCV1-3,为进一步研制成本低、见效快的PCV3疫苗奠定了基础。
4 结 论
本研究成功构建了PCV1和PCV3的嵌合病毒PCV1-3。对第4代病毒进行滴度测定,效价为105.13TCID50/mL。

