应用于抗体中和试验的假型化新型冠状病毒的构建
黄昭阳,张炎华,朱 颖,翁育伟,
2019年12月,中国武汉报道了由新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染引起的肺炎病例[1],世界卫生组织将该病(World Health Organization,WHO)命名为COVID-19(Coronavirus disease 2019)。2020年3月11日,WHO宣布COVID-19已形成“全球大流行”。截至2023年2月10日,全球有超过200个国家和地区报告COVID-19确诊病例超过7.55亿,死亡病例683万例。SARS-CoV-2具有高度变异性,自新冠病毒武汉株之后,先后进化成为Alpha、Beta、Gamma、Zeta、Delta等多种变异株以及数量不等的子代进化分支。伴随病毒持续变异和进化,SARS-CoV-2传染性逐步增强,并显示出逐渐增强的免疫逃逸性,2021年11月在南非被首次确认的Omicron变异株更是具有高度的传染性和免疫逃逸能力,对全球公共卫生产生了巨大挑战。由于SARS-CoV-2高度的传染性和致病性,我国将其列为第二类病原微生物进行管理。根据《国家实验室生物安全通用要求》(GB19489-2008),涉及SARS-CoV-2活病毒的试验均应在BSL-3(Bio-safety level-3)实验室中进行,但由于BSL-3实验室建设要求高,数量较少,极大限制了SARS-CoV-2病原学、免疫学等研究工作的开展。
假型化病毒(Pseudotyped virus)是一种被异源外膜蛋白包被,通过基因工程技术引入复制缺陷表型的病毒颗粒[2],能很好模拟野生病毒吸附、进入细胞过程,同时可避免病毒泄漏导致的人员感染,是可替代野生病毒在低生物安全等级实验室进行各种实验研究的安全有效的实验模型[3]。在体外抗病毒分析和体内生物分布分析的数据中可以发现,使用假型化病毒与使用活的野生型病毒产生的结果高度相关[4-5]。鉴于假型化病毒的相对安全性和可操作性,它被广泛用于各类新发和再发传染性病毒的实验研究,包括MERS-CoV[6]、狂犬病毒(Rabies virus)[7]、埃博拉病毒(Ebola virus)[8]、拉萨病毒(Lassa virus)[9]等。为安全、高效开展SARS-CoV-2抗体中和试验,本研究基于HIV包装系统,通过密码子优化和体外包装条件的优化,构建了表达S蛋白的假型化SARS-CoV-2,并比较了其与野生型病毒在抗体中和试验结果的相关性和一致性。
1 材料与方法
1.1 细胞株、质粒、血清 HEK 293T细胞购自ATCC,Vero E6细胞由本课题组保存,pCR-XL-2-TOPO和E.coliTOP 10购自Thermo Fisher Scientific公司。真核表达载体pcDNA3.1(+)购自南京金斯瑞生物科技股份有限公司,慢病毒骨架载体pHAGE-CMV-Luc2-IRES-ZsGreen-W、pHDM-Hgpm2、pRC-CMV-Rev1b、pHDM-Tat1b购自Addgene。S基因的密码子优化和合成委托南京金斯瑞生物科技股份有限公司进行。血清采集自新冠灭活疫苗加强免疫后(第3剂)人群,本研究通过福建省疾病预防控制中心伦理审查[闽疾控伦审(2021)第(021)号]。实验所用野生型SARS-CoV-2均为福建省疾病预防控制中心BSL-3实验室分离。
1.2 主要试剂和工具酶 DMEM培养基、胎牛血清FBS、青/链霉素等购自GIBCO公司。限制性内切酶KpnI、NotI购自NEB公司,引物序列由尚亚生物科技有限公司合成,质粒小提试剂盒购自北京全式金公司,胶回收试剂盒购自QIAGEN公司,质粒大提试剂盒和质粒转染试剂(Lipofectamine 3000)购自Thermo Fisher Scientific公司,兔抗SARS-CoV-2 S蛋白和山羊抗兔lgG H&L购自Abcam公司,萤火虫荧光素酶检测试剂盒购自碧云天生物技术公司。
1.3 SARS-CoV-2 S基因优化、设计与表达质粒构建 从COVID-19病例(武汉类似株感染者)样本提取病毒RNA,使用RT-PCR扩增获得S蛋白编码基因全长(引物Spike-Fw/Bw,见表1),反应条件为:98 ℃变性10 s,55 ℃退火15 s,72 ℃延伸4 min,循环30次;72 ℃延伸5 min,4 ℃保存。产物经纯化后插入pCR-XL-2-TOPO并转化感受态细胞,重组质粒经sanger法测序后进行S基因全长密码子优化,优化后的S基因插入pcDNA3.1(+)。

表1 本研究使用的引物序列信息
使用引物(表1)分别对密码子未优化和优化后的S基因进行PCR扩增,同时设计S蛋白C端肽段缺失13个(SEPVLKGVKLHYT)和19个(KFDEDDSEPVLKGVKLHYT)氨基酸的引物,扩增不同长度S基因。在上游引物序列加入kozak序列用以增强转录效率。将扩增产物分别插入pcDNA3.1(+)并转化E.coliTOP 10,得到6种S蛋白表达载体,即未经密码子优化和优化后的全长(W-S1、W-OS1)、C末端缺失13个氨基酸(W-△S13、W-△OS13)、C末端缺失19个氨基酸(W-△S19、W-△OS19)。按照上述方法,参考GenBank病毒序列,构建Delta(GISAID:EPI_ISL_10067523.1)和Omicron(GISAID:EPI_ISL_6913991.1)变异株S蛋白的表达质粒(D-△OS13、O-△OS13)。
1.4 假型化病毒包装与表达质粒筛选 293T细胞(2.5×105/孔)接种于细胞板,待细胞密度生长至70%~90%时进行转染。将上述构建的6种S蛋白表达质粒和空载pcDNA3.1(+)分别与pHAGE-CMV-Luc2-IRES-ZsGreen-W、pHDM-Hgpm2、pRC-CMV-Rev1b、pHDM-Tat1b用Lipofectamine 3000共转染进293T细胞中,转染6 h后更换为2%血清的培养基,在37 ℃、5% CO2培养箱继续培养24 h后收集上清。
转染后的细胞用4%多聚甲醛固定,0.5% Triton X-100室温通透细胞,5% BSA封闭,加入兔抗SARS-CoV-2 S1(1∶1 000)4 ℃孵育过夜,山羊抗兔lgG(1∶2 000)室温孵育1 h,DAPI对细胞核染色,在荧光显微镜下观察结果。
将VeroE6细胞(4×104/孔)接种于96孔板,37 ℃、5% CO2培养24 h后,加入病毒上清(100 μL/孔),继续培养24 h后弃去培养基,每孔加入100 μL细胞裂解液充分裂解细胞,再加入100 μL萤光素酶底物,检测细胞内的萤光相对发光值(Relative luminescence units,RLU),筛选萤火虫萤光酶活性最高的表达质粒类型。
1.5 假型化病毒包装系统转染比例的确定 采用不同比例的包装质粒和表达质粒,以及不同比例的DNA和Lipofectamine 3000,共9种不同组合共转染293T,24 h后收获上清。上清感染Vero E6细胞24 h后,检测每组RLU。
1.6 不同时间点收获转染后假型化病毒感染细胞的能力测定 为确定转染后假型化病毒收集和假型化病毒在Vero E6细胞最佳表达时间,分别于转染293T后24~96 h,间隔24 h收集假型化病毒上清,同时在感染VeroE6后24~96 h内,间隔24 h检测RLU。
1.7 假型化病毒的滴定 将Vero E6(4×104/孔)接种于96孔板,24 h后吸弃培养液。用含2%FBS培养基系列稀释(1∶10)假型化病毒,加入细胞培养孔(100 μL/孔),每个稀释度做4个复孔,37 ℃、5% CO2培养箱中培养48 h后检测RLU。以高于细胞对照均值10倍的孔判定为阳性孔,Reed-Muench法计算假型化病毒的50%组织培养感染剂量(TCID50)。
1.8 中和抗体水平检测
1.8.1 假型化病毒中和抗体试验 采用上述方法构建的假型化病毒检测201份新冠疫苗加强免疫后的血清中和抗体滴度。实验设置3个对照,即阴性对照:未接种新冠疫苗者血清和假型化病毒;病毒对照:只加入假型化病毒;空白对照:不含血清和假型化病毒。将Vero E6(4×104/孔)接种于96孔板,24 h后吸弃培养液,用2% FBS培养基系列稀释(1∶2~1∶512)血清样本,每个稀释度做3个重复孔。用2%FBS培养基将假型化病毒稀释至100 TCID50/50 μL。取70 μL稀释后的血清样本与70 μL稀释于含 2% FBS培养基的假型化病毒液混合,37 ℃孵育1 h,取100 μL假型化病毒-血清混合液加入细胞孔,在37 ℃、5% CO2培养箱中培养48 h后检测RLU。感染抑制率(%)=(1-血清组RLU/病毒对照组RLU)×100%。抑制率≥50%判定为具有中和活性。该稀释度即血清中和抗体滴度。
1.8.2 野生型病毒中和抗体试验 该实验在福建省疾病预防控制中心BSL-3实验室完成。实验操作与假型化病毒血清中和抗体检测操作一致,每个稀释度做3个重复孔。野生病毒感染细胞后在37 ℃、5% CO2培养至7 d,观察细胞病变情况,采用Reed-Muench 法计算50%感染抑制率时血清稀释倍数,该稀释度即为该血清样品的中和抗体滴度。
1.9 统计学处理 采用GraphPad Prism 9.0软件作图并进行统计学分析。组间比较采用Kruskal-Wallis检验;采用Spearman秩相关性分析,一致性分析采用组内相关系数(ICC),P<0.05为差异具有统计学意义。
2 结 果
2.1 SARS-CoV-2 S基因表达质粒构建 从病例样本中扩增的S蛋白全长基因(图1A),测序结果表明序列为SARS-CoV-2武汉类似株S基因全长序列。对S基因密码子优化前后的全长、C末端不同缺失长度的基因进行扩增,并于与载体pcDNA3.1(+)连接,获得的重组表达质粒用KpnI和NotI双酶切,其片段大小均与预期相符合(图1B),同时测序结果显示6种S基因表达序列正确。
2.2 S蛋白表达质粒的确定 6种武汉类似株S蛋白表达质粒分别与包装系统共转染入293T细胞,收集转染后病毒上清,感染Vero E6细胞。感染24 h后的免疫荧光显示,Vero E6细胞胞浆内可见有绿色荧光(图2A-B);感染后Vero E6细胞内荧光素酶活性显示(图3),基于W-△OS13构建的假型化SARS-CoV-2的荧光素酶活性最高(H=0.329,P=0.566)。参照W-△OS13构建方法,构建Delta和Omicron变异株的S蛋白表达质粒(D-△OS13和O-△OS13)。基于2种变异株S蛋白表达质粒构建的假型化SARS-CoV-2感染Vero E6细胞,感染24 h后胞浆内可见有绿色荧光(图2C-F)。
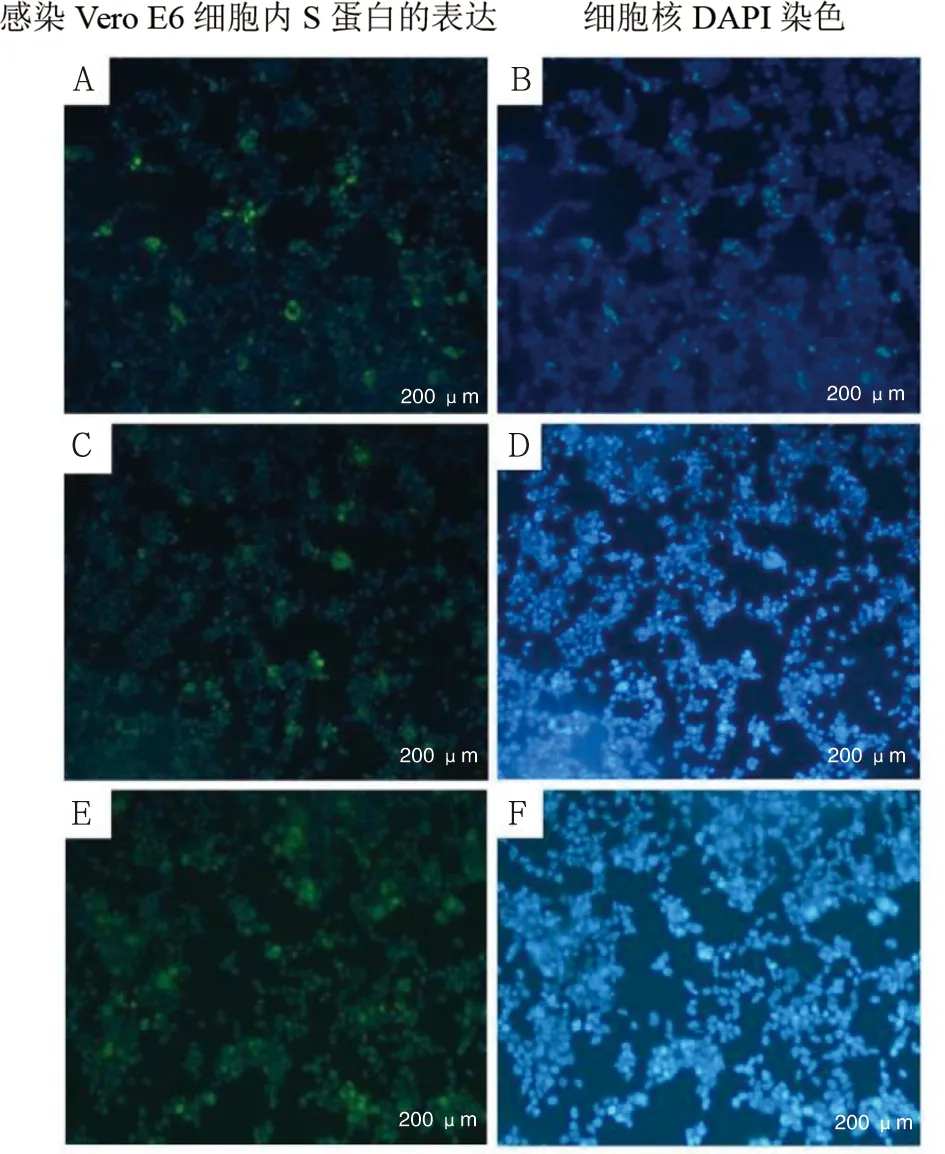
注:A-B.W-△OS13;C-D.D-△OS13;E-F.O-△OS13。
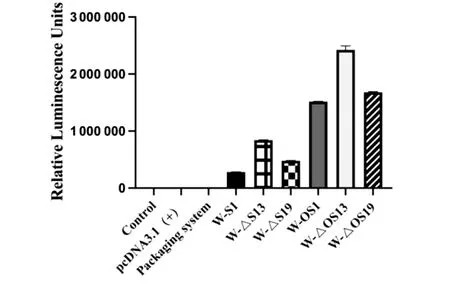
图3 基于6种武汉类似株S蛋白表达质粒构建的假型化SARS-CoV-2感染后细胞内荧光素酶活性
2.3 假型化病毒包装系统的优化和收获病毒感染细胞时间点的确定 包装质粒和目的质粒(S蛋白表达质粒)比例分别以1∶1、3∶1、4∶1混合,同时以1∶1、1∶2、1∶3比例(μg∶μL)混合质粒DNA和Lipfectamine 3000,共转染293T细胞并收集假型化病毒上清,上清感染Vero E6细胞后测定细胞内荧光素酶活性,各组间比较,结果为在包装质粒∶目的质粒=3∶1、转染总质粒DNA∶Lipfectamine 3000=1∶2条件下,测得的萤火虫萤光素酶活性最高(H=19.143,P<0.000 1,图4)。

注:应用不同条件下包装的假型化病毒(W-△OS13)感染Vero E6后,荧光素酶活性差异显著。control:无质粒和转染试剂的空白对照。***:P<0.001;****:P<0.000 1。
在上述转染条件下,间隔24 h收取病毒上清,感染Vero E6细胞并测定萤光素酶活性,结果显示,转染后24 h收集的假型化病毒,萤光素酶活性最高,随着收样时间的延长,滴度降低(H=32.838,P<0.000 1,图5A);对假型化病毒感染后的不同时间点测定萤光素酶活性,结果表明,感染后48 h时萤光素酶活性最高,72 h、96 h活性下降(H=15.295,P<0.000 1,图5B)。
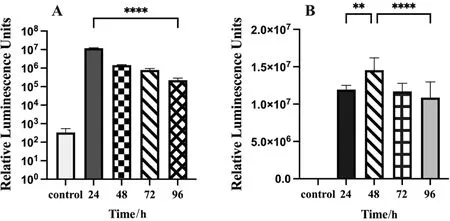
注:A.转染后24 h收获的假型化病毒(W-△OS13);B.该病毒感染细胞后48 h检测,荧光素酶活性相较高。control:无添加假型化病毒的空白对照。**:P<0.01; ****:P<0.000 1。
2.4 中和抗体试验 分析3种不同变异株的假型化病毒(W-△OS13、D-△OS13、O-△OS13)与相应野生型病毒(Wuhan-like、Delta、Omicron)中和抗体实验的相关性,结果显示(图6A-C),3种变异株假型化病毒与相应野生型病毒的中和试验结果呈较强的相关性(R2分别为0.915 0、0.898 4和0.799 0,均P<0.001);进一步分析3种变异株假型化病毒与相应野生型病毒的中和试验的一致性,Bland-Altman图(图7A-C)可见大部分数据点落在95%一致性界限之内,对应的ICC分别0.957、0.943和0.880,显示假型化病毒与野生型病毒中和试验结果有较好的一致性(P<0.001,表2)。
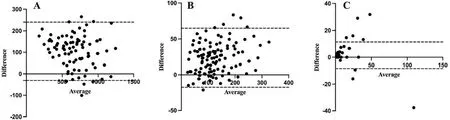
注:A.野生型病毒Wuhan-like与假型化病毒W-△OS13;B.野生型病毒Delta与假型化病毒D-△OS13;C.野生型病毒Omicron与假型化病毒O-△OS13。图中上、下虚线为95%一致性界限的上、下限。
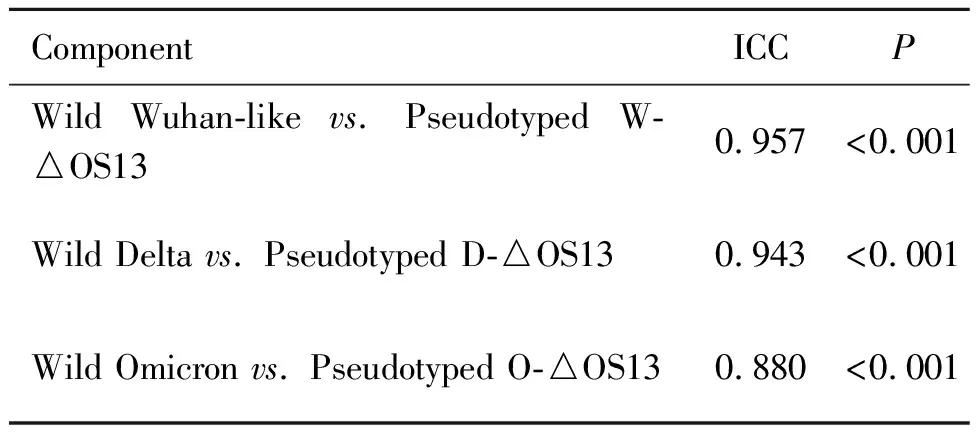
表2 野生型病毒与假型化病毒组内相关系数
3 讨 论
随着新冠病毒感染疫情的持续蔓延和大量变异株的出现,研发有效的疫苗和抗病毒药物是当前控制新冠病毒感染疫情的迫切需要,而相关研发工作无法避免使用病毒分离株。出于实验室生物安全的考虑,以及生物安全管理的限制,目前SARS-CoV-2无法在低等级实验室使用,极大限制了上述研发工作的开展。由于假型化病毒表面可嵌合异源病毒表面蛋白,能够很好的模拟异源野生型病毒,同时极大减少人员感染和病毒的传播,因此许多研究者采用人类免疫缺陷病毒(Human immunodeficiency virus,HIV-1)和水疱性口炎病毒(Vesicular stomatitis virus,VSV)包装系统,构建假型化病毒用于替代野生型SARS-CoV-2,开展疫苗和药物研发以及其他涉及活病毒的科研工作。Schmidt F等[10]利用复制缺陷的HIV-1病毒质粒,将其与密码子优化后的SARS-CoV-2刺突蛋白表达质粒共转染293T细胞产生SARS-CoV-2假型化病毒。Ou X等[11]将SARS-CoV-2 S蛋白表达质粒psPAX2和pLenti GFP共转染到HEK 293T细胞中,成功构建出SARS-CoV-2假型化病毒。Nie J等利用SARS-CoV-2 S蛋白表达质粒pcDNA3.1和VSV包装系统转染细胞构建成功假型化病毒,并在 VSV基因组中携带萤火虫荧光素酶[12],成功建立了基于假型化病毒的抗体中和试验[13]。
S蛋白是SARS-CoV-2的主要外膜蛋白,介导病毒吸附和感染,是SARS-CoV-2疫苗和药物研制主要靶点[14],但S蛋白胞内表达后,需经历内质网和高尔基复合体之间的中间室膜上组装和“出芽”,由于其C末端二元基序突变或氨基酸缺失可导致缺乏细胞内定位信号,有利于S蛋白向细胞质膜的转运,促进细胞表面S蛋白的增加和合胞体的形成并引导感染在细胞间的传播[15]。在假型化病毒构建中,有研究表明,S蛋白C端缺失18个[16]或19个[17]氨基酸可显著提高SARS-CoV-2假型化病毒滴度;另外,Nie Y等[18]报道优化S蛋白的N 端信号肽序列亦可提高SARS-CoV-2假型化病毒包装效率。因此,为提高假型化病毒的滴度,本研究除对S基因密码子进行优化的基础上,对其C末端进行截短,结果表明,在C端缺失13个氨基酸条件下所产生的假型化病毒滴度较高。除了对S基因进行优化外,本研究还对包装条件进行了优化,结果表明,当包装质粒∶目的质粒=3∶1,质粒DNA∶Lipfectamine3000=1∶2,转染后24 h后收获的假型化病毒滴度较高,同时细胞感染48 h后病毒的表达水平较高。这与其他研究者的结果类似,有研究表明,当骨架质粒和表达质粒配比为2∶1时,所产生的假型化病毒滴度较高[19];Hu J等[17]发现用转染48 h后收集的假型化病毒侵染细胞72 h后侵染效率最高等。因此,通过上述条件的优化,我们成功的构建了基于HIV包装系统的假型化SARS-CoV-2,并获得较高的病毒滴度。
除不断出现新变异株外,SARS-CoV-2新变异株的复制、传播能力也普遍增强,有研究显示,Delta感染后病毒浓度是武汉株的1 000倍[20],传染性几乎是最初武汉毒株的两倍;而Omicron变异株是一种传播力更强、感染率更高的变异毒株[21-22]。尽管有报道称两次接种早期毒株生产的疫苗对Delta具有一定的有效率[23],但是随着病毒变异增加,新变异株是否对疫苗的保护产生免疫逃逸,需要更多的研究来加以评价。基于此,本研究在成功构建武汉株假型化病毒的基础上,对Delta和Omicron这2种主要流行变异株进行了假型化,并对3种假型化病毒的抗体中和检测的效果,与基于野生型病毒的中和检测结果进行了比较[24-25],结果表明,本研究构建的3种假型化病毒检测结果与野生型病毒检测结果具有较好的一致性和相关性。但同时本研究也发现,两者间的相关性系数R2和组内相关系数ICC随着病毒变异度的增加而逐渐下降,其原因可能在于,本研究中构建假型化病毒选取的Delta和Omicron 2种变异株的S蛋白基因来自于该变异株的原始毒株序列,而野生型病毒来自于变异株的子代分支(分离株),因此在构建假型化SARS-CoV-2以及后续中和试验的应用中,可能需要考虑S基因的来源问题。
综上,本研究成功构建了基于HIV包装系统的SARS-CoV-2假型化病毒系统,中和抗体检测结果表明,3种变异株假型化病毒与野生病毒中和抗体结果有良好的相关性和一致性,因此所构建的假型化病毒可作为一个安全、可靠、适宜替代品,用于在低等级实验室开展SARS-CoV-2相关的免疫学等试验,同时本研究的构建方法,对于新发变异株以及其他高致病性披膜病毒的假型化有重要的参考价值和良好的应用前景。
利益冲突:无
引用本文格式:黄昭阳,张炎华,朱颖,等.应用于抗体中和试验的假型化新型冠状病毒的构建[J].中国人兽共患病学报,2023,39(9):857-864.DOI:10.3969/j.issn.1002-2694.2023.00.102

