白念珠菌HGT19基因敲除株的构建与基因功能初步研究
陈 婷,黄孝天,张陆兵
白念珠菌是隶属于子囊菌门的一种条件致病菌,持续定植在口腔,胃肠道和泌尿生殖系统。对于健康正常宿主而言,通常情况下白念珠菌与其他正常菌群处于共生状态,在体内可以保持平衡,但在宿主体内金属离子代谢改变时转变为病原体[1]。多种毒力属性的表达促进了白念珠菌形态的转换,导致多种感染,从浅表粘膜到系统性念珠菌病[2]。虽然浅表感染非常常见且可以治疗,但血液感染仍危及生命,据报道死亡率为34%[3]。更令人担忧的是,耐多药真菌物种的出现,因此迫切需求开发新的治疗药物,针对未开发的真菌途径,例如微营养免疫。微营养免疫是指在微生物感染期间,宿主隔离铁、锌和其他金属营养素,从而抑制病原体的生长,它是宿主对多种微生物病原体反应的一个重要特征[4]。一项最新结果表明,白念珠菌在播散性感染时受铁、锌营养免疫的影响,而在口腔感染时不受铁营养免疫的影响[5]。这也说明营养免疫中金属离子稳态的调节是相当复杂的。人体细胞中的铁外泵蛋白属于主要协同转运蛋白超家族(major facilitator superfamily,MFS)家族,目前在白念珠菌中没有相关铁泵蛋白的报道,所以我们聚焦在白念珠菌中是否有铁泵蛋白的存在,通过在数据库中蛋白的功能描述及相关文献的报道,发现了几个基因的蛋白受白念珠菌铁稳态有关的核心转录因子(Sef1,Sfu1,HAP43)调节,所以我们着重关注了几个基因,分别对其编码基因进行了敲除[6]。在这几个基因研究中我们发现了一个HGT19基因可能涉及到锌离子的代谢,后续做了一系列的其他金属离子点板实验、细胞膜损伤剂点板实验、菌丝诱导实验、小鼠毒力实验等,为后续研究HGT19基因的功能奠定了基础,也为研发新型的靶向药物提供了思路。
1 材料与方法
1.1 菌株和质粒 白念珠菌SN152(his1Δ/his1Δ,arg4Δ/arg4Δ,leu2Δ/leu2Δ,ura3Δ/URA3,iro1Δ/IRO1),为同源重组基因敲除亲本菌株,中国科学院生物化学与细胞生物学研究所陈江野教授惠赠。白念珠菌SN250(leu2Δ::Cm.LEU2/leu2Δ::Cd.HIS1,his1Δ/his1Δ,arg4Δ/arg4Δ,leu2Δ/leu2Δura3Δ/URA3,iro1Δ/IRO1),来源于白念珠菌SN152,与基因敲除株营养型相同,可作为基因敲除株野生型对照的菌株,中国科学院上海巴斯德研究所陈昌斌研究员惠赠。白念珠菌HGT19Δ(HGT19Δ::Cm.LEU2/HGT19,his1Δ/his1Δ,arg4Δ/arg4Δ,leu2Δ/leu2Δ,ura3Δ/URA3,iro1Δ/IRO1),为HGT19单条等位基因敲除株,本研究构建;白念珠菌HGT19Δ/Δ(HGT19Δ::Cm.LEU2/HGT19Δ::Cd.HIS1,his1Δ/his1Δ,arg4Δ/arg4Δ,leu2Δ/leu2Δ,ura3Δ/URA3,iro1Δ/IRO1),为HGT19基因双条等位基因敲除株,本研究构建。pSN40和pSN52分别携带Cm.LEU2和Cd.HIS1编码基因,中国科学院生物化学与细胞生物学研究所陈江野教授惠赠。
1.2 实验动物 6~8周BALB/c小鼠(雌鼠)。
1.3 培养基 YPD培养基(1%酵母提取物,2%蛋白胨,2%葡萄糖,固体培养基另外添加2%琼脂粉),SD培养基(无氨基酵母氮源0.17%,0.5%硫酸铵,其他所需氨基酸,2%葡萄糖,固体培养基另外添加2%琼脂粉),PBS缓冲液(0.8%氯化钠,0.02%氯化钾,0.144%磷酸氢二钠,0.027%磷酸二氢钾)。
1.4 主要试剂和仪器 Phanta Max 高保真DNA聚合酶反应试剂购自中国Vazyme,PCR产物凝胶回收试剂,PCR仪,恒温培养箱等。
1.5 实验步骤
1.5.1 基因敲除株的构建 首先是设计引物,引物序列见表1,利用设计的引物融合所需的基因片段。然后利用醋酸锂转化法将获得的融合基因片段依次转入 SN152 中,替换原基因组中的HGT19基因,构建示意图见图1。接着对转化成功的菌株进行营养型鉴定,最后用酸化玻璃微珠法提取阳性克隆株基因组,利用设计的验证引物进行PCR,验证目的基因与营养标记基因的插入位点,琼脂糖凝胶电泳鉴定长度。
1.5.2 点板实验 首先配置添加不同物质以及不添加这些物质的YPD固体培养基。然后分别挑取野生型菌株和HGT19基因敲除株的单克隆菌落于5 mL新鲜YPD液体培养基200 r/min摇床过夜培养约14~16 h收菌,用磷酸盐缓冲液(PBS)配置1×103CFU/mL~1×107CFU/mL 5个浓度梯度的菌液,吸取2 μL各浓度的菌液,均匀的点在相应的固体培养基表面。最后将平板放置于培养箱孵育48 h后观察生长情况。
1.5.3 结晶紫法生物膜形成实验 挑取野生型菌株和HGT19基因敲除株单克隆菌落于5 mL新鲜YPD液体培养基中,放置于30 ℃恒温摇床内200 r/min摇床过夜培养约14~16 h收菌,用Spider液体培养基(菌丝诱导培养基)配置适量OD600=0.5的菌液。然后将该菌液加入十二孔板中,每孔2 mL,每个菌设1个空白孔,再将十二孔板放置于37 ℃恒温摇床内,200 r/min孵育。90 min后,取出十二孔板吸弃菌液,用PBS洗涤后加入2 mL新鲜的Spider 液体培养基再继续放置于前述条件下孵育。48 h后,取出十二孔板吸弃孔内菌液,先用PBS洗去未附着的菌体和杂志,然后用甲醇固定20 min,再用结晶紫染色30 min,接着用冰醋酸脱色30 min。最后,用酶标仪测定脱色液OD620吸光度值。使用GraphPad Prism 8.0绘制统计图,并进行数据分析。
1.5.4 固体菌丝诱导实验 挑取野生型菌株和HGT19基因敲除株单克隆菌落于5 mL新鲜的YPD液体培养基中,放置于30 ℃恒温摇床内200 r/min过夜培养14~16 h。然后用PBS将菌液稀释至OD600=1,按10倍梯度稀释3次,取5 μL OD600=10-3的菌液在Spider固体培养基上进行点板,最后将培养基放置于37 ℃恒温培养箱孵育7 d,定期进行观察并拍照。
1.5.5 小鼠的毒力实验 先挑选10只6~8周的BALB/c小鼠,体重在22~28 g,分为两组。接着用牛鲍氏计数板计算野生型菌株和HGT19基因敲除株对数生长期的菌液浓度。然后,每只小鼠接种的菌量为5×105CFU/0.1 mL,尾静脉注射。接种后每天观察小鼠的生存状态、饮食饮水情况及体重变化并记录。最后,用GraphPad Prism 8.0绘制生存曲线,秩和检验比较组间差异,P<0.05为差异有统计学意义。
2 结 果
2.1 白念珠菌HGT19基因敲除株构建
2.1.1 营养型鉴定 白念珠菌SN152为基因敲除株的亲本菌,其在营养缺陷的SD培养基上是无法生长的,转化成功的基因敲除菌由于携带了相应的氨基酸标记可以在其对应的缺陷培养基上生长。所以将白念珠菌SN250、SN152、和HGT19Δ/Δ分别连续划线接种于YPD、SD/-LEU和SD/-LEU-HIS固体培养基进行各菌株的营养型鉴定。结果显示,野生型菌株SN250在YPD、SD/-LEU和SD/-LEU-HIS固体培养基上均能生长;亲本菌SN152在YPD固体培养基可以生长,在两种SD固体培养基上均不能生长;HGT19基因双缺株HGT19Δ/Δ在YPD、SD/-LEU和SD/-LEU-HIS固体培养基上均可以生长。如图2所示,营养型鉴定结果均符合预期。
2.1.2 PCR鉴定 以营养型鉴定正确的HGT19Δ/Δ基因组为模板,以上游验证引物(upcheck)+LEU LEFT(5′check)、LEU RIGHT(3′check)+下游验证引物(downcheck)为引物验证Cm.LEU2基因敲除转化组件是否成功替换第1条HGT19等位基因;以上游验证引物(upcheck)+HIS LEFT(5′check)、HIS RIGHT(3′check)+下游验证引物(downcheck)为引物验证Cd.HIS1基因敲除转化组件是否成功替换第2条HGT19等位基因;同时,以HGT19 left和HGT19 right为引物进一步验证2条HGT19等位基因是否被成功敲除;以SN152基因组为模板,HGT19 left和HGT19 right为引物作为阴性对照;以ddH2O为模板,HGT19 left和HGT19 right为引物作为阳性对照;PCR验证结果如图3所示,条带大小均符合预期。

M:2K DNA marker; 1:Cm.LEU2 上游验证(984 bp);2:Cm.LEU2 下游验证(835 bp);3:Cd.HIS1 上游验证(808 bp);4:Cd.HIS1 下游验证(883 bp);5:目的基因敲除验证;6:目的基因敲除阴性对照(SN152为模板,406 bp);7:目的基因敲除阳性对照(ddH2O为模板)。
2.2HGT19基因对白念珠菌环境适应性影响 金属离子在各种生命活动中起着重要的作用,微量金属元素在人体中占酶组分的50%~70%,缺乏相关金属离子就会影响酶的活性,进而影响生命活动的进行[8]。因此,我们在YPD平板中添加不同的金属离子来观察HGT19基因缺失是否对高浓度的金属离子敏感。根据数据库中的高通量计算结果,预测HGT19蛋白定位在细胞膜上,因此我们在YPD平板中添加细胞膜损伤剂SDS,来观察HGT19基因缺失是否对SDS敏感。同时,为了探究HGT19基因对白念珠菌应激能力的影响,我们测试了白念珠菌对不同温度(30 ℃、37 ℃和42 ℃)的敏感性。点板实验结果表明,HGT19Δ/Δ与野生型相比,HGT19Δ/Δ对Zn2+与细胞膜损伤剂SDS敏感,对其他大部分金属离子(Na+、K+、Li+、Ca2+、Fe2+、Fe3+、Cu2+)无明显差异。如图4所示,不同温度的点板实验表明HGT19基因的缺失影响白念珠菌对高温的耐受性。
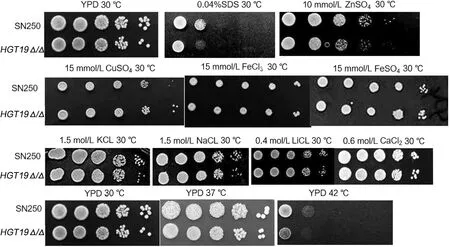
注:将10倍梯度稀释的SN250和HGT19Δ/Δ的菌液滴在不同平板上,相应温度下培养48 h,观察生长情况并拍照。
2.3HGT19基因对白念珠菌生物膜的影响 生物被膜是白念珠菌黏附在宿主组织或非生物表面并且包埋在多糖里的微生物细胞及分泌的细胞外基质组成的结构紧密的膜状物质。白念珠菌可在生物或非生物表面形成生物被膜,生物被膜能帮助白念珠菌抵抗宿主免疫也能对抗真菌药物产生抵抗。由于其高检出率和高耐药性,目前找出有关针对白念生物膜的特异性药物至关重要,因此我们着力于白念珠菌生物膜有关的研究。为了评估白念珠菌HGT19基因对白念珠菌生物被膜形成能力的影响,我们使用Spider液体培养基将野生型和HGT19Δ/Δ菌株分别接种于聚苯乙烯材质十二孔板,在37 ℃的条件下进行生物被膜诱导。野生型菌株SN250和HGT19Δ/Δ生物膜形成实验结果如图5所示。结果显示,HGT19Δ/Δ生物膜形成能力较SN250显著地缺陷(t=5.325,P=0.000 7)。
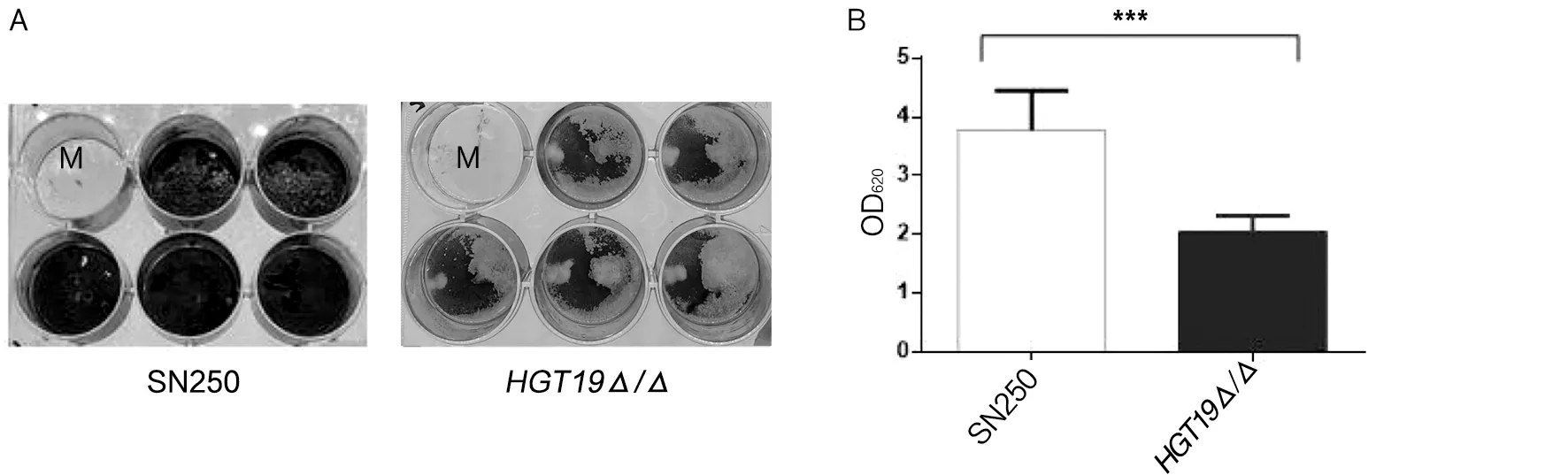
注:A.结晶紫染色;B.脱色液吸光度分析结果;M.空白对照孔;***.P<0.001。
2.4HGT19基因对白念珠菌固体培养基菌丝形成的影响 白念珠菌酵母态-菌丝态转换与其致病性紧密相关。我们评估了在HGT19Δ/Δ与野生型菌株Spider固体培养基上生长7 d后的菌落形态,结果显示HGT19Δ/Δ与野生型的菌丝生长无明显差异(图6)。

图6 HGT19基因的缺失影响不白念珠菌Spider固体培养基上菌丝的形成
2.5HGT19基因对白念珠菌毒力的影响 生存曲线测定结果如图7所示,SN250组小鼠于注射后第4 d陆续开始死亡,于注射后第7 d全部死亡;HGT19Δ/Δ组与SN250组相比,可显著减缓小鼠的死亡。生存曲线通过GraphPad Prism 8.0统计分析,HGT191Δ/Δ组与SN250组比较,差异有统计学意义(P=0.002 6)。以上实验表明,HGT19基因的缺失会显著降低白念珠菌的毒力。
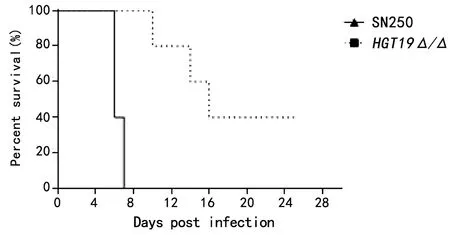
图7 HGT19的缺失影响白念珠菌感染BALB/c小鼠的能力
3 讨 论
白念珠菌是临床最常见的致病真菌,共有约6 100个基因,阐明其基因功能,尤其是与致病性和耐药性相关基因的功能,对发现抗真菌的新策略和新靶点有举足轻重的意义。因此,基因功能研究越来越受到重视。目前白念珠菌基因功能研究的策略主要包括基因敲除和基因表达调控[9]。HGT19基因别名ITR1,位于白念珠菌3号染色体-NC_032091.1。本试验采用LEU2和HIS1营养筛选策略,利用同源重组技术构建白念珠菌HGT19基因敲除株。与新兴的 CRISPR/Cas9 技术相比,在白念珠菌的基因编辑技术中同源重组更为成熟,有着更低的脱靶效应,同时采用LEU2、HIS1 和 ARG4 营养筛选策略,规避了URA3基因缺失对白念珠菌代谢的影响[10-12]。
锌是所有生命形式中普遍存在的金属,因为它是近10%的真核蛋白质(称为锌结合蛋白)的结构成分[13]。锌长期以来一直被认为是宿主与病原体相互作用的关键角色之一。锌离子在许多生命活动中都起着至关重要的作用,包括能量的产生、神经传导、信号传送、营养运输、PH和极性平衡都依赖锌离子[14-16]。对于致病真菌来说,由于环境中的锌水平变化很大,锌又是许多蛋白质的关键结构或者催化的辅助因子,所以在真菌中许多转运体和锌稳态的其他成分的活性在转录水平上受到锌响应转录因子的调节,因此锌离子稳态也一直是研究的热点[17-18]。最新研究表明,一种叫做己基氨基乙酰化醇溶酶体(Hexyl-Aminolevulinate Ethosomes,HAL-ES)的化合物可以通过干扰白念珠菌中锌的稳态来成为潜在的抗真菌药物。该研究表明通过下调白色念珠菌中锌稳态相关基因的表达,HAL-ES可影响白念珠菌的形态转变、生物膜形成、致病性和免疫逃逸[19]。同时也有研究表明营养免疫的锌隔离机制,可触发Hist-5(Histatin-5)内化和细胞杀伤[20]。这些研究都说明锌离子稳态与白念珠菌的致病性有密切关联。但是目前对锌离子和其他金属离子直接的相互作用,尤其是单一基因调控锌及其他金属离子的研究相对较少。本研究通过一系列点板试验发现HGT19Δ/Δ对高浓度锌离子敏感,发现其与Zn2+代谢相关,为后续进一步研究HGT19具体的功能提供了思路,也为抗真菌药物锌途径提供了思路。
白念珠菌对人类宿主的影响取决于其形成生物膜的能力,生物膜是密集排列的细胞群落,粘附在一系列生物和非生物表面。由于其高检出率和高耐药性,目前找出有关针对白念株菌生物膜的特异性药物至关重要,因此研究人员着力于白念珠菌生物膜有关的研究[21-24]。本研究首次发现HGT19Δ/Δ生物膜形成能力有缺陷,后续的小鼠毒力试验也表明HGT19Δ/Δ毒力减弱,这也符合生物膜形成缺陷的结果,具体机制还有待深入研究。
利益冲突:无
引用本文格式:陈婷,黄孝天,张陆兵.白念珠菌HGT19基因敲除株的构建与基因功能初步研究[J].中国人兽共患病学报,2023,39(9):843-849.DOI:10.3969/j.issn.1002-2694.2023.00.101

