2017-2019年济宁市健康人群脑膜炎奈瑟菌流行病学和基因组学分析
王 珊,杜照中,尹 强,韩淑琪,赵 剑,江亚娟,王胜男,温红玲
脑膜炎奈瑟菌(Neisseriameningitidis,N.meningitidis)是一种革兰氏阴性双球菌,人是它的唯一易感宿主,有10%的人群都为脑膜炎奈瑟菌的携带者[1]。当脑膜炎奈瑟菌穿过黏膜上皮侵入到血液时,就会引起严重的侵入性脑膜炎球菌病(invasive meningococcal disease,IMD)[2-3],其主要包括流行性脑脊髓膜炎和菌血症[4]。
根据脑膜炎奈瑟菌荚膜多糖的结构,可以将其分为13个血清群,而大部分的脑膜炎球菌病是由A群、B群、C群、Y群、W群和X群这6个血清群的菌株引起的[5]。目前已有研制出针对于A群、C群、Y群和W群荚膜多糖的疫苗,针对于B群表面蛋白也已研发出疫苗,并且可以覆盖部分B群脑膜炎奈瑟菌[5-6]。由于疫苗的使用,世界各国引起脑膜炎球菌病的菌株的血清型组成发生了很大的变化。在中国,随着1982年开始普及A群荚膜多糖疫苗,原来占据主导的A群脑膜炎奈瑟菌的发病率稳步下降[7],而B群和C群成为脑膜炎球菌病主要致病菌[8]。脑膜炎球菌病主要由健康人群的上呼吸道分泌物传播,而脑膜炎奈瑟菌的传播和携带阶段是致病的先决条件,对健康人群携带脑膜炎奈瑟菌情况进行研究,可以帮助了解脑膜炎奈瑟菌的流行病学情况,并有针对性地采取预防措施[9-10]。
近几年,基因组测序技术发展迅速,细菌全基因组测序的成本也逐渐降低。脑膜炎奈瑟菌在全球范围传播的过程中不断地进化,其基因组复杂多变,并且其经常会发生同源重组现象,因此对其进行全基因组研究很有必要[11]。利用基因组测序的数据,我们可以基于脑膜炎奈瑟菌的核心基因进行cgMLST,这比传统的MLST要更加精准[12]。本研究针对济宁市2017—2019年健康人群脑膜炎奈瑟菌携带情况进行调查,并且分析检出的脑膜炎奈瑟菌的基因组特征。
1 材料与方法
1.1 材 料
1.1.1 主要试剂 巧克力双抗平板和氧化酶试剂购自广东环凯微生物科技有限公司,革兰染液购自珠海贝索生物技术有限公司,生化鉴定试剂购自青岛海博生物,Remel脑膜炎奈瑟菌多价族凝集血清,脑膜炎奈瑟菌乳胶凝集试剂(bioMerieux),QIAGEN QIAamp DNA Mini Kit(51306)。
1.1.2 主要仪器 二氧化碳培养箱购自Thermo Fisher Scientific公司。
1.2 方 法
1.2.1 样本采集 根据《山东省健康人群流行性脑脊髓膜炎带菌状况调查方案》,每一次调查均随机抽取济宁市嘉祥县2个乡镇及1个街道办事处,每个乡镇(街道办事处)选取2个村(居委会)设置调查点,调查对象分为<3岁、3岁~、6岁~、13岁~、17岁~、≥20岁6个年龄组,并且保持男女比例均衡。于2017年4月(流行期)、2018年1月(流行前期)、2018年4月(流行期)、2018年5月(流行后期)、2019年4月(流行期),采集健康人群咽拭子,并对咽拭子标本进行N.meningitidis的检测。
1.2.2 菌株分离、鉴定及血清分型 参照《流行性脑脊髓膜炎诊断标准附录A》(WS295-2008),将采集的咽拭子标本直接接种在提前预热的巧克力双抗平板上,保温运送至实验室,放入37 ℃、5% CO2培养箱中培养24 h。从平板上挑出中等大小、表面光滑、湿润、略带灰白色、半透明露珠状的菌落继续传代培养。分离的菌株进行革兰染色、氧化酶试验、生化鉴定,将革兰染色呈阴性咖啡豆形双球菌、氧化酶阳性、能够分解葡萄糖和麦芽糖且产酸不产气的菌株初步鉴定为N.meningitidis,通过血清玻片凝集试验并辅以乳胶凝集试验进行血清凝集。
1.2.3 基因组提取与测序 复苏2017-2019年菌株(共21株菌株,2株复苏失败),成功复苏的19株N.meningitidis(菌株编号为LN1~LN19)见表2。使用QIAGEN QIAamp DNA Mini Kit(51306)提取细菌基因组,由上海伯杰科技有限公司进行基因组序列测定。使用TruSeqTM DNA Sample Prep Kit进行文库的构建,在Illumina NovaSeq 测序平台上进行了基因组的测序。采用FastQC对数据进行质量控制。采用A5-MiSeq[13]和SPAdes[14]对去除接头序列的测序数据进行从头拼装,获得最终的基因组框架图。测得的基因组数据上传到了PubMLST数据库(https://pubmlst.org/organisms/neisseria-spp)中的 Bacterial Isolate Genome Sequence Database(BIGSdb)[15],以进行后续的数据分析。
1.2.4 系统发育树分析 使用PubMLST网站上的MLST分析工具得到了19株菌株的MLST分型,同时得到了菌株的抗原编码基因的分型,包括PorA-VR1、PorA-VR2和FetA-VR。同时,对19株菌株进行了核心基因组多位点序列分析(cgMLST),并将90%的菌株都存在的基因序列导出,使用IQ-TREE[16]构建了ML系统发育树(bootstrap值为1 000),选择Z2491 (GenBank accession No.NC_003116)作为根。为了进一步研究菌株的详细分群和进化关系,本研究选择了PubMLST数据库中的中国的N.meningitidis的基因组一起进行了cgMLST分析。为了保证所选基因组的测序质量,仅选择了基因组大于1 Mb的基因组,共有436个基因组进行了分析。使用Genome Comparator进行cgMLST分析,参数选择N.meningitidiscgMLST v1.0。使用Splits Tree(v4.18.2)对cgMLST分析得到的差异矩阵进行网络构建。
1.2.5 统计方法 采用SPSS 22.0软件进行统计分析,采用卡方检验比较率的差异,以P<0.05为差异有统计学意义。
2 结 果
2.1 2017-2019年济宁市N.meningitidis流行情况 2017-2019年共检测1 086份健康人群咽拭子标本,检出21株N.meningitidis,带菌率为1.93%。其中2017年带菌率最高,为3.63%;2019年最低,为0.46%。各年龄组的带菌率差异有统计学意义(χ2=20.601,P<0.01),17~19岁年龄组带菌率最高,为6.11%,3~5岁、≥20岁年龄组未分离出N.meningitidis。男性的带菌率为2.31%,女性的带菌率为1.53%,二者差异无统计学意义(χ2=0.869,P>0.05)。见表1。分离到的21株脑膜炎奈瑟菌分为3个血清型,其中B群最多,为15株,C群仅有1株,不可分群为5株。流行期带菌率为2.30%(15/652),流行前期带菌率为0.93%(2/216),流行后期为1.83%(4/218),不同流行时期带菌率差异无统计学意义(χ2=1.398,P>0.05)。

表1 2017—2019年济宁市不同年龄组、不同性别健康人群脑膜炎奈瑟菌带菌率
2.2 19株N.meningitidis的基因组特征、MLST分型及系统发育树 19株N.meningitidis菌株均成功获得了基因组数据,其基因组大小为2.05~2.18 Mb,GC含量均在51.5%~51.9%,具体见表2。值得注意的是,19株N.meningitidis菌株通过血清分型实验测得有3株菌株为不可分群菌株(NG),而通过基因组预测其荚膜血清型均为B型。

表2 19株脑膜炎奈瑟菌的基因组信息
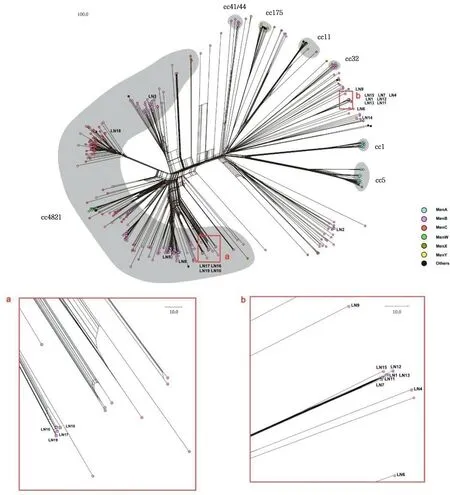
通过MLST分型,19株N.meningitidis菌株的ST序列分型为ST-12301(5株)、ST-14655(4株)、ST-5664(1株)、ST-4821(1株)、ST-5662(1株)、ST-3012(1株)、ST-16838(1株)、ST-17464(1株)、ST-17465(1株)、ST-17466(1株)、ST-17467(1株)和ST-17468(1株)。见图1。其中菌株LN3、LN4、LN5、LN6和LN15的序列型之前从未发现过,为本研究新发现的ST型。

注:红色虚线框内为属于CC4821群的菌株。
5株ST-12301菌株和菌株LN15有着相同的PorA分型(P1.22,14-6),而它们的FetA可变区并没有被匹配到已有的分型中。4株ST-14655菌株中,有3株菌(LN16、LN17和LN19)有着同样的PorA分型(P1.12-1,13-2)和FetA分型(F4-21),而这3株菌株均在2018年流行后期从同一学校高中学生咽拭子中分离得到,提示该型别脑膜炎奈瑟菌可能已在学生中传播,有潜在流行风险。另一株ST-14655菌株有着单独的PorA亚型(P1.12-1,13-9)和FetA亚型(F5-19)。其余菌株各自有独特的PorA分型和FetA分型(图1)。
通过对包括这19株在内的436株N.meningitidis基因组的cgMLST分析构建Neighbor-net网络,见图2。这19株菌株之间的亲缘关系与构建系统发育树所得到的关系基本一致(图1)。在这436株菌株中,有235株来自于无症状携带者,176株来自于患者,有25株并没有登录来源信息。从荚膜血清型来看,这436株菌株分别为A群(39株)、B群(232株)、C群(101株)、E群(1株)、W群(32株)、X群(4株)和Y群(8株),有16株为不可分群,有3株菌没有荚膜血清型信息。由图3A可以看出,无论是来自于无症状携带者的菌株还是来自于患者的菌株,B群和C群都是占比最高的两个类群。来自于患者的菌株中A群和C群的占比要比来自于无症状携带者的高。
注:节点颜色代表了菌株的血清群分型。

注:A.患者与健康携带者分离的菌株中各荚膜血清型的分类情况;B.各克隆群中荚膜血清型的分类情况;C.各克隆群中菌株分离来源情况。
结合cgMLST分析,我们对这436株N.meningitidis菌株克隆群进行了分析。共有11个克隆群被分析出来,其中包括:CC4821(270株)、CC5(29株)、CC11(27株)、CC1(18株)、CC175(11株)、CC41/44(6株)、CC23(3株)、CC8(1株)、CC103(1株)、CC198(1株)和CC269(1株),其他68株菌为UA菌株。根据之前的研究[17],CC4821可以分为4个子系:L44.1、L44.2、L44.3及L44.4,其中L44.1子系的致病性较高。CC4821克隆群中,有84株属于L44.1子系。由图2、图3B和图3C可以看出,各个克隆群中的血清型分布和致病性并不相同。B群和C群主要分布在CC4821和UA群中。而A群主要分布于CC5和CC1克隆群中。W群主要是CC11克隆群。值得注意的是,CC4821中来自于患者的菌株占比为32.6%(88/270),L44.1中来自于患者的菌株占比达到了69.0%(58/84)。
菌株LN3、LN5、LN8、LN10、LN16、LN17、LN18和LN19这8株属于CC4821,而其他11株菌均为不可归类的克隆群。见图2。进一步挑选出436株N.meningitidis中的CC4821构建Neighbor-net网络(图4),并根据之前的研究对其4个子系进行识别,可以看出本研究中分离到的N.meningitidis菌株分属于不同的子系。菌株LN18属于L44.1子系,菌株LN3属于L44.3子系。菌株LN5、菌株LN8以及4株ST-14655(LN10、LN16、LN17、LN19)菌株属于L44.2子系。

图4 基于cgMLST构建的CC4821菌株系统发育树
2.3 19株N.meningitidis菌株的疫苗抗原分析 对19株N.meningitidis菌株的疫苗抗原分析,发现它们之间的疫苗抗原类型有明显的差异(图1)。有7种fHbp肽分型,其中包括fHbp肽分型16(7株)、分型39(6株)、分型571(2株)、分型18(1株)、分型22(1株)、分型405(1株)以及分型14(1株)。除了菌株LN18,所有的CC4821的菌株的fHbp肽都为分型16。NHBA肽分型要更多,共有9种。其中有6株菌株属于NHBA肽分型1059,而4株ST-14655菌株属于NHBA肽分型688。所有的菌株都缺失了NadA肽。
通过分析MenDeVAR指数[18],部分N.meningitidis的表面抗原对Bexsero和Trumenba两种疫苗有交叉反应。仅有菌株LN16的表面抗原fHbp肽分型14对疫苗Bexsero有交叉反应。而7株属于CC4821的菌株的表面抗原fHbp肽分型16和菌株LN6的表面抗原fHbp肽分型14对疫苗Trumenba有交叉反应。
3 讨 论
我国的脑膜炎发病流行期为1-5月,之前的研究表明我国约70%的病例都发生在流行期[19]。在济南市2008-2015年的健康人群脑膜炎奈瑟菌带菌率调查中,济南市的平均带菌率为1.02%,大于7岁年龄组的带菌率最高[20]。而在山西省2016-2017年的调查中,其带菌率为2.99%,15~24岁组带菌率最高[21]。之前对于全球健康者脑膜炎奈瑟菌带菌情况的Meta分析表明,脑膜炎奈瑟菌带菌率在19岁左右达到峰值[1]。本次研究中,流行期健康人群的脑膜炎奈瑟菌带菌率最高,为2.30%,而平均带菌率为1.93%,这符合之前的研究结果。本次研究中带菌者主要分布于17~19岁的年龄组,带菌率达6.11%,这与之前的研究基本相符,今后应重点关注该年龄组人群。
我国自1982年开始普及A群荚膜多糖疫苗,流脑的发病率明显下降,同时我国脑膜炎奈瑟菌的主要血清群由A群向B群和C群转移[8]。2005-2015年江西省分离到的脑膜炎奈瑟菌中,有60.12%为C群,29.76%为B群,16%为不可分群[22]。2011-2021年,浙江省脑膜炎奈瑟菌的研究中,有53.33%确诊病例是由B群脑膜炎奈瑟菌引起的,20%为C群,而健康人群携带的脑膜炎奈瑟菌中有70.59%为B群,5.88%为C群,17.65%为不可分群[10]。本次研究中,在济宁市分离到的阳性菌株里,B群占比最高,为71.43%(15/21),C群为4.76%(1/21),不可分群为23.80%(5/21)。同时,在对全国436株脑膜炎奈瑟菌基因组进行分析时,B群和C群也占据了主要的类群,这与之前的研究相吻合。值得注意的是,在本研究分离到的菌株中,有3株菌血清型为不可分群,而通过对基因组的分析,其基因型为B型,这可能是因为荚膜基因簇cps中的唾液酸荚膜生物合成基因cssA-C或多聚唾液酸转移酶基因csb中产生了滑链错配,从而使基因相位变异导致荚膜不能正常表达[23-24]。
CC4821群为我国发现的一类脑膜炎奈瑟菌,2003年其在安徽省暴发之后就迅速扩散成为我国脑膜炎奈瑟菌的主要克隆群之一[25]。CC4821群主要由B型和C型血清群构成,且之前的研究发现,它们之间存在着荚膜转换和基因重组[26-27]。多个研究表明CC4821群内存在着明显的聚类分支[26,28],最近的一项研究将CC4821群分为L44.1、L44.2、L44.3和L44.4四个分支,而多数的患者分离菌株都为L44.1分支[17]。本研究中完成基因组测序的19株菌株中,有42.1%(8/19)属于CC4821群,其余菌株都不能归类于特定的克隆群。其中菌株LN18属于L44.1分支,其血清型为C型,经分析其FetA基因型为3-3,与之前研究L44.1分支中患者分离株的分型相同[17],该菌株可能有潜在的致病性。在对全国436株脑膜炎奈瑟菌基因组进行分析时,有61.93%(270/436)的菌株都属于CC4821群,而其中L44.1分支来自于患者的菌株占比达到了69.0%(58/84)。这与之前的研究基本一致。这些结果表明在接下来的研究中CC4821群仍是值得重点关注的类群。
综上,通过研究分析对2017-2019年济宁市健康人群脑膜炎奈瑟菌的流行情况有了一定了解,同时我们从基因组层面上细致深入的分析了菌株的遗传特征,发现5种新的ST型。这为接下来的研究工作打下了基础,并指引了方向。我们将持续监测济宁市健康人群脑膜炎奈瑟菌的流行状况,并从基因组水平研究其进化发育特征,及早发现潜在的流行风险,为制定预防控制策略提供依据。
利益冲突:无
引用本文格式:王珊,杜照中,尹强,等.2017-2019年济宁市健康人群脑膜炎奈瑟菌流行病学和基因组学分析[J].中国人兽共患病学报,2023,39(9):879-886.DOI:10.3969/j.issn.1002-2694.2023.00.093

