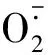初花期冷害对绿豆叶片生理的损伤及烯效唑的缓解效应
李 琬,项洪涛,何 宁,王雪扬,曾玲玲,刘 淼,姜连子,姜 辉,刘 佳
(1.黑龙江省农业科学院 耕作栽培研究所,哈尔滨 150086;2. 黑龙江省农业机械工程科学研究院绥化分院,黑龙江绥化 152054;3.黑龙江生物科技职业学院,哈尔滨 150025)
绿豆(Vignaradiata)是豆科菜豆族豇豆属一年生草本植物,是中国重要的传统食用豆类作物之一,在国内具有悠久的栽培历史。绿豆籽粒具有高蛋白、低脂肪、药食同源等特点,是现代功能性食品开发的重要资源[1]。绿豆生育期短、抗旱耐瘠薄、适应性强,在农业供给侧结构性改革中具有重要作用[2]。绿豆起源于热带,属于冷敏感作物,对生长环境中的温度具有较高要求,低温环境下会遭受冷害损伤。尤其是初花期,绿豆对温度极为敏感,作为营养生长和生殖生长的并存关键期,初花期发生冷害会减少柱头的花粉粒数量和质量,导致花荚脱落,产量降低[3]。
在生育进程中,作物会不可避免地受到低温的影响,这也是抑制作物生长发育及产量的最主要逆境之一[4]。低温胁迫对作物的生理代谢活动具有明显的影响,使作物产生复杂的生物化学和生理学上的响应[5]。低温胁迫能够引起作物体内活性氧类物质、抗氧化酶活性、渗透调节物质含量等发生变化[6]。一般而言,冷害可以导致作物氧化应激反应剧烈增强,导致活性氧类物质异常累积,并引发细胞膜质过氧化,进而引起细胞膜结构蛋白和酶的空间结构改变,打乱细胞正常的生理功能和代谢活动,质膜透性增大、胞内电解质外渗,最终可能使得细胞死亡[7]。
低温条件下,胁迫起初诱发超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等抗氧化酶活性提高,以清除过量积累的活性氧类物质(ROS),进而起到抵御低温损伤的作用;可溶性糖、脯氨酸等渗透调节物质含量提高,以维持细胞结构、细胞运输和调节渗透压,具有一定的抗性和保护作用[4]。在低温胁迫下,植物自身会产生对逆境的适应性反应,随着温度降低,植物体内的SOD、POD和CAT活性在一定范围内都呈上升趋势,可溶性糖和可溶性蛋白含量也呈上升的趋势。SOD、POD和CAT活性的提高是作物应对低温逆境时的自我保护行为,以增强作物对低温的耐受力[8]。但随着低温强度的增加,植物的自我保护机制遭到破坏,导致生理代谢受损,诸如抗氧化酶活性急速降低、ROS大量积累,并对细胞膜系统、脂类、蛋白质和核酸等大分子产生强烈的破坏作用,最终诱发作物的生理机制遭到不可逆破坏并引起减产。研究表明,苗期低温可导致小豆百粒质量下降2.58%~10.61%[9],花期低温可引起绿豆产量下降10.29%~30.88%[10]。
当前,国内关于低温胁迫的研究主要集中在大宗粮食作物上,对食用豆类作物的低温胁迫研究较少,尤其是关于植物生长调节剂缓解绿豆花期低温胁迫的生理响应研究较少。因此本试验于初花期对绿豆进行低温胁迫,开展冷害及预喷施S3307对绿豆叶片抗逆生理及产量的影响研究,重点从活性氧类物质积累-抗氧化酶活性-渗透调节物质含量-产量这一主线进行试验,旨在分析S3307抵御绿豆花期低温的作用,以期为绿豆抗冷栽培及保产和丰产提供理论支持。
1 材料与方法
1.1 试验材料
供试绿豆品种为‘绿丰5号’(本文用L5表示)和‘绿丰2号’(本文用L2表示),由国家食用豆产业技术体系齐齐哈尔试验站馈赠。供试植物生长调节剂为S3307,由黑龙江八一农垦大学化控研究中心提供。
1.2 试验设计
试验于2020年在黑龙江省农业科学院耕作栽培研究所盆栽场(N 45°75′, E 126°63′)及人工气候室内进行。试验共设4个处理,每个处理设3次重复,具体设计见表1。试验采用盆栽方式,盆高23 cm、直径25 cm,每盆装自然风干壤土 5.5 kg,播种后覆土200 g,每盆播种15株 (5穴×3株),待植株长至V2期时,每盆定苗5株,其中每处理使用30盆,指定15盆用于生理取样,剩余15盆用于测产。待所有植株生长至初花期,即50%以上植株现蕾开花时,于处理当天 9:00,叶面喷施浓度为50 mg·L-1的S3307(该浓度系本课题组前期浓度比较试验筛选所得),折合用液量为22.5 mL·m-2。翌日上午9:00进行低温处理,处理温度平均为15 ℃,温度24 h变化趋势见图1。低温24 h后,开始第一次取样,之后每24 h进行取样,本试验共取样5次,记为取样 1~5 d。同时各处理在取样期间每天解除低温胁迫3盆,恢复正常气温条件。盆栽全生育期根据实际气温和降雨情况,适时浇水直至成熟测产。
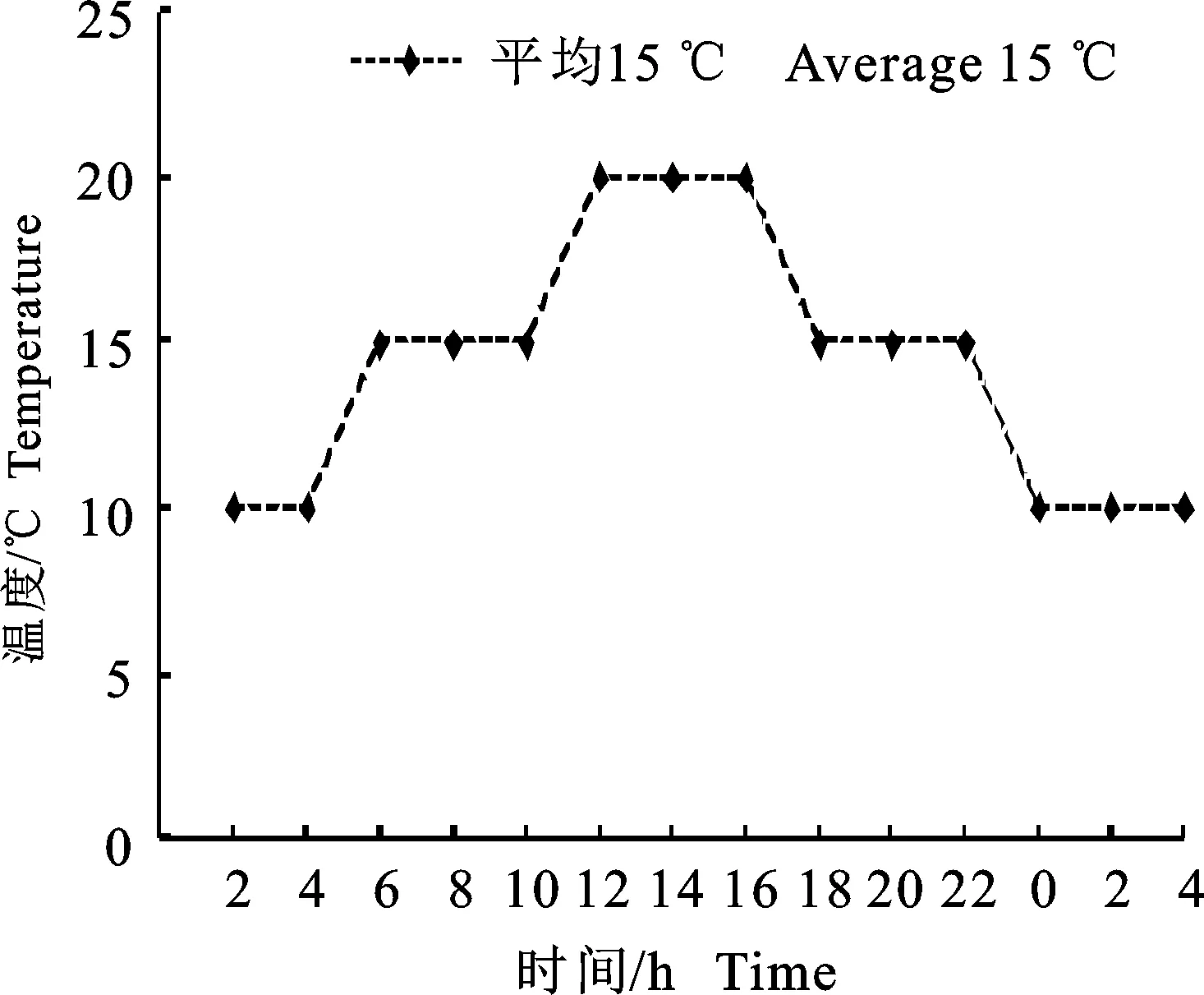
图1 24 h温度变化Fig.1 Change of temperature in 24 hours

表1 试验设计方案Table 1 Experiment design
1.3 测定指标与方法
1.3.1 取样方法 各处理分别取样,将绿豆植株叶片(每盆4株,倒3叶)迅速剪下装入事先标记好的自封袋内,并立即放入液氮中,充分冷冻后置于-80 ℃冰箱中保存,供测定生理指标使用。将每盆剩余1株植株的倒三叶片剪取1.0 cm2的方块,然后用去离子水清洗,放入盛有去离子水的试管中,以备测定电解质渗透率。
1.3.2 测定方法 过氧化氢(H2O2)含量使用试剂盒测定,主要采用氧化硫酸钛比色法。采用羟胺氧化法测定超氧阴离子产生速率,具体操作方法参照高俊凤[15]的方法。采用氮蓝四唑(NBT)法测定超氧化物歧化酶(SOD)活性,采用愈创木酚法测定过氧化物酶(POD)活性,采用分解过氧化氢含量速率法测定过氧化氢酶(CAT)活性,具体操作规程按照李合生等[16]的方法。采用茚三酮比色法测定脯氨酸含量,可溶性糖含量测定采用硫酸蒽酮比色法,具体操作规程按照张宪政[17]的方法。

表2 不同品种、不同处理和不同取样时间下叶片H2O2含量的方差分析(F值)Table 2 Variance analysis of leaf H2O2 content on rate under different varieties, different treatments and different sampling times(F value)
1.4 数据处理
利用Excel 2010处理试验数据并作图,使用DPS软件选择新复极差法进行显著性差异检验。
2 结果与分析
2.1 低温胁迫及喷施S3307对绿豆叶片活性氧类物质积累的影响
2.1.1 对叶片过氧化氢(H2O2)含量的影响 由图2可知,正常条件下,预喷施S3307对绿豆叶片内H2O2含量的积累影响较小,经过方差分析可知,仅L5品种处理第5天时,T1较CK显著低 2.42%。低温处理引起叶片内H2O2含量迅速积累,方差分析结果表明,不论是L5还是L2,各取样时间内,T2处理的H2O2含量均显著高于CK。喷施S3307可有效降低低温条件下绿豆叶片内H2O2含量,L5在处理1~5 d时,T3较T2分别降低8.54%、8.11%、7.95%、6.45%和6.09%,方差分析结果表明T3均显著低于T2。L2在处理1~5 d时,T3较T2分别降低3.04%、 2.51%、4.81%、6.47%和4.30%,方差分析结果表明T3均显著低于T2。由表2可知,不同品种(A)、不同处理(B)和不同取样时间(C)对H2O2含量达极显著影响(F值分别为845.98、1318.76和228.79),双因素A×B(F=34.45)、A×C (F=11.48)和B×C(F=87.25)互作效应对H2O2含量具有极显著影响,而三因素A×B×C交互作用(F= 2.15)对H2O2含量达到显著影响。
不同小写字母表示同一天内不同处理间差异在P<0.05水平具有显著性,误差线所示为标准误差。下同
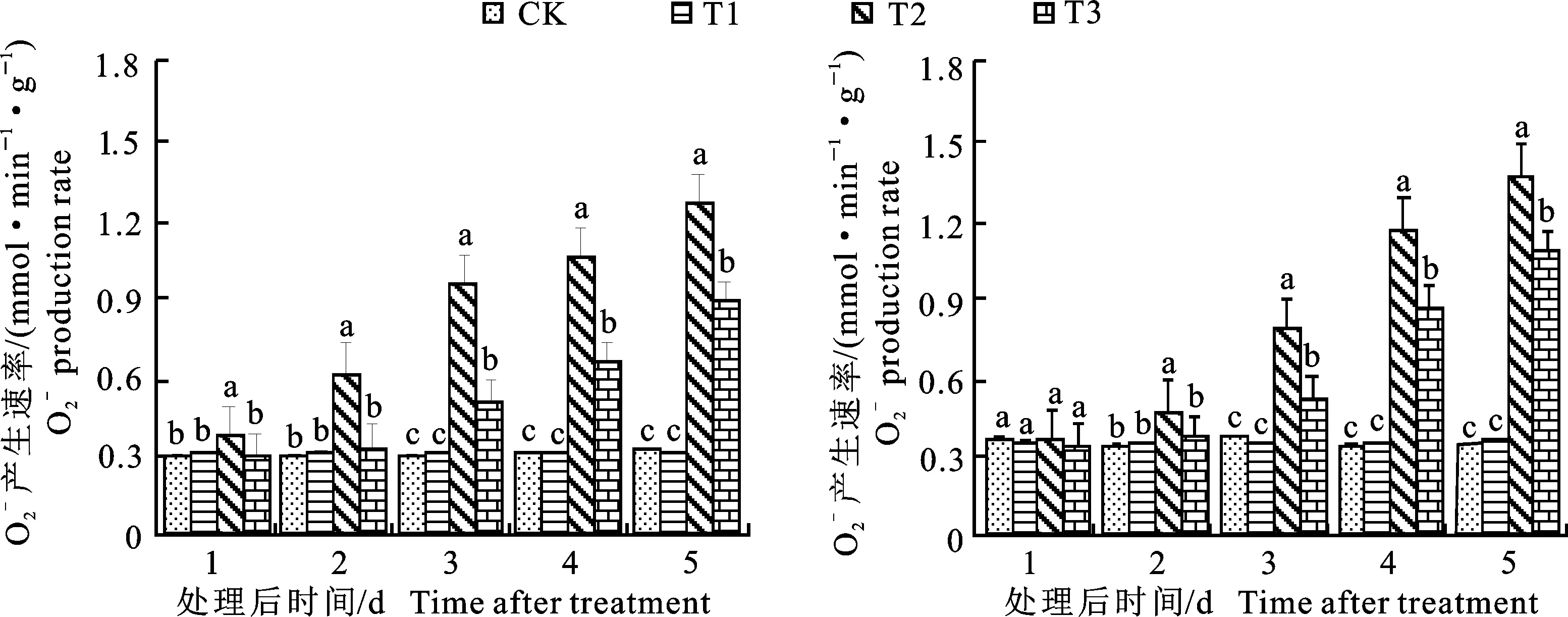
图3 不同处理下绿豆叶片的超氧阴离子产生速率 Production rate in leaves of mung bean under different treatments
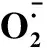
表3 不同品种、不同处理和不同取样时间下绿豆叶片产生速率的方差分析(F值)Table 3 Variance analysis of leaf production on rate under different varieties, different treatments and different sampling time(F value)
2.2 低温胁迫及喷施S3307对绿豆叶片抗氧化酶系统的影响
2.2.1 对叶片超氧化物歧化酶(SOD)活性的影响 从图4可以看出,正常温度条件下,预喷施S3307对绿豆叶片内SOD活性没有显著性影响。低温处理对SOD活性具有明显的提高作用,方差分析结果表明,不论是L5还是L2,各取样时间内,T2均显著高于CK。预喷施S3307可进一步有效提高低温条件下绿豆叶片内SOD活性,就L5来说,处理1~5 d时,T3较T2分别提高 11.17%、 8.53%、12.40%、16.63%和16.62%,经方差分析可知T3均显著高于T2。就L2来说,处理1~5 d时,T3处理的SOD活性均高于T2处理,方差分析结果表明T3较T2分别显著提高 35.47%、60.89%、69.02%、29.57%和 22.04%。由表4可知,不同品种、不同处理和不同取样时间对绿豆叶片SOD活性均具有极显著影响,且双因素交互和三因素交互作用对SOD活性也达极显著影响。
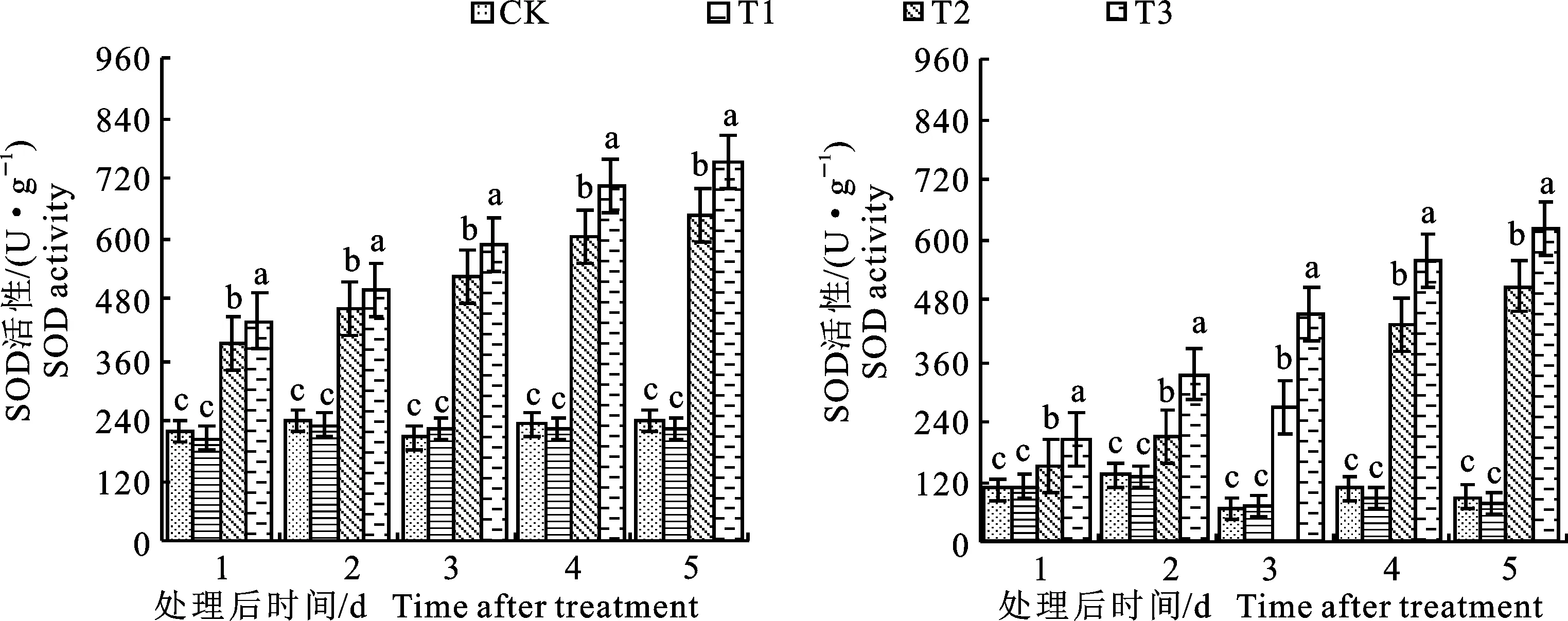
图4 不同处理下绿豆叶片的SOD活性Fig.4 SOD activity in leaves of mung bean under different treatments
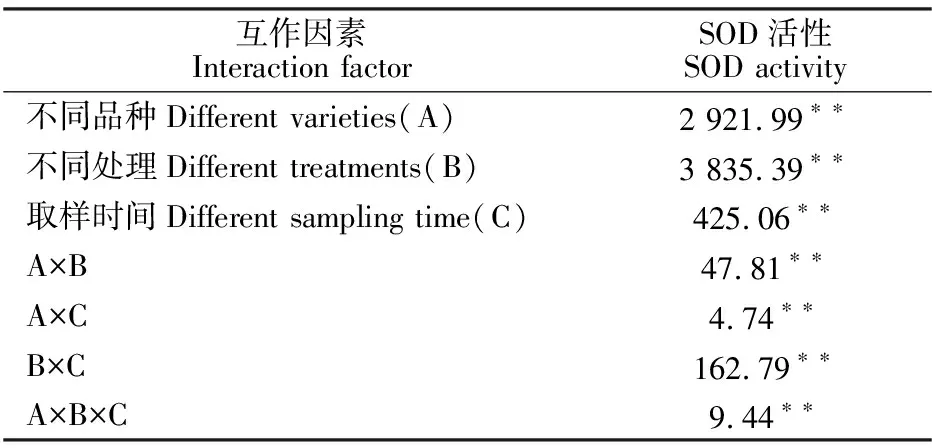
表4 不同品种、不同处理和不同取样时间下绿豆叶片SOD活性的方差分析(F值)Table 4 Variance analysis of leaf SOD activity under different varieties, different treatments and different sampling time(F value)
2.2.2 对叶片过氧化物酶(POD)活性的影响 从图5可以看出,正常条件下,预喷施S3307对绿豆叶片POD活性具有一定影响,不同品种间差异较大,就L5来说,方差分析结果表明T1与CK之间差异不显著。就L2来说,处理后1~2 d表现为T1较CK高3.05%和6.01%,方差分析结果表明差异均达到显著水平。低温处理引起POD活性增强,就L5来说,方差分析结果表明T2与CK之间的差异均达到显著水平。就L2来说,处理后 4~5 d表现为T2较CK高48.26%和37.69%,方差分析结果表明差异均达到显著水平。喷施S3307可进一步提高绿豆叶片POD活性,呈线性升高的变化趋势。方差分析结果表明,不论是L5还是L2,各取样时间内,T3均显著高于T2。另外,由表5可知,不同品种、不同处理和取样时间及其双因素和三因素交互作用对绿豆叶片POD活性均存在极显著影响。
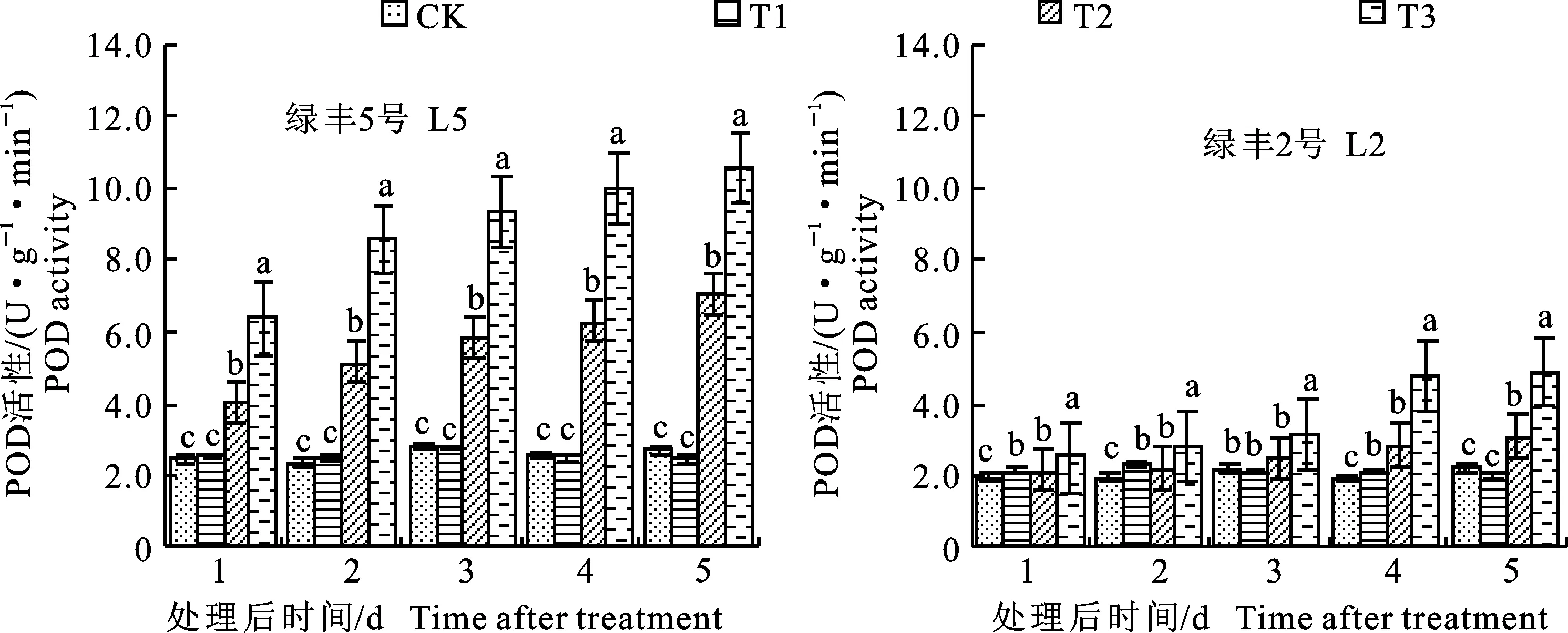
图5 不同处理下绿豆叶片的POD活性Fig.5 POD activity in leaves of mung bean under different treatments
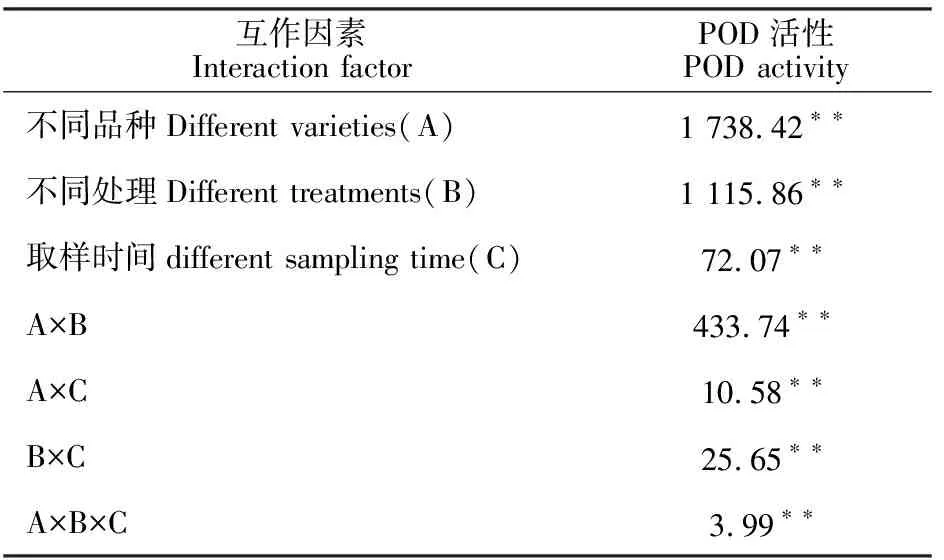
表5 不同品种、不同处理和不同取样时间下绿豆叶片POD活性的方差分析(F值)Table 5 Variance analysis of leaf POD activity under different varieties, different treatments and different sampling time(F value)
2.2.3 对叶片过氧化氢酶(CAT)活性的影响 由图6可知,正常温度下,预喷施S3307对绿豆叶片活性影响不大,经方差分析可知,仅L5处理的第3天、L2处理的第4天,T1显著高于CK,这可能与取样误差有关。低温处理对绿豆叶片CAT活性影响较大。就L5来说,与CK相比,T2分别提高了66.67%、16.00%、178.57%、95.45%和 144.44%,经方差分析可知,除处理第2天外,其他取样时间,T2均显著高于CK。就L2来说,与CK相比,T2分别提高了10.00%、33.33%、 105.88%、241.67%和178.57%,经方差分析可知,处理后2~5 d时,T2均显著高于CK。喷施S3307具有提高CAT活性的调节效应,方差分析结果表明,处理后2~5 d时,L5和L2均表现为T3显著高于T2。由表6可知,不同品种、不同处理、不同取样时间和不同处理×不同取样时间对绿豆叶片CAT活性达极显著影响,不同品种、不同处理、取样时间的三因素互作对CAT活性具有显著影响,而不同品种×不同处理和不同品 种×不同取样时间的交互作用对CAT活性影响不显著。

图6 不同处理下绿豆叶片的CAT活性Fig.6 CAT activity in leaves of mung bean under different treatments
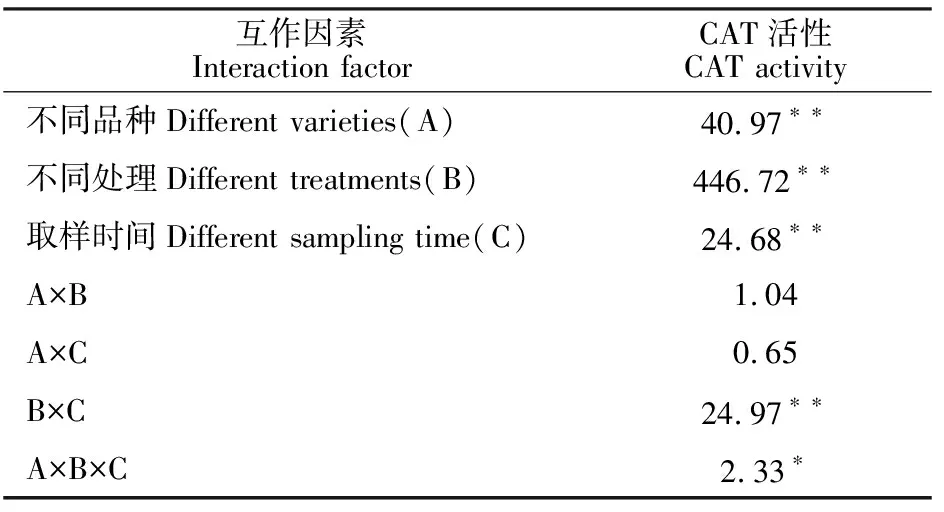
表6 不同品种、不同处理和不同取样时间下绿豆叶片CAT活性的方差分析(F值)Table 6 Variance analysis of leaf CAT activity under different varieties, different treatments and different sampling time(F value)
2.2.4 对叶片SOD/POD的影响 由表7可知,正常气温条件下喷施S3307,SOD/POD整体呈降低的变化趋势,有利于提高根系对逆境的抗性,但方差分析结果表明,各品种内的T1和CK之间无显著性差异。低温引起绿豆叶片内SOD/POD整体呈升高趋势,就L5来说,处理后1 d、 3~5 d时均表现为T2>CK;就L2来说,处理后1~5 d均表现为T2>CK;这不利于作物对低温的抵抗,但方差分析结果表明,各品种内的T2与CK之间的差异未达到显著差异水平。喷施S3307对不同品种SOD/POD值的调控效应不同,就L5来说,处理1~5 d时,T3均低于T2,方差分析结果表明,处理2~5 d时,T3显著低于T2(P<0.05)。就L2来说,处理1~3 d时,表现为T3>T2,但方差分析结果表明T3与T2之间未达到显著差异;处理4~5 d时,T3均低于T2,方差分析结果表明T3与T2之间达到显著差异水平(P<0.05)。
表7 不同处理下绿豆叶片的SOD/POD值Table 7 SOD/POD value in leaves of mung bean under different treatments
2.3 低温胁迫及喷施S3307对绿豆叶片渗透调节物质含量的影响
2.3.1 对叶片脯氨酸含量的影响 从图7可以看出,预喷施S3307对绿豆叶片脯氨酸含量具有一定的调控效应。就L5来看,处理1~5 d时,与CK相比,T2分别增加了3.73%、18.27%、 37.29%、23.59%和3.49%,方差分析结果表明,处理2~4 d时,T1显著高于CK。就L2而言,处理1~5 d时,与CK相比,T2分别增加了 11.72%、43.77%、79.68%、72.66%和50.19%,方差分析结果表明,处理3~5 d时,T1显著高于CK。整体来看,预喷施S3307对绿豆叶片脯氨酸含量具有调增的效应,这对绿豆抵御低温有利。低温引起绿豆叶片内脯氨酸含量增加,就L5来看,处理1~5 d时,T3较CK分别增加了 1.07%、7.41%、9.20%、9.65%和5.49%,但方差分析结果表明各取样时期T3与CK之间差异均不显著。就L2而言,处理1~5 d时,T3较CK分别增加了26.37%、49.06%、74.10%、19.48%和0.77%,方差分析结果表明,处理1~3 d时,T3与CK之间差异达到显著水平。低温条件下喷施S3307可进一步提高脯氨酸含量,就L5来说,经方差分析可知,处理1~5 d时,T3较T2分别显著增加了31.13%、14.25%、36.36%、 42.54%和6.62%;就L2而言,经方差分析可知,处理1~5 d时,T3与T2之间未达到显著差异水平。由表8可知,除不同品种和不同取样时间对脯氨酸含量影响不显著外,不同品种、不同处理、不同取样时间及其双因素和三因素交互作用对脯氨酸含量均具有极显著影响。
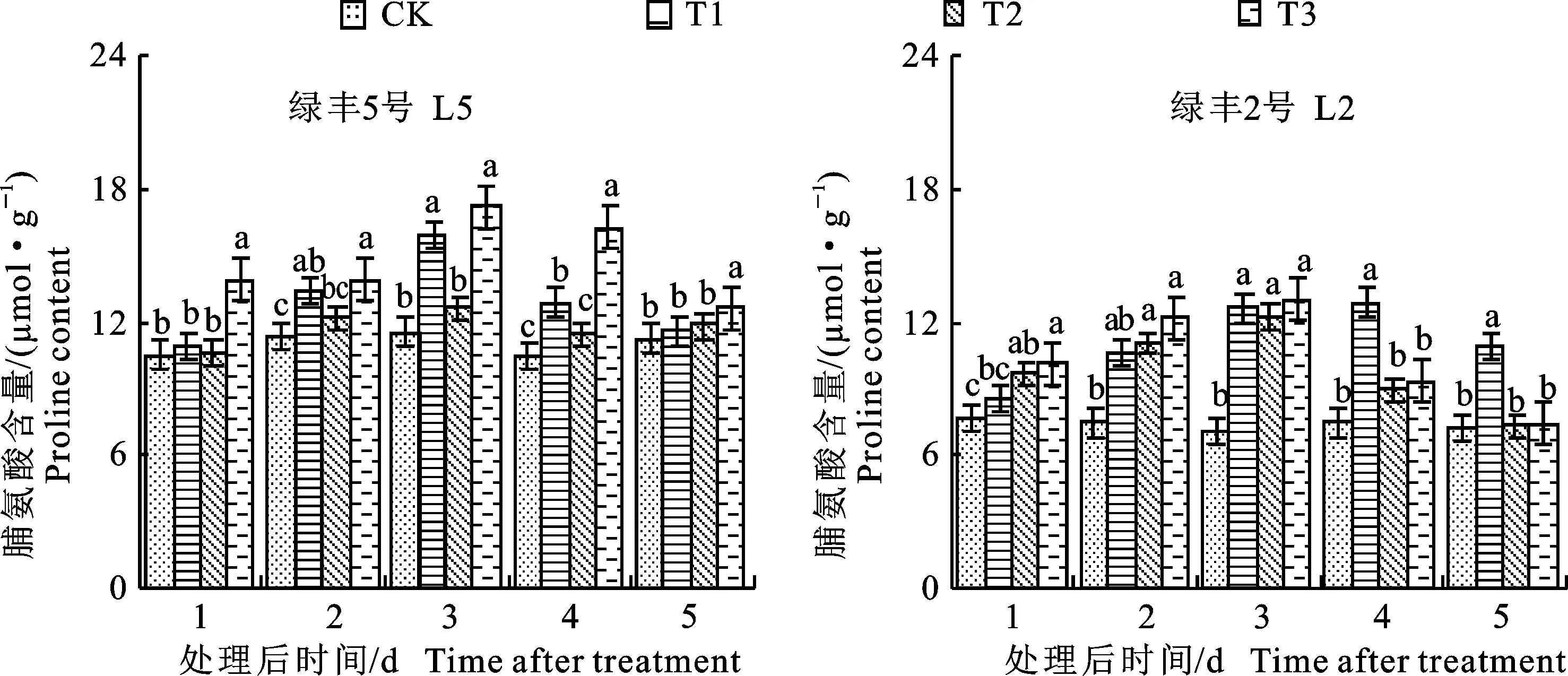
图7 不同处理下绿豆叶片的脯氨酸含量Fig.7 Proline content in leaves of mung bean under different treatments
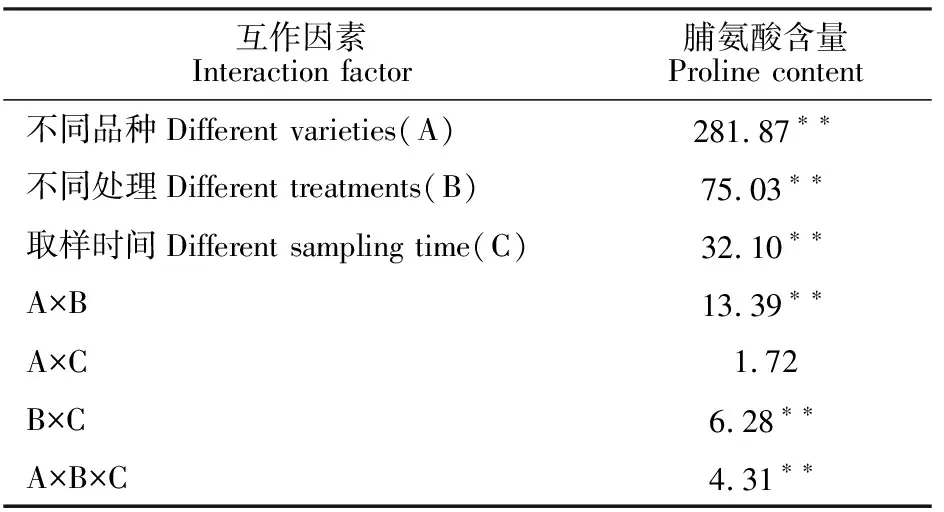
表8 不同品种、不同处理和不同取样时间下绿豆叶片脯氨酸含量的方差分析(F值)Table 8 Variance analysis of leaf proline content under different varieties, different treatments and different sampling time(F value)
2.3.2 对叶片可溶性糖含量的影响 由图8可知,预喷施S3307对可溶性糖含量具有一定的调节作用。对L5来说,处理1~5 d时,T2较CK分别增加了9.25%、3.92%、0.86%、6.51%和 2.43%,方差分析结果表明,处理1 d和3 d时,T1显著高于CK。对L2而言,经方差分析可知仅在处理2 d时,T1显著高于CK,其他取样时期二者无显著差异。低温引起绿豆叶片内可溶性糖含量增加,就L5来看,处理1~5 d时,T3较CK分别增加了7.57%、8.71%、29.05%、40.60%和 25.00%,经方差分析可知,除处理2 d外,其他取样时期T3与CK之间差异均达到显著水平。就L2而言,处理1~5 d时,T3较CK分别增加了5.25%、14.37%、16.94%、31.21%和5.63%,方差分析结果表明,处理2~5 d时,T3与CK之间差异达到显著水平。低温条件下喷施S3307可进一步提高可溶性糖含量,就L5来说,经方差分析可知,处理1~5 d时,T3较T2分别显著增加了9.43%、15.01%、9.41%、8.32%和8.88%;就L2而言,处理1~5 d时,T3较T2分别增加 5.50%、6.22%、4.26%、11.82%和6.67%,方差分析结果表明,处理2~5 d时,T3与T2之间差异达到显著水平。由表9可知,不同品种、不同处理和取样时间对可溶性糖含量具有极显著影响,不同品种×不同处理和不同处理×不同取样时间的双因素交互作用以及不同品种×不同处理×不同取样时间的三因素交互作用对可溶性糖含量具有极显著影响。
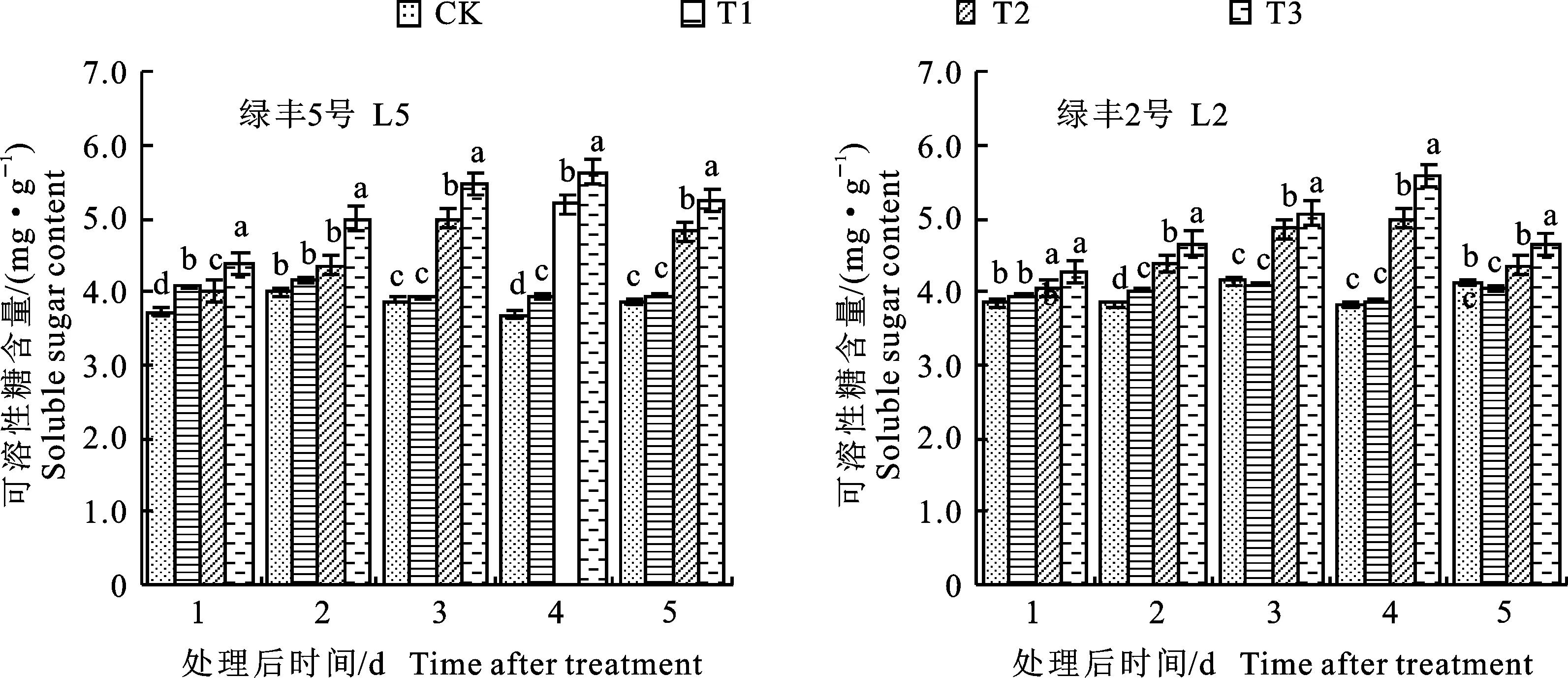
图8 不同处理下绿豆叶片的可溶性糖含量Fig.8 Soluble sugar content in leaves of mung bean under different treatments
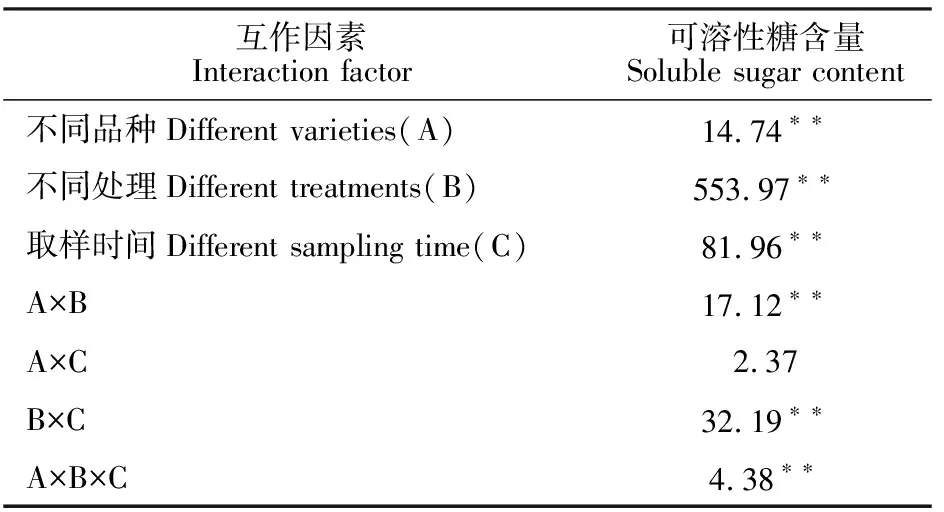
表9 不同品种、不同处理和不同取样时间下绿豆叶片可溶性糖含量的方差分析(F值)Table 9 Variance analysis of leaf soluble sugar content under different varieties, different treatments and different sampling time(F value)
2.4 低温胁迫及喷施S3307对绿豆产量的影响
由表10可知,正常条件下,初花期喷施S3307具有提高绿豆盆栽产量的效应,‘绿丰5号’表现为T1较CK高出1.49 g·盆-1,增幅为 5.67%,经方差分析可知达到显著差异水平(P<0.05);‘绿丰2号’的T1较CK高出2.33g·盆-1,增幅为8.73%,方差分析结果表明二者之间差异显著(P<0.05)。初花期冷害引起绿豆产量下降,方差分析结果表明‘绿丰5号’处理 1~5 d时,T2较CK相比均显著降低P<0.05);单盆产量降幅分别为11.58%、17.78%、27.19%、33.24%和46.27%;‘绿丰2号’处理 1~5 d时,T2较CK相比均显著降低P<0.05);单盆产量降幅分别为12.74%、18.82%、 28.04%、36.58%和44.75%。冷害条件下预喷施S3307具有提高产量的调控效应,就‘绿丰5号’来说,处理1~5 d时,T3较T2每盆分别增加了1.88 g、1.69 g、1.56 g、1.20 g和1.31 g,增幅分别为8.10%、7.83%、8.16%、 6.85%和 9.28%,方差分析结果表明T3与T2之间达到显著差异水平(P<0.05);就‘绿丰2号’来说,处理 1~5 d时,T3较T2每盆分别增加了 2.27 g、 2.35 g、1.80 g、2.33 g和2.36 g,增幅分别为 9.75%、10.85%、9.38%、13.77%和 16.01%,方差分析结果表明T3与T2之间达到显著差异水平(P<0.05)。由表11可知,不同品种、不同处理和取样时间对单盆产量具有极显著影响,不同品种×不同处理和不同处理×不同取样时间的双因素交互作用对单盆产量也具有极显著影响,而不同品种×不同时间和不同品种×不同处理×不同取样时间的三因素交互作用对单盆产量影响不显著。
表10 不同处理下绿豆的单盆产量Table 10 Yield per pot of mung bean under different treatments
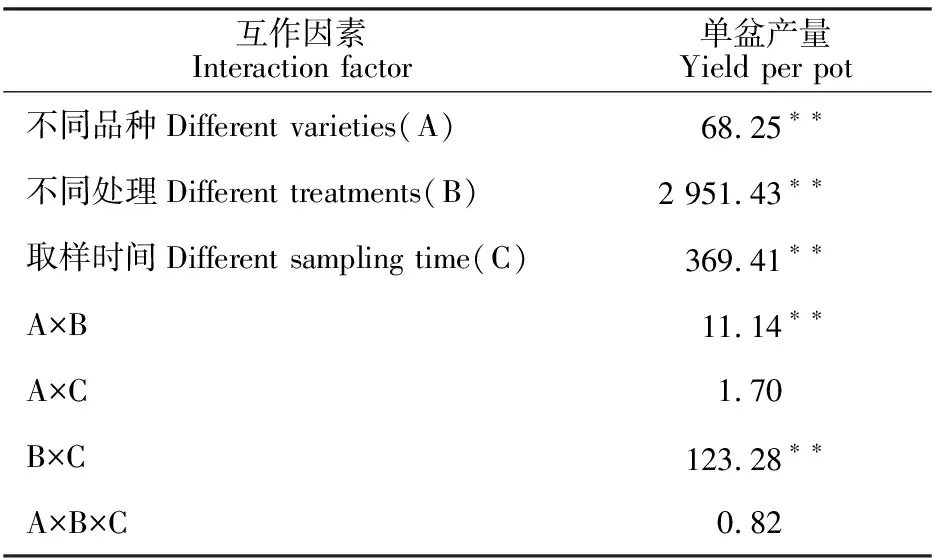
表11 不同品种、不同处理和不同取样时间下绿豆产量的方差分析(F值)Table 11 Variance analysis of mung bean yield under different varieties, different treatments and different sampling time(F value)
3 讨 论
低温作为农作物生长发育过程中不可避免的自然灾害,是影响作物生长发育、产量和品质的重要非生物胁迫之一[18-19]。低温可导致植物体内活性氧代谢失衡、自由基积累、细胞膜透性增加、代谢紊乱,及蛋白质变性、核苷酸损伤等,严重时可致细胞死亡[20],从而造成植物严重受损甚至绝产。
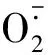
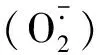
渗透调节是植物抵御低温逆境的另一种重要生理机制[8]。脯氨酸、可溶性糖和可溶性蛋白是植物体内重要的渗透调节物质,在提高植物抗性方面发挥着重要作用[28]。可溶性糖和脯氨酸是植物应对低温胁迫重要的渗透调节物质,耐寒性强的种质在低温下能迅速积累可溶性糖和脯氨酸,以提高细胞液浓度,降低冰点温度,保持细胞不至于遇冷凝固。植物可溶性糖含量与耐寒性总体上呈正相关关系,而脯氨酸含量与耐寒性的关系尚无统一定论[29]。本研究结果表明,低温胁迫引起绿豆叶片可溶性糖含量显著提高,这与赵晶晶[3]的研究结果类似。但脯氨酸含量的变化因品种而异,低温胁迫对‘绿丰5号’叶片内脯氨酸含量没有显著影响,但可显著提高‘绿丰2号’叶片内的脯氨酸含量,这可能与两个品种的抗冷基因的诱导表达不同有关,因为逆境胁迫下,植物体内脯氨酸的积累主要由其生物合成降解共同作用调控,有报道指出低温胁迫下脯氨酸的积累与脯氨酸合成酶基因——鸟氨酸转氨酶基因(OAT)和△′-吡咯林-5-羧酸合成酶基因(P5CS)基因表达的提高,以及脯氨酸脱氢酶基因(ProDH)表达的下降有关[30]。本研究表明低温条件下,喷施S3307能进一步提高渗透调节物质含量,显著提高可溶性糖的含量,这与赵晶晶[3]、项洪涛等[14]的研究结果相同。可溶性糖含量的提高有利于提高植物的抗逆性,因为可溶性糖是植物体内的重要代谢产物,能与水结合,促进细胞束缚水含量积累并增强细胞液的流动性,维持细胞的正常功能[31],并且可溶性糖含量的增加能够提高细胞渗透压浓度[19],这也是S3307提高植物抗逆性的生理原因之一。
低温胁迫导致豆科作物产量下降,赵晶晶等[10]、王新欣[23]研究表明,开花期低温降低了大豆产量,项洪涛等[14]指出苗期低温降低了红小豆产量,本研究得出相同结论,低温处理1~5 d导致‘绿丰5号’单盆产量显著下降11.58%~ 46.27%,‘绿丰2号’显著下降12.74%~ 44.75%。预喷施S3307能缓解冷害引起的产量损失[4,9],本研究也得到相同结果,喷施S3307能有效缓解冷害对绿豆产量的影响,‘绿丰5号’处理1~5 d时,单盆产量显著提高6.85%~ 9.28%,‘绿丰2号’处理1~5 d时,单盆产量显著提高9.38%~ 16.01%。
4 结 论