外源核黄素处理对上海青采后品质及抗氧化活性的影响
刘雪松,李韫同,朱俊臻,安容慧,徐晓阳,李鹏霞,3,,*
(1.江苏省农业科学院农业设施与装备研究所,江苏 南京 210014;2.农业农村部农产品冷链物流技术重点实验室,江苏 南京 210014;3.沈阳农业大学食品学院,辽宁 沈阳 110866;4.江苏大学食品与生物工程学院,江苏 镇江 212013;5.中华全国供销合作总社济南果品研究所,山东 济南 250220)
上海青(Brassica rapasubsp.chinensis)是一种重要的绿叶蔬菜,在中国南方广泛种植[1],原产于中国,栽培历史悠久,在西方国家和非洲也很常见[2-3]。上海青富含维生素、矿物质和硫代葡萄糖苷,而硫代葡萄糖苷及其降解产物具有抗癌作用[4]。此外,上海青含高浓度的抗氧化成分,如抗坏血酸和多酚,对人体具有抗衰老、抗心血管疾病和抗癌作用[5]。上海青含水量高、组织清脆,然而在收获后的呼吸和蒸腾作用过程中,水分迅速蒸发,使其容易受到机械损伤;且在采后贮存和运输过程中易发生枯萎和黄变,加剧采后损失[6-7]。
当前,已有学者采用不同的方法对上海青进行保鲜处理,Song Liuli等[1]研究发现,1-甲基环丙烯处理能显著抑制上海青的呼吸速率和乙烯产生,从而延缓其采后衰老。An Ronghui等[8]采用真空预冷结合富氢水的方法处理上海青,结果表明上海青抗氧化性和叶绿素含量得到显著提高,此外,该学者还发现花旗松素可以通过调节抗坏血酸-谷胱甘肽(ascorbate-glutathione,AsA-GSH)循环提高活性氧的清除率,从而降低膜脂氧化程度,最终减少上海青贮藏过程中的营养物质损失和叶绿素降解[9]。
核黄素(V B2)是对人类健康有益的1 3 种必需维生素之一[10],其推荐的每日摄入量相对较低(0.6~1.6 mg)。因为人体本身不能合成核黄素,因此需要通过饮食摄入[11]。核黄素重要的天然食物来源包括绿色蔬菜、肉类和奶制品[10]。核黄素在植物代谢中的作用已得到充分研究,黄素单核苷酸和黄素腺嘌呤二核苷酸的分子中含有核黄素。黄素单核苷酸和黄素腺嘌呤二核苷酸都是克雷布斯循环及蛋白质、脂肪和类固醇代谢的基本辅酶[12]。据报道,核黄素与植物对非生物胁迫的适应有关[13]。在水果中,核黄素在病原菌控制[14]、品质维持[15]和调控成熟[16]过程中发挥重要作用。除了这些中心代谢功能外,核黄素还在植物和微生物之间的相互作用中发挥作用[17]。在拟南芥和烟草中,Dong等[18]研究发现核黄素处理可以诱导植物对寄生霜霉病、丁香假单胞菌、烟草花叶病毒和交链格孢菌产生抗性。且核黄素是美国食药局评价为一般认为安全(generally recognized as safe,GRAS)的食品添加剂[19]。鲜有研究将核黄素作为防腐剂用于上海青保鲜,鉴于此,本实验以核黄素处理上海青,研究其对上海青贮藏过程中的品质影响,以期为上海青的贮藏保鲜技术提供一定的参考。
1 材料与方法
1.1 材料与试剂
上海青来源于中国江苏省农业科学院试验田。播种40 d后,挑选大小均匀(约100 g)且叶片无机械损伤的上海青进行采摘,对样品进行冷处理去除田间热并快速运输到实验室。
TRIzol试剂 宝日医生物技术(北京)有限公司;HiScriptTM II cDNA Synthesis Kit 南京诺维赞生物科技有限公司;三氯乙酸、硫代巴比妥酸、草酸、抗坏血酸、磷酸二氢钾 上海源叶生物科技有限公司;偏磷酸、钼酸铵、愈创木酚、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、EDTA-Na2北京索莱宝生物科技有限公司;过氧化氢、乙醇、浓硫酸 南京化学试剂股份有限公司;乙酸 西陇科学股份有限公司;没食子酸 上海瑞永生物科技有限公司。
1.2 仪器与设备
PL202-L型分析天平 梅特勒-托利多(上海)仪器有限公司;A11 Basic液氮研磨器 广州艾卡仪器设备有限公司;CR-400型色差仪 日本柯尼卡美能达公司;3K15高速冷冻离心机 美国Sigma-Aldrich公司;UV-1102型紫外-可见分光光度计 上海天美科学仪器有限公司;7500实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪 美国应用生物系统公司。
1.3 方法
1.3.1 原料处理
随机将大小均一的上海青分成5 组,每组12 棵,分别用浓度为200、400、600 μmol/L和800 μmol/L的核黄素均匀喷洒上海青,对照组喷洒蒸馏水。每组喷洒用量在20 mL左右,并在(20±1)℃条件下风干。然后将处理的上海青放在多孔的聚乙烯食品袋中,每个袋子里装4 颗上海青,每个处理3 个平行。并在温度(20±1)℃、相对湿度80%、黑暗条件下贮存4 d。从每个处理组的12 棵菜中随机选取除去主静脉的叶片,迅速放入液氮中并研磨成粉末,于-80 ℃冷冻保存,用于叶片总叶绿素含量的测定。根据上海青叶片的表型以及叶绿素总含量确定最适核黄素浓度。
从远处看,几座大型苏联式三层筒子楼矗立在街角,与周围的高层住宅楼极不协调。走近了,临街布满岁月痕迹的沾满油渍的厨房窗户半敞着,睁着黑洞洞的大眼睛,注视着街道上来往的行人。偶尔,几家厨房窗户飘出几丝袅娜的饭菜香味,这时候,人们才发觉,原来这里也有人烟。
选取大小均匀且表面无破损的上海青,随机分成两组,每组60 颗。一组用120 mL的蒸馏水均匀喷洒(对照组),另一组用120 mL的核黄素溶液(最适浓度)均匀喷洒(处理组),在(20±1)℃条件下风干。将上海青放在穿孔聚乙烯食品袋中,每袋装4 颗上海青,将其置于温度约20 ℃、相对湿度80%条件下贮存4 d,每天随机选取处理组和对照组的除主静脉的叶片,迅速于液氮中冷冻并研磨成粉末,于-80 ℃保存。
1.3.2 指标测定
1.3.2.1 色泽测定参照卢瑞雪等[20]的方法,选取上海青外叶避开主叶脉在叶片两侧进行色泽(L*、b*、h值)测定。
1.3.2.2 叶绿素含量测定
叶绿素含量测定参照纪淑娟等[21]的方法,并略有改动。称取0.2 g上海青样品,加入10 mL体积分数95%的乙醇溶液,常温避光浸提12 h,过滤后吸取滤液,以95%乙醇溶液为空白校零。测定上清液在642、665 nm波长处的吸光度,重复测定3 次。叶绿素a、叶绿素b和总叶绿素含量分别按公式(1)~(3)计算。
式中:V表示提取液总体积/mL;m表示样品质量/g。
1.3.2.3 菌落总数的测定
生理盐水(质量分数0.9%)分装于三角瓶及试管中,用报纸包裹严密,实验枪头及琼脂培养皿放入高压灭菌锅(121 ℃、20 min)灭菌后用于后续实验。称取5 g新鲜样品,捣碎后加入45 mL生理盐水,溶液倒入袋中并排尽袋中空气,无菌均质振荡5 min。吸取均质好的样液1 mL进行梯度稀释(稀释梯度为10-1~10-7),稀释后要涡旋,整个过程试管在使用前均要在酒精灯上灭菌。每个梯度吸取100 μL样液滴在琼脂平板中间,轻轻用涂布棒均匀涂布,完成后用保鲜膜包裹,于37 ℃倒置培养24 h,24 h后用肉眼观察并记录菌落数量,菌落计数以菌落形成单位表示。
1,1-二苯基-2-三硝基苯肼自由基(1,1-diphenyl-2-picrylhydrazyl,DPPH)清除率的测定参考Mohamed等[22]的方法,并略有改动。称取0.5 g样品,加入5 mL 95%的乙醇溶液匀浆,浸提5 h,4 ℃、10 000×g离心20 min,取上清液,置于冰上待测。取上清液0.5 mL加入2.5 mL 0.1 mmol/L DPPH,反应30 min,于517 nm波长处测定吸光度。按公式(4)计算DPPH自由基清除率。
式中:A0为未加样品时的DPPH溶液的吸光度;A样品为加入样品后DPPH溶液的吸光度。
1.3.2.5 丙二醛含量测定
丙二醛(malondialdehyde,MDA)含量测定参照李合生[23]的方法,并略有改动。称取0.5 g样品,加入5 mL体积分数为5%的三氯乙酸溶液,冰上浸提10 min,4 ℃、10 000×g离心20 min,取上清液,置于冰上待测。取2 mL上清液,加入2 mL、体积分数0.67%硫代巴比妥酸,混合后沸水煮20 min,冷却后4 ℃、10 000×g离心20 min,于450、532、600 nm波长处测定吸光度。按公式(5)计算MDA含量。
式中:V1为反应液总体积/mL;V2为反应液中的提取液体积/mL;V为提取液总体积/mL;m为样品质量/g。
1.3.2.6 抗氧化酶活力测定
粗酶液的制备:称取1 g样品,加入4 mL 0.1 mol/L pH 7.2磷酸缓冲液,冰上匀浆,4 ℃、10 000×g离心15 min,取上清液,置于冰上待测。
过氧化物酶(peroxidase,POD)活力测定采用愈创木酚法。将0.2 mL粗酶液中加入2 mL 0.05 mol/L愈创木酚溶液,30 ℃水浴中平衡5 min,加入1 mL、0.2% H2O2溶液,混合均匀后测定470 nm波长处的OD值,以每分钟OD470nm变化1表示1 个POD活力单位。
过氧化氢酶(catalase,CAT)活力测定采用过氧化氢法。取0.05 mL粗酶液,加入2 mL 0.05 mol/L磷酸缓冲液(pH 7.0),在25 ℃水浴下预热5 min,然后加1 mL、0.2% H2O2,于240 nm波长处测定OD值,以每分钟OD240nm变化0.01表示1 个CAT活力单位。
超氧化物歧化酶(superoxide dismutase,SOD)活力测定按照赵世杰等[24]的方法,并略有改动。取0.05 mL粗酶液,依次加入0.3 mL 130 mmol/L甲硫氨酸、750 μmol/L氮蓝四唑、20 μmol/L核黄素和100 μmol/L EDTA-Na2溶液,在4 000 lx日光灯下反应20 min后于560 nm波长处测定OD值,以0.1 mol/L pH 7.2磷酸缓冲液替换粗酶液作为对照管,以每分钟OD560nm变化1为表示1 个SOD活力单位。
1.3.2.7 抗坏血酸含量测定
称取0.5 g样品,加入4 mL草酸-EDTA溶液(含0.05 mol/L草酸、0.2 mol/L EDTA),冰上匀浆,4 ℃、10 000×g离心20 min,取1 mL上清液,依次加入4 mL草酸-EDTA溶液、0.5 mL 0.3 g/L偏磷酸-乙酸溶液、1 mL 5%硫酸、2 mL 0.5g/L钼酸铵溶液,30 ℃水浴15 min,于760 nm波长处测定OD值,采用系列质量浓度梯度0、0.01、0.02、0.03、0.04、0.05、0.06 mg/mL抗坏血酸作标准曲线,根据标准曲线方程计算抗坏血酸质量浓度,进而计算其含量。
1.3.2.8 总酚含量测定
称取0.5 g样品,加入5 mL 80%的乙醇溶液,冰上匀浆,4 ℃、10 000×g离心20 min。取0.1 mL上清液,依次加入0.9 mL蒸馏水、0.5 mL福林-酚溶液(在250 mL的圆底烧瓶内加入20 g钨酸钠、5 g钼酸钠、140 mL蒸馏水、10 mL 85%的浓磷酸及20 mL浓盐酸,充分混匀,以小火回流10 h,再加入3 g硫酸锂及15 mL双氧水,开口继续煮沸15 min),25 ℃水浴3 min,再加入1 mL饱和碳酸钠溶液,25 ℃水浴1 h,于760 nm波长处测定吸光度,以系列质量浓度梯度0、4、8、12、16、20 μg/mL没食子酸作标准曲线,根据标准曲线方程计算样品没食子酸质量浓度,总酚含量以每克样品所含没食子酸质量表示,单位为mg/g。
1.3.2.9 衰老及抗氧化相关基因表达量测定
使用TRIzol试剂从新鲜上海青组织中分离总RNA。用1%琼脂糖凝胶电泳检测R N A 样品的质量。使用HiScriptTM II cDNA Synthesis Kit,根据说明书从纯化的总RNA中反转录cDNA作为模板。根据从Brassicaceae数据库(http://brassicadb.org/brad/)获得的序列信息,使用Primer 6软件设计实时定量聚合酶链式反应(polymerase chain reaction,PCR)引物,以BrActin作为内参基因(表1)。PCR程序:95 ℃预变性30 s;95 ℃变性10 s;60 ℃退火30 s,40 个循环,终止后于4 ℃保存。使用7500实时荧光定量PCR仪进行PCR。使用2-ΔΔCT方法测定基因相对表达量。

表1 PCR的引物序列Table 1 Primer sequences used for polymerase chain reaction
1.4 数据处理与分析
实验采用完全随机设计,处理组和对照组分别3 个重复,结果以平均值±标准差,采用Origin 2020软件作图,采用SPSS 22软件进行单因素方差分析,利用邓肯检验进行显著性分析。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 不同浓度的核黄素对上海青表型的影响
20 ℃黑暗贮存4 d后,对照组叶片开始变黄,400 μmol/L和600 μmol/L处理组叶片黄化程度较低(图1A)。通过测定对照组和核黄素处理组总叶绿素含量,发现400 μmol/L核黄素处理组总叶绿素含量最高(图1B)。本研究中筛选得到的核黄素最佳使用浓度与Guhr等[25]使用的浓度相同。因此,选择400 μmol/L的核黄素对采后上海青进行处理做后续实验。

图1 不同浓度核黄素处理对采后上海青叶片表型(A)和总叶绿素含量(B)的影响Fig.1 Effects of different concentrations of riboflavin on visual appearance (A)and total chlorophyll content (B) of postharvest pak choi leaves
2.2 核黄素处理对上海青外观品质的影响
叶片变黄是衰老的标志,是影响上海青等叶类蔬菜品质的主要因素[5]。如图2所示,对照组上海青在20 ℃贮藏第3天时叶片开始变黄,第4天时黄化更为严重,已失去商品价值。而400 μmol/L核黄素处理的上海青仅在第4天时出现轻微黄化现象。结果表明外源核黄素可以延缓上海青叶片黄化。

图2 核黄素处理对上海青外观品质的影响Fig.2 Effect of riboflavin treatment on appearance quality of pak choi
2.3 核黄素处理对上海青叶片色泽及叶绿素含量的影响
上海青叶绿素含量高,其叶子的颜色可反映上海青的商品质量[1]。由于叶绿素降解引起上海青叶片快速变黄,采后上海青在室温下的保质期仅为2~3 d[26]。因此,保持叶绿素含量可以延长上海青的货架期。色泽指数L*值代表叶片亮度,b*值代表黄蓝度,h值代表颜色饱和度。在贮存期间,对照组和核黄素处理组的L*值和b*值均增加。在贮存的第3、4天,核黄素处理组的L*值分别比对照组低约8.2%和11.3%(图3A),而处理组的b*值分别比对照组低约8.3%和19.7%(图3B)。对照组和处理组贮藏期间的h值逐渐下降,核黄素处理组贮藏第3、4天的h值分别比对照组高约1.9%和3.5%(图3C)。此外,在贮存的第3、4天,核黄素处理组的叶绿素a含量分别比对照组高29.1%和65.0%(图3D),叶绿素b含量分别比对照组高31.2%和69.5%(图3E),总叶绿素含量分别比对照组高32.2%和65.6%(图3F)。由此,核黄素处理可有效保持上海青叶片的色泽和叶绿素含量。
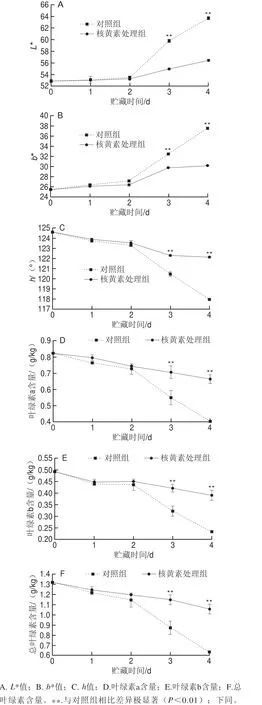
图3 核黄素处理对上海青叶片色泽和叶绿素含量的影响Fig.3 Effect of riboflavin treatment on color and chlorophyll content of pak choi leaves
2.4 核黄素处理对上海青叶绿素代谢基因表达的影响
叶绿素分解代谢基因及衰老相关基因影响叶绿素的降解途径[27-29]。SAG12是一个与植物衰老相关的标记基因,其表达量可以在很大程度上反映植物衰老的过程[30],与植物叶绿素降解途径有关的基因包括NYC1、PPH、PAO、SGR1和SGR2,它们负责编码叶绿素分解代谢途径中的各类酶或功能蛋白[27]。由图4可知,核黄素处理不同程度地下调了BrSAG12、BrNYC1、BrPPH、BrPAO、BrSGR1和BrSGR2的表达,与Song Liuli等[1]的研究结果类似,这表明核黄素可以通过抑制上海青中衰老相关基因和叶绿素降解基因(BrNYC1、BrPPH、BrPAO和BrSGR1/2)的表达来延缓上海青叶片黄化。


图4 核黄素处理对叶绿素降解基因表达的影响Fig.4 Effect of riboflavin treatment on the expression of genes related to chlorophyll degradation
2.5 核黄素处理对上海青叶表面菌落总数的影响
前人研究表明,外源施加核黄素可以诱导小麦和番茄幼苗对白粉病菌(Blumeria graminisf.sp.tritici)产生抗性[31-32],但是鲜有关于核黄素对上海青叶表面菌落数影响方面的报道。叶类蔬菜表面菌落总数对叶片衰老有着重要的影响。随着贮藏时间的延长,对照组和核黄素处理组菌落总数持续增加,而在贮藏的第1、2、4天,核黄素处理组的叶表面菌落总数显著低于对照组,分别低6.8%、2.5%和2.3%(图5)。因此,核黄素可以通过有效降低采后上海青叶表面菌落总数来维持其品质。

图5 核黄素处理对上海青叶表面菌落总数的影响Fig.5 Effect of riboflavin treatment on total bacterial count on pak choi leaves
2.6 核黄素处理对上海青DPPH自由基清除率和MDA含量的影响
DPPH自由基是一种很稳定的氮中心自由基,其清除能力是反映植物抗氧化能力的重要指标之一[33]。随着贮藏时间的延长,DPPH自由基清除率持续降低。然而,在贮藏的第3、4天,核黄素处理组的DPPH自由基清除率显著高于对照组,分别高5.4%和4.7%(图6A)。MDA含量是表征植物抗氧化能力的重要参数,能有效反映植物机体脂质过氧化速率和强度,也能间接反映植物组织过氧化损伤程度[34]。如图6B所示,对照组MDA含量随着贮藏时间的延长而不断增加,而核黄素处理组MDA含量几乎没有变化,第3、4天核黄素处理组MDA含量比对照组分别低14.7%和38.6%。

图6 核黄素处理对上海青叶片DPPH自由基清除率(A)和MDA含量(B)的影响Fig.6 Effect of riboflavin treatment on DPPH radial scavenging capacity (A) and MDA content (B) of pak choi leaves
2.7 核黄素处理对上海青抗氧化酶活性和基因表达的影响
POD、SOD和CAT是植物抗氧化的重要酶。抵御植物抗活性氧入侵的第一道防线是SOD,它将O2-·转化为H2O2[35]。此外,POD和CAT还积极参与将H2O2转化为H2O和O2的过程[36]。上海青叶片POD活力在贮藏期间呈持续上升趋势,在贮藏的第1、2天,核黄素处理组POD活力极显著高于对照组,分别高出11.2%和9.3%(图7A);上海青叶片的SOD活力在贮藏前3 d呈先上升趋势,第4天下降,在贮藏的第2、3天,核黄素处理组SOD活力极显著高于对照组,分别高4.1%和8.1%(图7B);上海青叶片的CAT活力在贮藏期间呈持续下降趋势,且在贮藏第3、4天时,核黄素处理组极显著高于对照组,分别高22.4%和21.6%(图7C)。综上,核黄素处理总体上可有效保持上海青叶片中较高的POD、SOD和CAT活力。BrPOD、BrSOD和BrCAT基因表达量与抗氧化酶活力变化趋势相似,核黄素处理可诱导提高BrPOD、BrSOD和BrCAT的表达(图7D~F)。结果表明,核黄素可以通过上调相应基因的表达水平来增强主要抗氧化酶的活力,从而有助于清除过量的ROS,保护上海青叶片在衰老过程中免受氧化损伤。

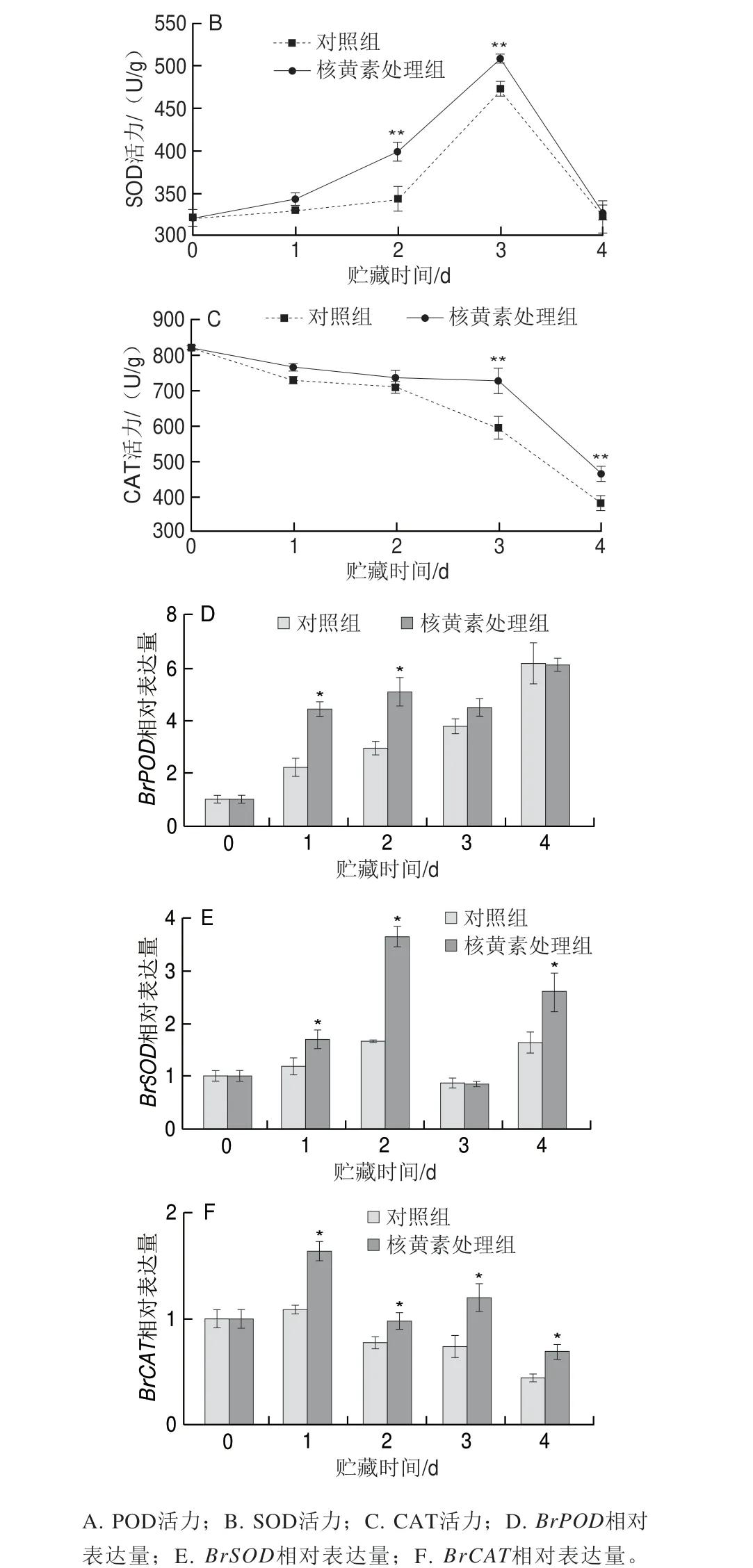
图7 核黄素处理对上海青叶片抗氧化酶活力及相关基因表达的影响Fig.7 Effect of riboflavin treatment on antioxidant enzyme activity and related gene expression in pak choi leaves
2.8 核黄素处理对上海青抗坏血酸和总酚含量的影响
上海青体内富含抗氧化物质总酚和抗坏血酸[5]。如图8A所示,在整个贮藏期间,叶片中抗坏血酸含量呈下降趋势,且在贮藏第3天,核黄素处理组抗坏血酸含量比对照组高4.3%。如图8B所示,上海青叶片总酚含量在贮藏期间呈波动变化趋势,核黄素处理组总酚含量在第3、4天显著高于对照组,分别高13.7%和13.3%(图8B)。综上,核黄素处理能够提高采后上海青叶片中抗坏血酸和总酚等抗氧化物质的含量。

图8 核黄素处理对上海青叶片抗坏血酸(A)和总酚(B)含量的影响Fig.8 Effect of riboflavin treatment on ascorbic acid (A) and total phenolic acid (B) contents in pak choi leaves
3 结 论
本研究表明,外源核黄素处理延缓了采后上海青叶片的衰老并维持了其品质。核黄素处理可有效降低上海青叶绿素分解代谢相关基因(BrNYC1、BrPPH、BrPAO和BrSGR1/2)的表达,延缓叶绿素的降解;减少上海青叶表面的菌落总数,降低病原性腐败的发生;通过上调抗氧化谢相关基因(BrPOD、BrSOD和BrCAT)的表达增强POD、SOD和CAT抗氧化酶活性,维持较高的抗氧化物质(抗坏血酸和总酚)含量,从而提高DPPH清除率并降低MDA的生成量,最终有效保持上海青采后品质。

