ceRNAs在软骨损伤中作用机制的研究进展
张高林 张成俊 夏亚一 韵向东 姜金 敏思聪
1. 甘肃省中医院,甘肃 兰州730050
2. 兰州大学第二医院,甘肃 兰州 730030
软骨是存在于肢体关节表面的一种结缔组织,其主要由软骨细胞、基质及胶原纤维和软骨膜构成,具有协助关节无摩擦运动和承受压力负荷的作用[1]。由于软骨内无直接的血液及淋巴供应,关节软骨极易发生损伤进而引起骨关节炎(osteoarthritis,OA)等关节退行性病变,其中以膝关节软骨损伤最为多见,髋关节、踝关节次之。据最新的数据报道,全球范围内超过30 %以上的人因关节软骨发生损伤导致相关病患严重影响正常生活,且发病率呈不断上升趋势[2-3]。先前的研究虽然已在分子层面上对关节软骨损伤的原因做出报道,但关于软骨损伤发生及预后的分子间调控机制了解并不充分[4]。近年来,包括长链非编码 (long noncoding RNA,lncRNA )、环状 RNA (circle RNA,circRNA )、微小 RNA (microRNA,miRNA )在内的非编码RNA(non-coding RNA,ncRNA)对关节软骨的影响引起了广大研究人员的极大兴趣,而由此3者及信使RNA(message RNA, mRNA)和假基因构成的竞争性内源RNA(ceRNAs)网络倍受关注,该机制可影响相关基因的表达,对关节软骨产生重要影响。本文就有关ceRNAs在关节软骨中的作用机制及潜在性应用展开综述,以期为关节软骨损伤的防治提供新的思路和方向。
1 ceRNAs调控网络的组成及机制
ceRNAs网络是一种全新的基因表达调控机制,由Salmena 等[5]在2011年首先提出,相比与其他调控机制,ceRNAs调控网络更为精细和复杂。该调控网络主要由miRNA、lncRNA、circRNA以及mRNA和假基因构成,其中核心分子为miRNA,lncRNA、circRNA及假基因可作为“海绵”吸附 miRNA 并在结合位点与之结合,从而对mRNA的转录和表达产生影响[6-7]。miRNA是由大约20~22个核苷酸组成,在基因的转录及表达过程中具有重要作用的非编码RNA,研究发现,机体内超过50 %的蛋白质编码基因受其调控,其通过与靶基因mRNA上的3’-非翻译区上的miRNA反应元件(miRNA response elements, MRE)互补碱基配对,进而降解靶基因或在转录后水平上对抑制靶基因的翻译,在细胞内构建了全方位多层次的基因表达调控系统,参与细胞分裂、增殖和凋亡等过程[8]。lncRNA是一类长度超过 200 个核苷酸并高度结构化的RNA分子,具有非编码蛋白质的特性,其存在于细胞核和细胞质中,主要通过直接与脱氧核糖核酸、核糖核酸和蛋白质相互作用,成为机体众多重要生理和病理过程的关键调节因子,虽然lncRNA不具备编码蛋白质的功能,但其含有与编码基因转录物一样的MREs,因此可与mRNA竞争性结合相同的miRNA产生相关调控作用[9-10]。存在于绝大数生物中的circRNA是一种特殊结构的非编码RNA,由于其不存在3′-端与 5′-端并通过外显子环化或内含子环化将3′和5′末端连接形成完整的环状结构,从而不易被核酸外切酶影响,相对于线状RNA更具稳定性,在疾病的发展过程中具有关键作用[11]。研究发现circRNA中富含miRNA结合位点,可通过与靶基因竞争性结合影响靶基因的表达[12]。假基因又称伪基因,虽然它与正常基因相似,但在结构上存在缺失或插入和外显子内含子邻接区顺序变化,以及在5′端启动区域的缺陷等致使其不能形成正常的mRNA,但其转录物可竞争性结合miRNA靶基因并对其表达进行干预[13]。
MRE是miRNA与mRNA结合位点,理论上任何含有与 miRNA靶基因3′-非翻译区上相同MRE的各种转录本均可通过竞争性结合相同的 miRNA 来调控靶 mRNA 的表达水平,从而构成庞大的ceRNAs调控网络。
2 ceRNAs在关节软骨中的作用机制
2.1 lncRNA 作为 ceRNA 与关节软骨
既往的研究已经报道lncRNA作为一种重要的生理和病理过程调节因子广泛参与多种骨与关节疾病的发病过程,但其具体的调控机制仍不完全清楚,随着分子生物学技术的发展,研究人员发现lncRNA作为一种ceRNA通过竞争性结合miRNA对关节软骨细胞增殖、凋亡以及细胞外基质降解产生影响[14-15]。
2.1.1lncRNA与软骨细胞:Wang等[16]通过构建关节软骨损伤模型研究lncRNA-HOTAIR对软骨细胞的影响及作用机制时发现,lncRNA-HOTAIR在该模型中表达上调并加剧了软骨细胞的凋亡和炎症反应,同时发现lncRNA-HOTAIR可作为miR-1277-5p的海绵对软骨细胞凋亡和炎症产生影响。Luo等[17]研究发现,lncRNA-MFI2-AS1在损伤的软骨细胞中表达增加,其可加速软骨细胞的凋亡等过程,而沉默lncRNA-MFI2-AS1可抑制软骨细胞凋亡发生,其机制可能为lncRNA-MFI2-AS1沉默后miR-130a-3p水平增加与靶基因转录因子4(TCF4)共同作用抑制软骨细胞发生损伤。Huang等[18]研究发现,lncRNA-TNFSF10的高表达可诱导软骨细胞增殖和炎症反应的发生,而此过程可部分被miR-376-3p所逆转,原因在于lncRNA-TNFSF10作为一种ceRNA与miR-376-3p存在负相关关系。Ni等[19]研究发现,lncRNA-LUADT1可与miR-34a相互作用对软骨细胞的凋亡产生影响,当miR-34a含量增多时其可与下游调节因子SIRT1结合促进软骨细胞的凋亡,而lncRNA-LUADT1与SIRT1过表达时软骨细胞凋亡率下降,表明lncRNA-LUADT1可通过miR-34a/SIRT1轴调控软骨细胞的凋亡。Jiang等[20]在研究软骨损伤中lncRNA-SNHG5的作用及机制时发现,lncRNA-SNHG在损伤的软骨细胞中低表达,同时发现miR-10a-5p表达上调,当敲除lncRNA-SNHG5时增强了软骨细胞的凋亡,通过救援实验发现lncRNA-SNHG5可通过海绵化miR-10a-5p抑制软骨细胞的凋亡,由此表明lncRNA-SNHG5可作为ceRNA对软骨细胞分化起调控作用。
2.1.2lncRNA与软骨细胞外基质:Liu等[21]在探讨lncRNA-MALAT1/miR-145在软骨损伤过程中的作用时发现,lncRNA-MALAT表达上调,miR-145下调,lncRNA-MALAT1的过度表达促进了软骨细胞外基质(extracellular matrix,ECM)ECM的降解,而当上调miR-145的表达时抵消了lncRNA-MALAT的作用,最终表明调控lncRNA-MALAT1/miR-145轴可能是防治关节软骨损伤的一种方法。Chen等[22]在研究lncRNA-MEG3对软骨细胞ECM降解中的调节功能和潜在分子机制时发现,当lncRNA-MEG3的表达不足时可加速ECM发生降解及细胞凋亡,同时发现发现lncRNA-MEG3可以作为miR-93的ceRNA激活生长因子-β(TGF-β)信号通路,进而调控软骨细胞ECM的降解等过程。Tang等[23]研究发现,LncRNA-TUG1可通过LncRNA-TUG1/miR-195/MMP-13轴调节关节细胞外基质的降解,他们发现lncRNA-TUG1在损伤软骨中的表达水平高于正常软骨,lncRNA-TUG1的过度表达降低了miR-195、胶原和聚集蛋白聚糖的表达,但增加了MMP-13的表达加速ECM降解。lncRNA-PCGEM1已被发现参与了软骨损伤的发病过程,然而其对软骨损伤的分子机制尚未完全阐明,Zeng等[24]研究发现,在损伤的软骨中lncRNA-PCGEM1存在过度表达,且促进了软骨细胞ECM的降解及软骨凋亡,进一步研究发现其机制为lncRNA-PCGEM1通过竞争抑制miR-142-5p的表达和Runt转录因子2(RUNX2)促进软骨细胞ECM的降解及软骨凋亡。Qian等[25]通过RT-qPCR技术研究评估损伤软骨组织中lncRNA-LINC00707、miR-330-5p和卵泡刺激素受体(FSHR)表达时发现,lncRNA-LINC00707和FSHR升高,而miR-330-5p降低,高表达的lncRNA-LINC00707及FSHR加速了软骨细胞凋亡及软骨细胞外基质(extracellular matrix,ECM)降解,当敲低lncRNA-LINC00707表达时可缓解软骨的损伤,并发现lncRNA-LINC00707可作为一种ceRNA通过调节miR-330-5p抑制FSHR来减轻软骨损伤。
综上,lncRNA在关节软骨中的正常表达对关节软骨的健康至关重要,当其表达异常时可通过ceRNA机制影响软骨细胞增殖、凋亡以及加速软骨细胞外基质降解及炎症反应促进软骨发生损伤,值得一提的是同一lncRNA可同时影响一种及多种病理过程加速软骨的损伤。不同lncRNA在软骨损伤中的作用及机制见表1。
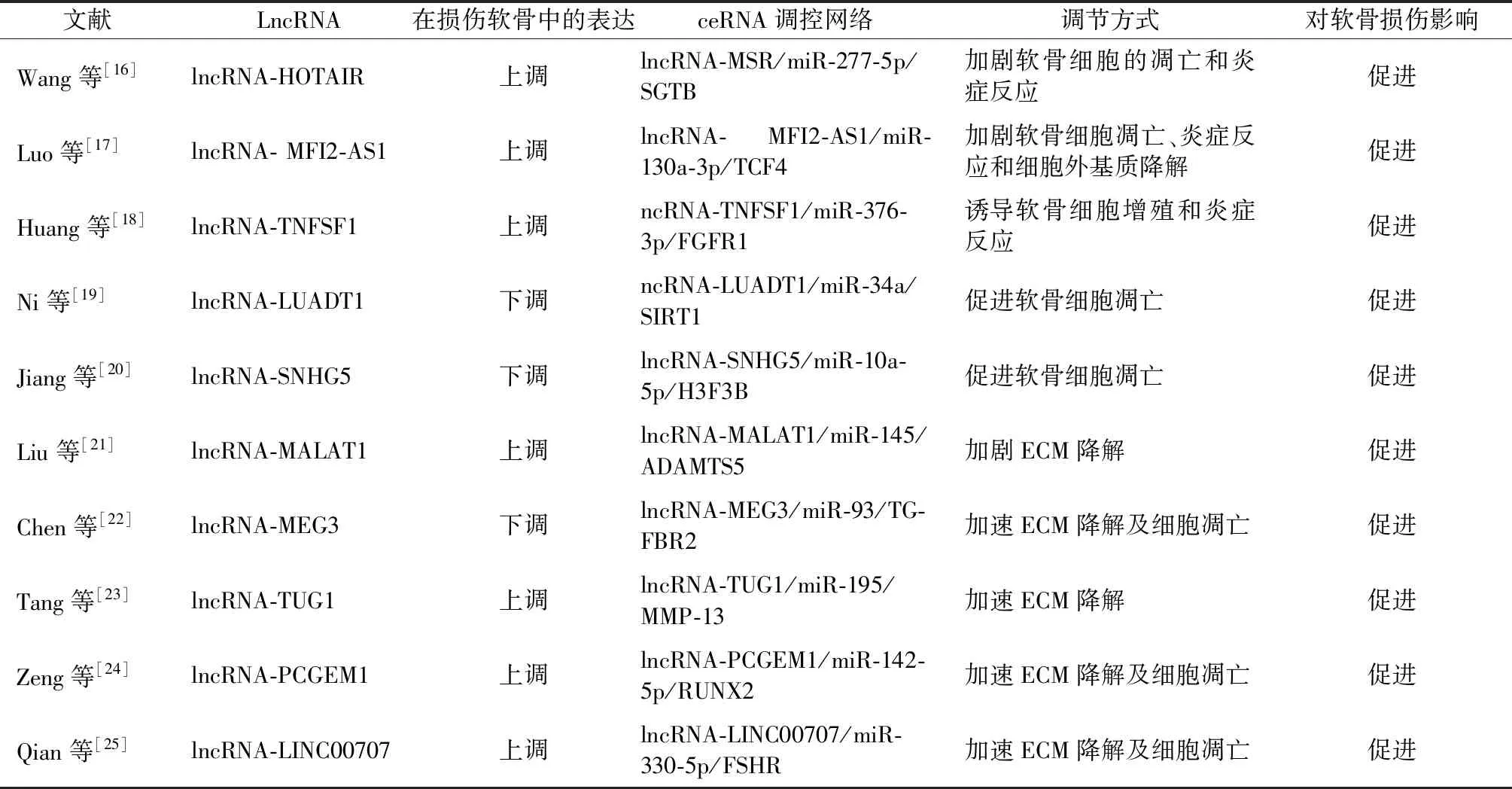
表1 lncRNA作为ceRNA在软骨损伤中的作用
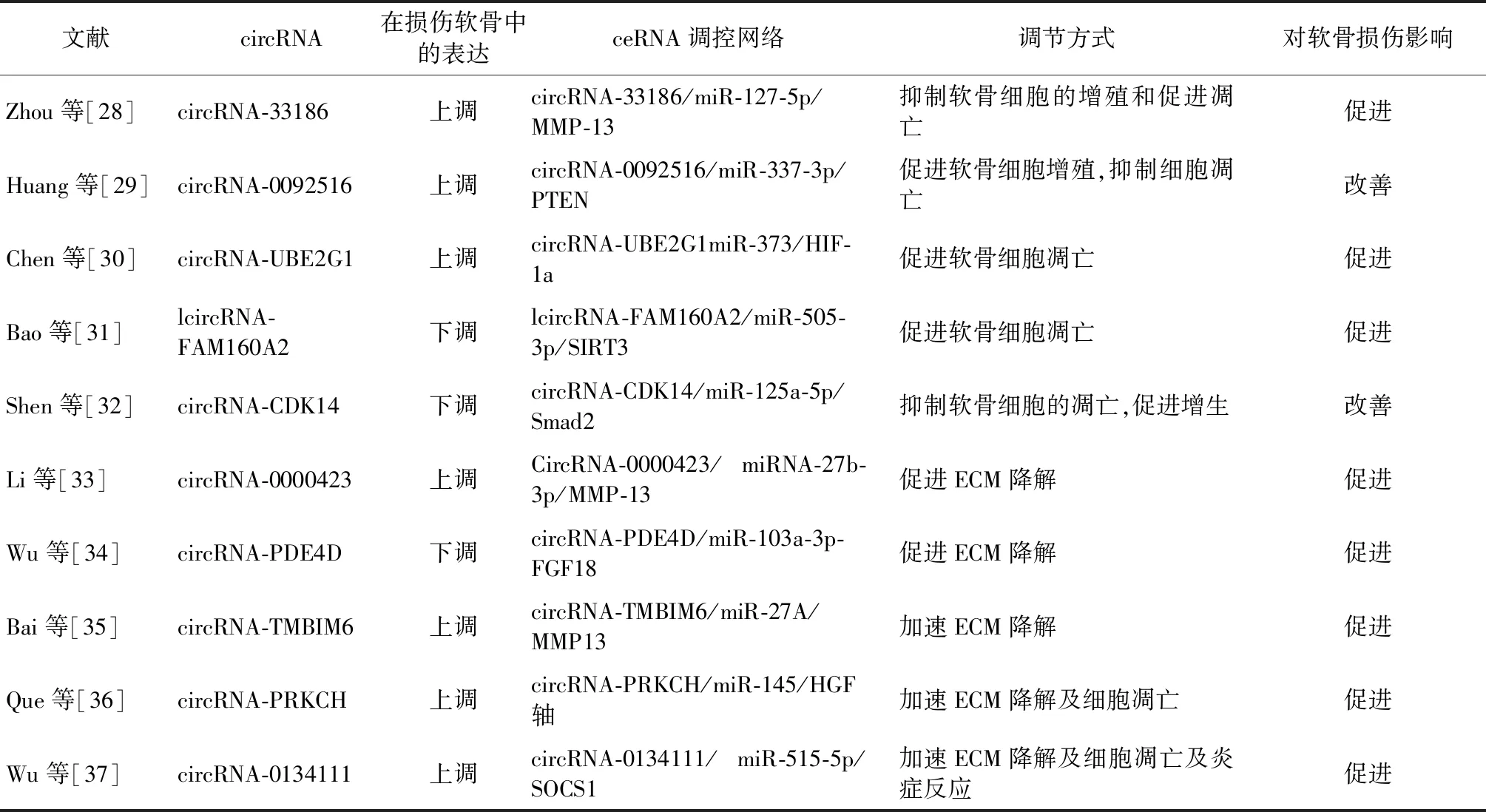
表2 circRNA作为ceRNA在软骨损伤中的作用
2.2 circRNA作为 ceRNA 与关节软骨
circRNA在1976年首次被发现,其在生物的生长发育,疾病进展及诊断标记等方面具有重要作用,2013年因被研究者证实circRNA可作为ceRNA参与基因的表达调控再次给circRNA的研究提供了新的曙光,随着研究的不断深入,发现circRNA通过竞争性结合miRNA机制对关节软骨的损伤及改善方面有调控作用[26-27]。
2.2.1circRNA与软骨细胞:Zhou等[28]研究发现,circRNA-33186在损伤的软骨组织中表达明显上调,而抑制circRNA-33186表达可促进软骨细胞的增殖和减少凋亡,机制研究表明,circRNA-33186直接结合并抑制miR-127-5p表达从而增加基质金属蛋白酶(MMP-13)的水平导致软骨损伤的发生。Huang等[29]通过定量实时PCR检测circRNA-0092516在膝关节OA患者关节组织中的表达时发现circRNA-0092516表达增加,并发现circRNA-0092516可与miR-337-3p结合,通过miR-337-3p/ PTEN基因轴调控circRNA-0092516表达进而促进软骨细胞增殖,抑制细胞凋亡改善OA软骨损伤。Chen等[30]研究发现,在损伤的关节软骨组织中circRNA-UBE2G1的表达明显增加,miR-373的表达下调,在机制方面,他们发现circRNA-UBE2G1作为ceRNA通过调节miR-373/HIF-1a轴促进了关节软骨细胞损伤的发展。Bao等[31]在研究circRNA-FAM160A2/miR-505-3p/SIRT3轴在软骨损伤中的作用及机制时发现,circRNA-FAM160A2的表达减少,miR-505-3p表达增加,而增加circFAM160A2的表达时可抑制软骨细胞的凋亡和改善线粒体功能障碍,其机制可能为circRNA-FAM160A2通过靶向miR-505-3p和SIRT3促进软骨细胞的线粒体稳定和细胞凋亡减少。此外Shen等[32]研究发现,关节软骨中低表达的circRNA-CDK14可抑制软骨的凋亡、促进软骨的增生对关节软骨具有保护作用,同时发现circRNA-CDK14的保护作用是由通过海绵化miR-125a-5p介导的,由此为软骨损伤提供了潜在的分子治疗策略。
2.2.2circRNA与软骨细胞外基质:Li等[33]研究发现,相较于正常软骨circRNA-0000423在损伤的软骨组织中表达上调,并发现其可作为ceRNA海绵化miRNA-27b-3p,通过调控MMP-13和II型胶原的表达影响关节软骨的正常功能。Wu等[34]研究发现,circRNA-PDE4D在维持关节软骨ECM起着重要作用,在损伤软骨组织中其表达明显下调,进而导致包括MMP3、MMP13、ADAMTS4和ADAMTS5等在内的促进细胞外基质降解的物质产生进一步损害正常关节软骨,进一步研究发现circRNA-PDE4D是作为miR-103a-3p的海绵通过ceRNA机制发挥其作用。Bai等[35]在研究circRNA-TMBIM6/miR-27A/MMP13轴在关节损伤中的作用及机制时发现,circRNA-TMBIM6在受损的关节中呈表达上调,circRNA-TMBIM6的过表达降低了miR-27A的表达,而增加MMP13的含量加速软骨ECM降解加重病情。circRNA-PRKCH已被证明在损伤的软骨细胞中表达上调,Que等[36]在研究circRNA-PRKCH产生损伤作用分子机制发现,软骨细胞ECM降解及凋亡与circRNA-PRKCH表达上调有关,而当抑制circRNA-PRKCH的表达时其通过调节miR-145/HGF轴来减少细胞ECM降解及凋亡。Wu等[37]构建关节软骨损伤模型研究circRNA-0134111在骨关节炎中的作用时发现,circRNA-0134111在OA软骨组织中过度表达导致软骨细胞ECM降解、细胞凋亡及加剧炎症反应,其机制为circRNA-0134111作为miR-515-5p海绵使miR-515-5p的表达下调,同时当miR-515-5p表达恢复时可抑制上述病理过程的发生。
总之,关节软骨中circRNA对关节软骨的损伤及预后具有重要影响,其含量异常时可通过竞争性结合miRNA最终促进软骨发生损伤,抑制或促进circRNA的表达使其处于平衡态可改善关节软骨损伤,因此研究探寻调控circRNA表达的物质有望成为治疗软骨损伤的潜在药物。不同circRNA在软骨损伤中的作用及机制见表1。
3 干预ceRNAs与软骨损伤的诊疗
基于ncRNA在关节软骨损伤过程中的异常表达,筛选与病情正相关的ncRNA可作为诊断和预后的生物标志物,通过干预ceRNA网络抑制对软骨损伤有促进作用的ncRNA表达或促进对软骨损伤有抑制作用的ncRNA表达是延缓软骨损伤进一步发展的潜在治疗点。Li等[38]通过基因学研究方法验证正常和损伤的软骨细胞中差异表达的miRNAs和差异表达的靶基因表达水平,共鉴定了26个差异表达的miRNAs及259个差异表达基因,最终发现其中27个miRNA-mRNA与关节损伤关系最为密切,并构建了一个有5 505个lncRNA-miRNA-mRNA相互作用的ceRNA网络,发现B细胞易位基因2(BTG2)、阿贝尔森相关基因(ABL2)和血管内皮生长因子A(VEGFA)被确定为具有良好预测性能的中心基因,同时表明阿尼霉素、毒胡萝卜素、石蒜碱及MG-132为治疗软骨损伤的潜在候选药物。Luo等[17]研究发现高表达的lncRNA-MFI2-AS1与软骨损伤有关,其可能与lncRNA-MFI2-AS1/miR-130a-3p轴的平衡失调有关,陶银伟等[39]研究发现从白桦树中提取的桦木酸(betulinic acid)可通过抑制lncRNA-MFI2-AS1的表达而促进细胞增殖及抑制炎症反应、凋亡以及软骨基质胶原的破坏,进而减轻关节软骨细胞的损伤。中药干预ceRNAs网络防治软骨损伤的研究也广泛开展,李涛[40]研究发现,中药方剂益气养血方能通过干预LncRNA-UFC1/miR-34a/MMP-13轴上调LncRNA-UFC1mRNA的表达,抑制miR-34a mRNA的表达,进而抑制MMP13的表达起保护软骨的作用。lncRNA-BLACAT1的高表达不利于关节软骨的健康,陈晨等[41-42]研究发现,从中药青风藤中提取的生物碱单体青藤碱可下调lncRNA-BLACAT1的表达,抑制LPS诱导关节软骨细胞凋亡、促进软骨细胞增殖,有缓解软骨细胞损伤的作用,其机制可能与青藤碱干预LncRNA-BLACAT/miR-142-5p轴有关。
4 总结与展望
随着人们运动意识的普遍提高,关节发生损伤性改变的患者呈明显上升趋势,这不仅严重影响患者的生活质量,而且给社会医疗资源也带来了新的压力。存在于关节表面的软骨损伤是导致此类疾患的直接原因,因此寻找有效防止软骨损伤的方法是临床及科研工作者的研究方向。受助于分子学技术的发展,研究人员陆续发现ncRNA与关节软骨的损伤密切相关,而更为复杂及精细的ceRNA 网络调控机制在关节软骨损伤及诊治过程中具有重要作用,该机制认为lncRNA、circRNA、miRNA等ceRNA分子通过MRE竞争结合相同的miRNA对关节软骨细胞的增殖、凋亡及软骨细胞外基质降解等过程影响关节软骨的健康,同时发现通过药物干预该机制可起到治疗损伤的软骨的作用。但是问题也伴随存在,如①ceRNA网络在关节软骨中的作用的研究以miRNA与lncRNA-miRNA轴偏多,circRNA-miRNA轴研究较少。②lncRNA、circRNA对软骨细胞损伤的影响是是否存在更多途径?③目前大多研究都局限于机理研究层面,药物干预及临床研究较少。因此,进一步阐明ceRNA网络在软骨损伤中的作用机制并研发药物应用于临床将是未来工作的重点。

