Vaspin对去卵巢大鼠骨质疏松的保护作用及机制研究
王宏伟 卜晓洁 战祥芹 陈福莲 王燕 杨延民*
1.山东省日照市人民医院保健/老年医学科,山东 日照 276800
2.山东省潍坊市益都中心医院,山东 潍坊 262500
3.山东第一医科大学第二附属医院内分泌科, 山东 泰安 271000
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)是由于长期雌激素缺乏导致的骨稳态失调[1]。它是绝经后妇女最常见的骨病,主要表现为骨量减少、骨微结构异常,以及骨折风险增加[2]。POMP及其相关骨折对全球绝经后妇女的健康构成重大威胁[3],导致身体残疾和生活质量下降[4]。统计数据显示,50岁以上的女性有一半容易发生骨质疏松相关骨折,髋部骨折的死亡率与乳腺癌相当,比子宫内膜癌高4倍[5]。先前的研究发现,PMOP主要是卵巢功能下降和雌激素水平下降共同导致的结果,因此雌激素补充被广泛用作传统的治疗策略。然而,最近的研究表明,激素疗法在预防骨折方面并不是很有效,而且可能会增加某些类型癌症的风险,如乳腺癌和子宫内膜癌[6]。因此,开发更有效、不良反应更小的替代治疗药物是改善PMOP的关键。
内脏脂肪组织特异性丝氨酸蛋白酶抑制剂(Vaspin)是一种新发现的脂肪细胞因子,与骨代谢密切相关。高飞等[7]发现Vaspin可能通过激活Wnt/β-catenin信号通路促进大鼠骨髓间充质干细胞成骨分化。Bao等[8]发现骨关节炎(osteoarthritis, OA)患者血清Vaspin水平明显低于正常人群,体外实验证实Vaspin可降低软骨细胞的炎症反应。动物实验证实,关节内注射Vaspin对关节软骨也有抗炎、抗降解作用[8]。本课题组前期研究发现,腹腔注射重组Vaspin蛋白可改善雄性SD大鼠高脂饮食引起的骨损伤,并在体外促进原成骨细胞向成骨细胞分化[9]。此外,我们之前的临床研究也发现老年男性骨质疏松症患者血清Vaspin水平降低,高血清Vaspin水平可能是老年男性骨质疏松症的保护因素。Tanna等[10]发现绝经后妇女的血清Vaspin水平与股骨颈和髋关节骨密度(BMD)显著正相关。这些研究表明Vaspin可能代偿性增加从而对骨代谢发挥积极的调节作用。然而,目前尚无研究报道Vaspin干预治疗对雌激素缺乏引起的PMOP的作用及机制。腹腔注射外源性Vaspin是否对OVX大鼠骨代谢也有保护作用尚不清楚。本研究旨在观察Vaspin对去卵巢大鼠骨代谢的影响,并探讨其可能的机制。
1 材料和方法
1.1 实验动物、试剂与材料
实验动物:16周龄的雌性Sprague-Dawley (SD)大鼠,购自北京维通利华实验动物技术有限公司[许可证号:SCXK(京) 2019-0006],在封闭的SPF级动物房中饲养,饲养条件是12 h的明暗周期,湿度50 %~60 %,温度23 ℃左右。大鼠可以自由地获得食物和水。
试剂与材料:重组人Vaspin 蛋白溶液(C192)购自上海近岸蛋白科技有限公司;P1NP 测定试剂盒(货号CSB-E12774r),OCN测定试剂盒(货号CSB-E05128r),TRAP测定试剂盒(货号CSB-E08492 m),CTX-1测定试剂盒(货号CSB-E12776r),IL-1β ELISA试剂盒(货号CSB-E08055r),TNF-α测定试剂盒(货号CSB-E11987r)均购自武汉华美生物技术有限公司;4 %多聚甲醛购自武汉塞维尔生物科技有限公司;反转录试剂盒、Trizol 试剂、引物合成、SYBR Premix EX TAQ II试剂盒试剂盒均购自大连宝生物工程公司;RIPA缓冲液购自上海博彩生物科技有限公司;BCA蛋白分析试剂盒购自上海碧云天生物有限公司;PVDF膜购自美国Millipore公司;强化学发光试剂盒购自美国Santa公司;SkyScan-1176 μCT(比利时布鲁克公司);动态疲劳实验机BoseElectroForce®3230(美国博士公司);10×光学显微镜(德国 Zeiss公司);实时荧光定量 PCR 仪(LightCycler480,瑞士罗氏公司);实验用抗体:GAPDH(稀释比例1∶1 000,51332)、OPG(稀释比例1∶1 000,#8486 s)及RANKL(稀释比例1∶1 000,#3959)均购自Cell Signaling (CST)公司;二抗购自Abcam公司;Flurochem Q化学发光成像系统(美国Alpha Innotech公司)。
1.2 方法
1.2.1去卵巢手术构建绝经后骨质疏松模型:适应性喂养2周后,随机分为模型组和实验组:模型组分为去卵巢组(OVX)组和假手术组(Sham)组,每组6只,用于验证OVX 术后 OP 模型构建的成功;实验组分为Sham 组、OVX组和 OVX+Vaspin组3组,每组10只。术前采用戊巴比妥钠进行麻醉处理,剂量为50 mg/kg,OVX组采用双侧卵巢切除术建立绝经后骨质疏松模型,Sham组在卵巢周围切除少量脂肪,术后所有大鼠均在同等条件下单笼饲养,自由饮水、活动,标准大鼠饲料喂养。
1.2.2动物分组及干预治疗:术后6周处死模型组大鼠,取一侧股骨行microCT检测,对OVX大鼠OP模型进行验证,造模成功评价标准:OVX组大鼠BMD峰值较Sham组降低≥2.5 SD(标准差)。造模成功后,OVX+Vaspin组大鼠均每天给予重组人Vaspin蛋白溶液1 μg/kg腹腔注射,Sham组及OVX组给予等量生理盐水腹腔注射,干预12周后,用戊巴比妥钠麻醉处死大鼠,收集血清和骨骼样本进行分析。
1.2.3骨代谢指标及炎症因子检测:采用ELISA试剂盒检测各实验组大鼠血清标本中P1NP、OCN、TRAP、CTX、IL-1β和TNF-α的水平。所有操作均严格按照各试剂盒说明书进行操作,操作前将所需要的血清样品、试剂盒及酶标板孔在室温下平衡1 h,并按照试剂盒说明书配制实验所需试剂。最后,根据标准品的浓度和OD值,应用Curve Expert软件绘制标准曲线,然后根据公式分别计算出样本P1NP、OCN、TRAP、CTX、IL-1β及TNF-α的浓度水平。
1.2.4骨组织学分析:解剖大鼠左侧胫骨,用4 %多聚甲醛固定48 h。用10 %的乙二胺四乙酸(EDTA)脱钙4周。随后,将骨标本置于乙醇中逐渐脱水,石蜡包埋,二甲苯脱蜡,再用不同浓度乙醇脱水,滴加苏木精染色3 min,自来水冲洗1 min,1 %盐酸乙醇分化2 s,自来水冲洗返蓝3 min,梯度酒精切片脱水,用伊红染色液染色1.5 min,骨切片脱水、透明、封片,最后在10×光学显微镜下观察骨切片的视野图像。
1.2.5骨生物力学分析:取大鼠右侧股骨,用盐水浸泡纱布保持湿润,-20 ℃保存。采用动态疲劳实验机进行三点弯曲试验,以评估骨强度。测量前将骨置于仪器中,置于两个轴承的中心位置,以确保弯曲轴与加载长轴对准。在2 mm/min的恒定变形速率下,加载5~6 N直至发生断裂,确定载荷和断裂参数。记录数据后,生成载荷-变形曲线,计算最大载荷、最大断裂负荷、韧性、能量吸收、弹性模量、极限拉伸强度等骨生物力学参数。
1.2.6MicroCT分析:左股骨分离,4 %多聚甲醛固定,75 %乙醇保存。使用Skyscan 1176 μCT扫描仪分析骨质量和骨小梁微结构,扫描精度17.93 μm,扫描旋转角度180 °,1 mm A1滤波器,扫描电压70 kV,电流278 μA,曝光时间450 ms;然后将扫描图像处理成2D和3D图像。所有3D图像处理和分析均使用MicroView,v.2.1软件进行。计算分析骨小梁体积骨密度(Tb.vBMD)、骨小梁体积/总体积(Tb.BV/TV)、骨小梁数(Tb.N)、骨小梁厚度(Tb.Th)、骨小梁分离度(Tb.Sp)和结构模型指数(SMI)。
1.2.7RNA提取和实时定量PCR(qRT-PCR):使用TRIzol试剂从右胫骨标本中提取总RNA,将总RNA溶解在DEPC水中,测定其浓度。取5 μg总RNA,使用Prime Script®RT试剂盒反转录为cDNA。采用10 μL反转录反应制备总RNA,37 ℃孵育30 min,85 ℃孵育5 min。使用SYBR Premix EX TAQ II试剂盒,在LightCycler480上进行实时PCR。按照说明书进行PCR反应,引物列于表1。PCR条件为93 ℃ 1次循环2 min(初始变性),然后93 ℃ 1 min、55 ℃ 1 min、72 ℃ 1 min 40次循环,最后72 ℃延伸5 min。数据分析采用2-△△CT法,以β-actin为内参进行标准化。

表1 qRT-PCR引物序列
1.2.8免疫印迹分析:将大鼠腰椎骨从液氮中取出,用锤子迅速敲碎,放入液氮臼中研磨。使用RIPA缓冲液按说明书提取腰椎骨总蛋白。细胞悬浮在冰冷的RIPA缓冲液中,在冰上裂解10 min,然后以14 000 r/min 离心10 min。含总蛋白裂解液的上清液用BCA蛋白分析试剂盒定量。通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)将蛋白质分离到10 %聚丙烯酰胺凝胶中,并转移到聚偏氟乙烯(PVDF)膜上。用5 %脱脂牛奶封闭1 h后,在4 ℃下用一抗孵育过夜。用TBST缓冲液清洗3次,室温下二抗孵育1 h。蛋白条带使用增强化学发光试剂盒进行可视化,并使用Flurochem Q化学发光成像系统进行检测。以GAPDH作为对照。
1.3 统计学处理
2 结果
2.1 大鼠骨代谢指标和炎性因子比较
与Sham组相比,OVX组血清P1NP和OCN水平显著降低,TRAP、CTX、IL-1β、TNF-α水平明显升高(P<0.05)。而与OVX组相比,OVX+Vaspin组血清P1NP和OCN水平显著升高,TRAP、CTX、IL-1β、TNF-α水平明显降低(P<0.05),见表1。
2.2 大鼠骨组织形态变化
与Sham组相比,OVX组骨微结构受损,骨小梁数量明显减少,OVX+Vaspin组与OVX组相比,骨显微结构明显改善,骨小梁数量明显增加,见图1。
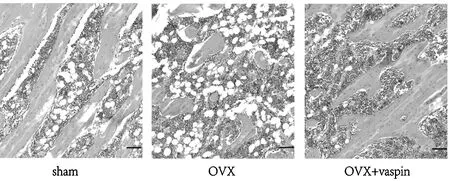
图1 各组大鼠的骨组织病理学(HE染色10×,标尺:50 μm)
2.3 大鼠骨生物力学变化
与Sham组相比较,OVX组最大负荷、最大断裂负荷、韧性、能量吸收、弹性模量、最大强度等生物力学参数均明显受损(P<0.05)。与骨组织学分析一致,OVX+Vaspin组大鼠OVX诱导的骨生物力学损害明显改善,见表2。
表2 各组大鼠骨代谢指标和炎性因子比较
表3 各组大鼠骨生物力学参数比较
2.4 大鼠Micro CT分析
Micro CT分析显示,Vaspin干预治疗可以保护大鼠免受OVX诱导的骨小梁和皮质骨骨量丢失,股骨干骺端骨小梁三维重建图像如图2A所示。骨小梁的定量分析方面,与Sham组相比,OVX组Tb.vBMD、Tb.BV/TV、Tb.N和Tb.Th水平均显著下降(P<0.05),Tb.Sp和SMI水平显著升高(P<0.05),而OVX+Vaspin组这些指标在很大程度上得到了改善(P<0.05),见图2B~2G。
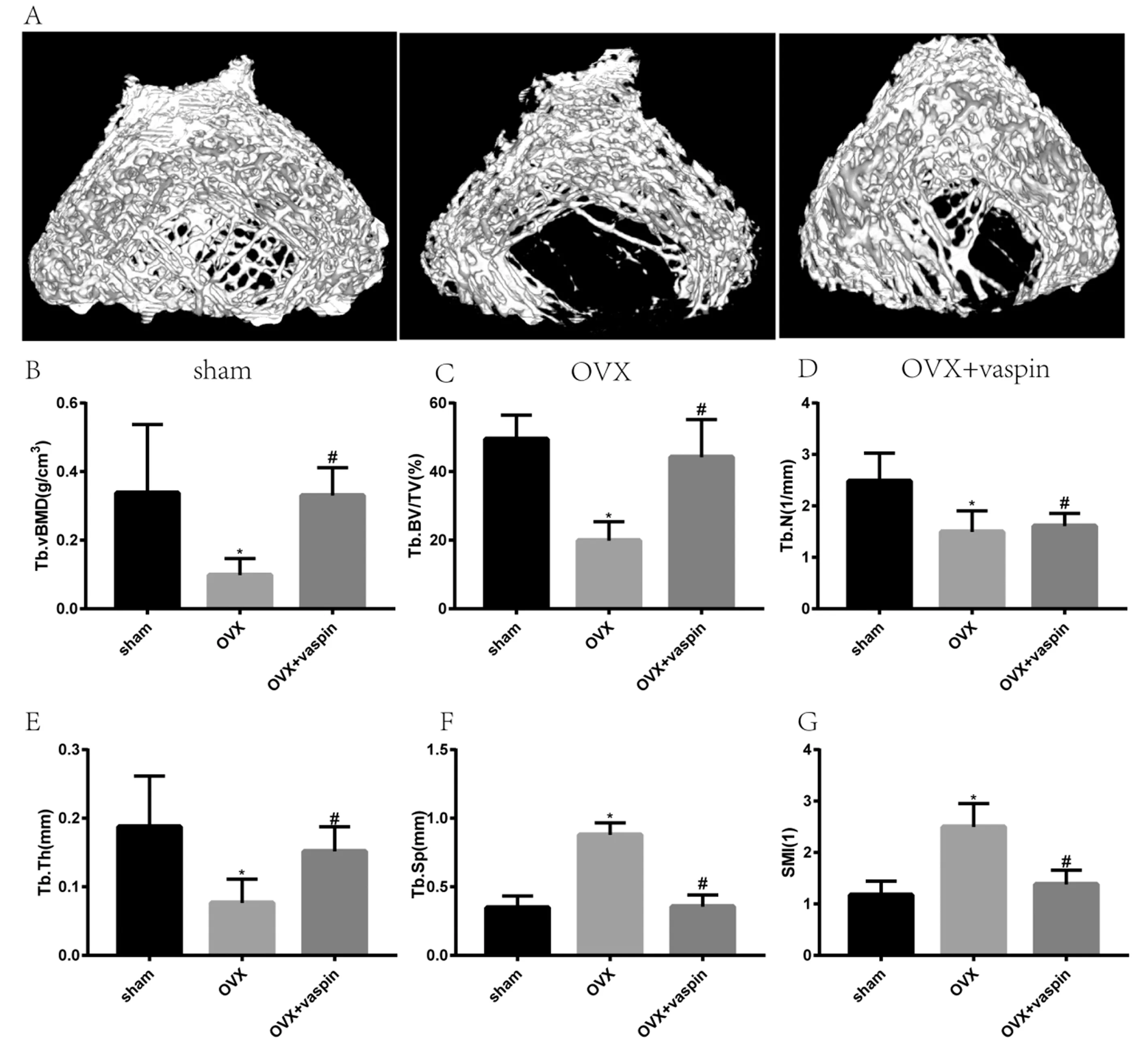
注:与Sham相比,* P<0. 05;与OVX相比,#P<0. 05。
2.5 大鼠骨组织骨代谢相关基因表达水平的变化
与Sham组相比,OVX组骨组织中OPG的mRNA水平显著降低(P<0.05),而RANKL的mRNA水平显著升高(P<0.05)。而与OVX组相比,OVX+Vaspin组骨组织中OPG的mRNA水平显著升高(P<0.05),而RANKL的mRNA水平显著降低(P<0.05),见图3A、3B。
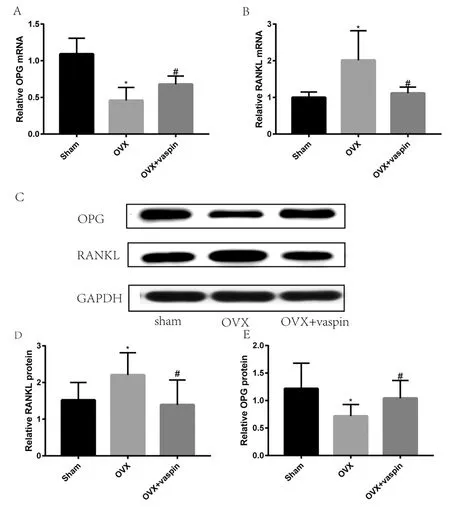
图3 大鼠骨组织骨代谢相关基因及蛋白表达水平的变化
2.6 大鼠骨组织骨代谢相关蛋白表达水平的变化
我们进一步检测了右胫骨标本中OPG及RANKL的蛋白表达水平,结果与mRNA定量观察结果一致,见图3C~3E。
3 讨论
去卵巢大鼠模型是目前世界卫生组织(WHO)推荐的POMP最常用的动物模型,该模型能较好地模拟绝经后妇女雌激素缺乏的临床特征及其对药物替代治疗的反应,对研究大鼠骨质疏松症的发生过程和病理生理机制非常有利[11]。我们的研究发现,与Sham组相比,OVX组术后12周骨微结构明显受损,骨小梁数量明显减少,骨强度明显下降,说明卵巢摘除后POMP建模成功。Vaspin干预可以通过提高OVX大鼠的骨量和骨密度,改善骨骼微观结构和生物学特性,从而对OVX诱导的骨质疏松症具有改善作用。
骨代谢指标是骨形成或骨吸收过程中血液中释放的生化指标,能准确反映早期全身骨代谢情况,临床上常用于评价骨质疏松症的治疗效果。P1NP是成骨细胞在骨形成过程中产生的,可以反映胶骨的形成速度。CTX是破骨细胞在骨基质降解过程中产生的碎片和分泌产物,可以反映骨吸收的状态。血清P1NP和CTX检测是国际骨质疏松基金会提出的反映骨形成和骨吸收的敏感指标[12]。OCN是一种广泛应用的骨形成指标。Vaspin的干预可提高OVX大鼠血清P1NP和OCN水平,降低CTX水平,说明Vaspin可在一定程度上促进OVX大鼠骨形成,降低OVX大鼠骨转化率。
正常骨量的维持依赖于成骨细胞相关骨形成和破骨细胞相关骨吸收之间的动态平衡,当这种稳态因任何原因被破坏时,破骨细胞的骨吸收比成骨细胞更强,导致骨质流失,这也是OP的主要发病机制。既往研究发现雌激素缺乏可导致绝经后妇女破骨细胞分化增加,骨吸收能力增强,近期研究发现炎性细胞因子也参与了PMOP的病理生理机制[13]。研究证实IL-1β和TNF-α可通过激活炎症信号通路促进骨吸收,抑制骨形成[14]。我们的实验也证实了OVX组血清中IL-1β和TNF-α水平明显高于Sham组,说明OVX组大鼠炎症因子被激活,而Vaspin可以抑制炎症反应和骨吸收,降低骨代谢的高转换水平,从而在一定程度上起到抗骨质疏松的作用。
骨的生物力学分析是评价骨强度和抗骨质疏松药物疗效的黄金指标[15],而骨小梁的微观结构通常被认为是预测骨量丢失和结构破坏最理想的指标[16]。Micro CT可为股骨干干骺端骨小梁的显微结构提供直观、定量的数据。通过三维重建和三维图像,不仅可以更直观地观察骨小梁的结构,还可以通过Tb.vBMD、Tb.BV/TV、Tb.N和Tb.Th等定量数据更准确地检测骨小梁参数的细微变化。因此Micro CT获得的数据对于骨质疏松症的诊断和治疗更加具体和全面[17]。我们的研究也证实了OVX大鼠骨生物力学性能下降,骨微观结构受损,而Vaspin干预可以改善骨生物力学性能,改善骨微观结构,并在骨组织中产生新的骨小梁。
在骨组织中,骨保护素(osteoprotectin, OPG)主要由成骨细胞产生,进一步促进成骨细胞的分化和成熟。目前研究发现OPG对破骨细胞有直接的负向调节作用[18]。OPG/RANKL/RANK信号通路是参与骨代谢和骨质疏松的主要信号通路,也是目前研究的热点。有研究发现OPG/RANKL/RANK信号通路部分分子通路的改变直接参与了POMP的病理生理过程[19-21]。我们的研究发现,Vaspin干预OVX大鼠12周后,骨组织中OPG mRNA水平和蛋白水平均升高,而RANKL表达的mRNA和蛋白水平均下降。提示Vaspin对OVX组大鼠骨质疏松的保护作用可能是通过激活OPG/RANKL信号通路介导的,为我们今后进一步的细胞实验提供了方向。
由于实验条件限制,本研究未在体外进一步证实Vaspin对OPG/RANKL信号通路表达及相关下游因子的影响。在接下来的研究中,我们将在细胞实验中加入OPG/RANKL信号通路抑制剂,观察Vaspin对其下游相关基因蛋白表达的影响,并进一步研究其相关分子机制。
综上所述,我们的研究证实Vaspin可以促进OVX大鼠骨形成,抑制炎症反应,抑制破骨细胞分化,优化骨形成和骨吸收的动态平衡,改善骨微观结构和骨强度,从而在体内发挥抗骨质疏松的作用,而这种作用可能是通过上调OPG表达和下调RANKL表达介导的。因此,在未来的研究中,我们将通过体外细胞实验进一步验证Vaspin对OPG/RANKL通路的调控作用。

