MLO-Y4来源外泌体对破骨细胞调控机制的研究
赵丽洲 勾蓉 王晨 涂小林*
1. 重庆医科大学生命科学研究院骨发育与再生实验室,重庆 400016
2. 重庆大学附属肿瘤医院体检中心,重庆 400030
3. 陆军军医大学西南医院,重庆 400038
破骨细胞来源于骨髓中的造血干细胞,是由单核细胞/巨噬细胞通过融合形成具有骨吸收功能的多核巨细胞[1],其生理分化需要TNF超家族成员NF-κB配体受体激活剂(receptor activator of nucler factor-κB ligand,RANKL)的介导[2], RANKL与破骨前体细胞膜上的κB受体活化因子(receptor activator of nucler factor-κB,RANK)结合,通过衔接NF-κB通路导致破骨细胞生成关键转录因子NFATc1的诱导和激活[3-5],调控破骨细胞生成和分化。RANKL主要由骨细胞和成骨细胞分泌[6-7],与促进破骨前体细胞增殖的巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)联合使用可以在体外诱导具有骨吸收能力的破骨细胞的形成。
骨细胞是破骨分化必需因子RANKL的主要来源细胞。研究表明,骨细胞中RANKL基因敲除导致小鼠松质骨量大增,且同时能增加成骨功能不全小鼠的松质骨[8]。体外实验也验证,在三维羟基磷灰石/磷酸三钙支架中,增加静水压导致骨细胞样细胞系MLO-Y4中RANKL高表达,并促进破骨前体细胞系RAW264.7成破骨细胞[9]。前期实验发现骨细胞Wnt信号激活小鼠破骨细胞增加,骨吸收能力增强[10],骨细胞的脱细胞基质修饰3D打印PCL支架,促进成骨分化、矿化与破骨细胞生成[11]。由此可见,在生理状态下,骨细胞具有重要的破骨细胞调控功能。
骨细胞被包埋在坚硬的矿化骨基质中,较难与其他细胞通过直接接触传递信号,所以骨细胞衍生因子的产生与传递方式是其调控破骨细胞的关键。外泌体是一种圆形膜结合的囊泡,由细胞分泌到细胞外基质中,具有与衍生细胞相同的膜成分和一些细胞质内容物如脂类、蛋白质、核酸组成的DNA和RNA等,通过囊泡膜和细胞膜的融合将分泌因子从相关细胞转移到循环途径中的其他细胞[12-15]。
研究显示,骨细胞外泌体通过miR-181b-5P激活蛋白激酶B(Akt)促进人牙周膜干细胞的成骨分化[16]。肌肉生长抑制素处理的骨细胞其外泌体通过miR-218阻断Runx2和Wnt途径以抑制成骨分化[17]。成骨细胞外泌体通过RANKL-RANK信号激活Nfatc1核位移促进破骨细胞分化[18]。但骨细胞来源的外泌体对破骨细胞的作用研究甚少。本研究拟通过提取骨细胞样细胞MLO-Y4来源外泌体,探讨其对破骨细胞分化的影响及分子机制。
1 材料和方法
1.1 动物实验
4至6周龄C57BL/6J野生型小鼠(WT)获自重庆医科大学动物设施(中国)。所有动物实验均经重庆医科大学动物护理与使用委员会批准。
1.2 试剂
胎牛血清(FBS)购自加拿大Wisent公司。小鼠RANKL和M-CSF重组蛋白购自美国PeproTech公司。CD63和Alix抗体购自中国万类生物科技有限公司。α-MEM培养基、胎牛血清购自美国Gibco公司;青、链霉素及胰酶购自中国碧云天公司;TRIzol、反转录和实时荧光定量PCR试剂盒购自中国艾科瑞公司;PCR引物来自生上海工生物工程股份有限公司。
1.3 细胞培养
1.3.1骨细胞系MLO-Y4:骨细胞系MLO-Y4细胞由美国 Lynda Bonewald 教授赠予,在含有10 %FBS和1 %青霉素/链霉素的α-MEM培养基中培养,0.25 %的胰酶消化传代。
1.3.2骨髓单核巨噬细胞:从C57BL/6J野生小鼠股骨和胫骨提取原代骨髓细胞,在含有10 %FBS和1 %青霉素/链霉素的α-MEM培养基中培养3 d,将非粘附细胞转移到新的培养皿中,加入30 ng/mL M-CSF重组蛋白继续培养3 d,通过胰蛋白酶消化收集粘附细胞即骨髓巨噬细胞(bone marrow macrophages,BMM),作为破骨前体细胞使用[19]。
1.4 外泌体的分离和鉴定
通过文献报道的方法提取细胞外泌体[20-21]。使用前将FBS 100 000 g超速离心18 h以去除牛外泌体[22]。收集MLO-Y4的48 h条件培养在4 ℃下依次300 g离心10 min, 2 000 g离心10 min,10 000 g离心30 min去除细胞和细胞碎片,然后通过低温超速离心机(Beckman Coulter,美国)100 000 g离心70 min以收集外泌体。无菌PBS重悬外泌体沉淀,用于细胞培养和动物实验。外泌体的蛋白含量通过BCA蛋白检测试剂盒(Beyotime,中国上海)检测。透射电子显微镜鉴定纯化的外泌体大小及形态,Western blot鉴定外泌体标志蛋白表达。
1.5 细胞共培养和TRAP染色
BMM以4×104个/孔的密度混匀接种于48孔板,加入M-CSF(30 ng/mL)+RANKL(30 ng/mL)或M-CSF(30 ng/mL)+RANKL(30 ng/mL)+MLO-Y4-Exo(15 μg/mL)于共培养体系中。培养液每3 d更换1次。5~9 d后,显微镜普通光源镜检可见大的多核破骨细胞在孔板中形成,即可收获细胞。细胞用4 %甲醛溶液固定10 min,然后蒸馏水洗2次并晾干,根据TRAP染色试剂盒说明书(Sigma-Aldrich,美国)对细胞进行染色,显微镜镜检并计数每孔TRAP阳性(红色)细胞数量。
1.6 RNA 提取及qPCR实验
使用TRIzol试剂提取细胞RNA,测定浓度后按照反转录试剂盒(艾科瑞,中国)说明书进行反转录,获得的 cDNA作为 qRT-PCR 反应的模板[23]。相对表达量采用2-ΔCt分析, 以CHoB的表达水平作为标准。所用引物序列如表1所示。

表1 引物序列
1.7 细胞免疫荧光(IF)检测
单核巨噬细胞细胞用4 %多聚甲醛固定10 min, 然后用0.25 %Triton X-100透化30 min,5 %牛血清白蛋白封闭30 min后与RANKL一抗孵育过夜,然后用Cy3标记的羊抗兔IgG抗体(cell signaling technology,美国)室温孵育1 h。随后,用DAPI(碧云天,中国)标记细胞核,荧光显微镜观察RANKL表达量。
1.8 小干扰RNA(siRNA)转染实验
RANKL小干扰RNA质粒(序列:GGATGAAACAAGCCTTTCA)构建于RIBOBIO公司,溶解于无菌ddH2O至终浓度20 μmol/L,与Zeta Life转染试剂以体积1∶1比例混匀静止10~15 min后加入MLO-Y4细胞培养皿,转染24 h 后对细胞正常换液,48 h后Cy3-siRNA转染细胞通过荧光显微镜检测转染效率,RANKL-siRNA转染细胞进行RNA检测或收集外泌体。
1.9 免疫组织化学检测(IHC)
4~6周龄C57BL/6J野生型小鼠颅骨皮下注射PBS和MLO-Y4-Exo连续5 d,在第6 天收获小鼠颅骨甲醇固定后脱钙[24-25]。脱水后将颅骨垂直于矢状缝包埋在石蜡中,并切成5 μm厚的切片。切片脱蜡后分别用于免疫组织化学和TRAP染色,染色方法如报道所述[11]。切片通过OsteoMeasure TM软件对TRAP阳性细胞进行分析计数。
1.10 Western blot
根据上述方法提取MLO-Y4外泌体,加入适量的 RIPA 裂解液,然后在冰上进行超声破碎。按照BCA试剂盒说明书测量蛋白浓度,加入上样缓冲液,金属浴100 ℃,8 min。使用试剂盒配胶,每孔上样 30 μg。上层胶采用 70 V 恒压,样品进入下层胶后采用 120 V恒压电泳,210 mA恒流转膜1 h 后,使用5 %脱脂奶粉于室温摇床封闭 2 h。然后在4 ℃孵育一抗过夜,第 2 天使用 TBST洗膜,室温下孵育二抗2 h,TBST 洗膜后显影。
1.11 ELISA实验
将上述方法获得的MLO-Y4外泌体,使用RIPA裂解液重悬后利用BCA蛋白浓度检测试剂盒检测浓度。提前将ELISA试剂盒在室温平衡30 min,根据蛋白浓度,每孔加相同蛋白量,然后用缓冲液补充至相同体积,封板膜盖住反应板,37 ℃水浴锅温育60 min,然后用洗涤液洗涤5次,然后将底物A和B以1∶1混合后加入反应孔中,37 ℃水浴锅温育15 min,加入终止液,在酶标仪450 nm波长上测量吸光度,采用四参数Logistic曲线拟合,创建标准曲线方程。
1.12 统计学处理

2 结果
2.1 MLO-Y4来源的外泌体的分离和鉴定
外泌体的鉴定依赖于报道的标准[26],外泌物的大小范围为30至200 nm,在透射电子显微镜下呈杯状形态,具有特定的标记蛋白如CD63和Alix[27-29]。在我们的研究中,从MLO-Y4细胞培养液中分离的外泌体在离心管中呈白色沉积物(图1A)。在透射电子显微镜观察下呈圆形,直径约100~150 nm,具有完整的膜脂双层,并显示杯状形态(图1B)。Western blot实验显示MLO-Y4-Exo表达CD63和Alix蛋白(图1C)。
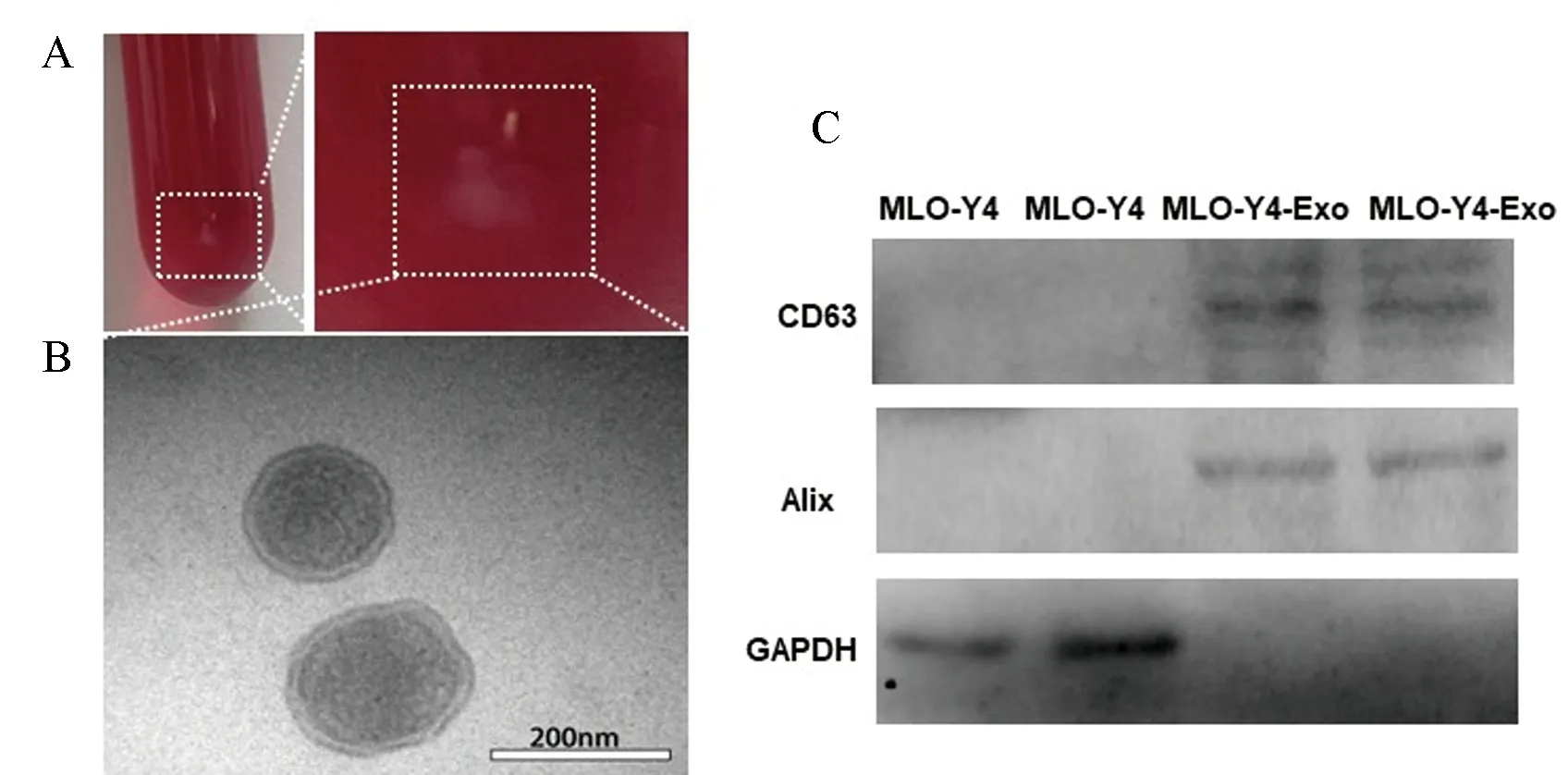
注:A:外泌体离心沉淀图,B:透射电子显微镜观察外泌体;C:Western blot检测外泌体标志蛋白表达。
2.2 MLO-Y4来源的外泌体促进破骨细胞分化
MLO-Y4-Exo与BMM共培养5~9 d后进行TRAP染色(图2A),MLO-Y4-Exo组TRAP阳性的单核细胞和大于三个核的破骨细胞均增多(图2B),qPCR显示MLO-Y4-Exo组细胞的破骨细胞标志基因表达增加(图2C),说明MLO-Y4-Exo促进BMM成破骨细胞分化。
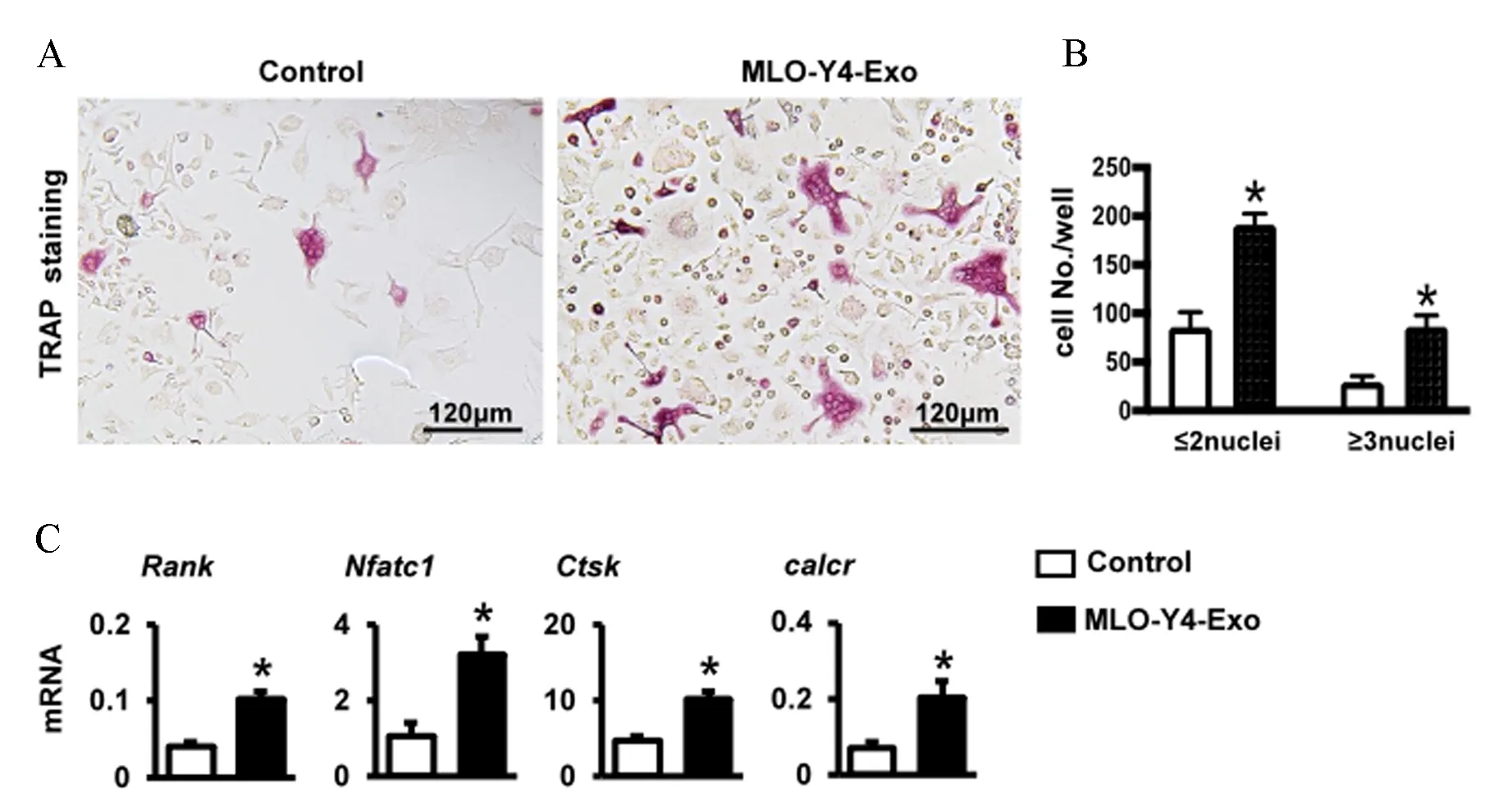
注:A:细胞TRAP染色;B:TRAP阳性细胞(红色)计数;C:qPCR检测破骨细胞标志基因mRNA表达量。n=3, 与 Control比较,*P<0.05。
2.3 MLO-Y4来源的外泌体在体内促进破骨细胞的形成
在小鼠顶骨皮下连续注射5 d外泌体后,收获小鼠颅骨用于TRAP染色(图3A),并通过OsteoMetrics对破骨细胞进行骨组织形态学定量分析。在注射MLO-Y4-Exo的小鼠的颅骨中发现了丰富的破骨细胞,单位组织面积破骨细胞数量(N.Oc/T.Ar)、单位骨周长破骨细胞数量(N.Oc/B.Pm)和单位骨表面的破骨细胞表面(Oc.S/BS)均增加(图3B)。
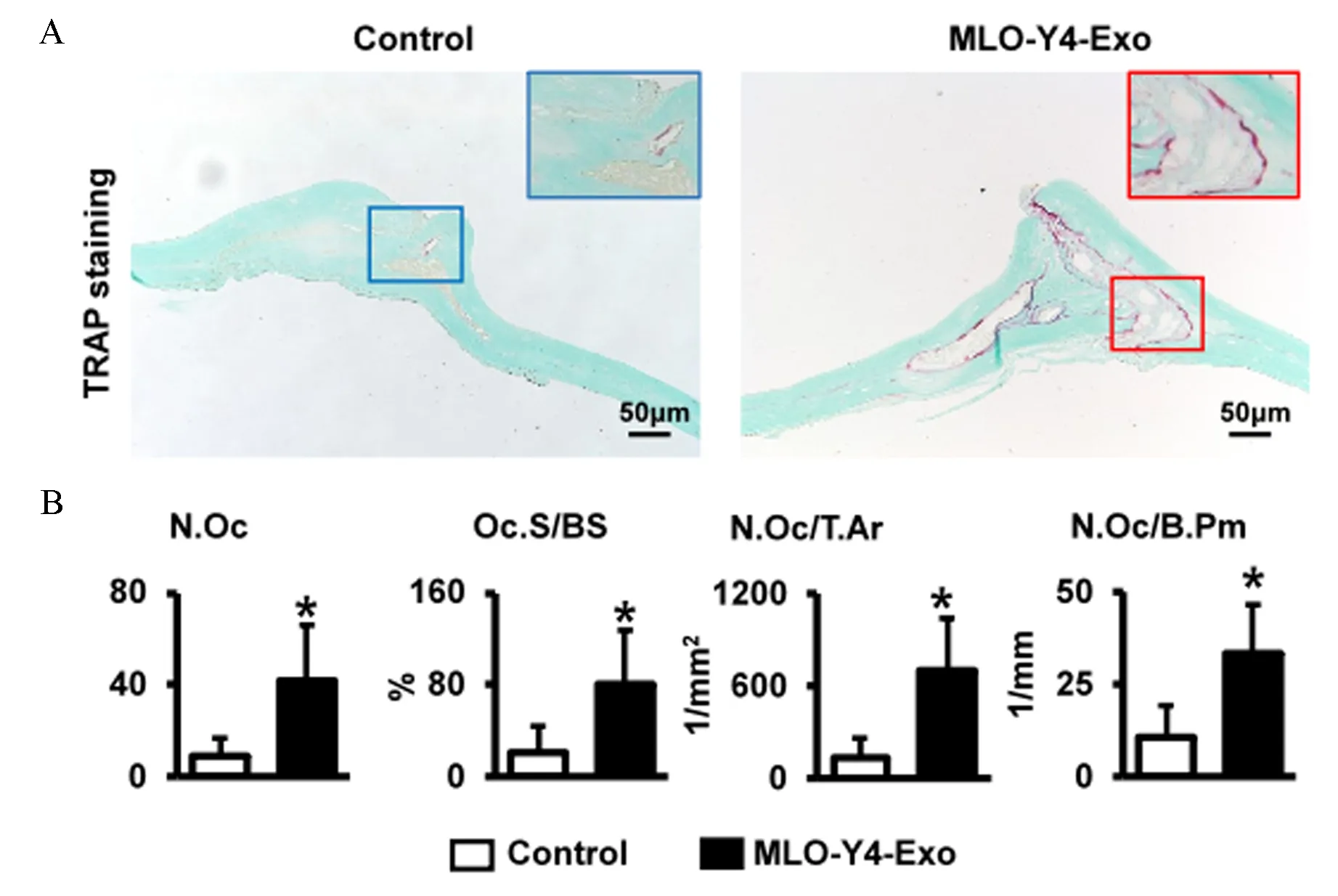
注:A:组织TRAP染色;B:破骨细胞计数。n=5, 与Control比较,*P<0.05。
2.4 MLO-Y4来源的外泌体传递RANKL
原代小鼠BMM细胞的RANKL免疫荧光染色结果显示,PBS处理组BMM中红色荧光较少,RANKL表达量极低,MLO-Y4-Exo处理组BMM中RANKL含量增加(图4A)。小鼠颅骨切片免疫组化检测显示,与注射PBS的组相比,注射MLO-Y4-Exo的小鼠颅骨RANKL表达更高(图4B),这解释了MLO-Y4-Exo治疗组颅骨破骨细胞增多的原因。

注:A:免疫荧光染色检测BMM细胞中RANKL表达;B:骨组织切片免疫组化染色检测RANKL表达。
2.5 MLO-Y4来源的外泌体通过RANKL促进破骨细胞分化
siRNA-FAM质粒处理MLO-Y4细胞48 h后,在荧光显微镜下观察转染效率(图5A)。siRNA-RANKL转染MLO-Y4后,qPCR检测显示细胞RANKL mRNA表达降低(图5B)。获取MLO-Y4细胞外泌体,采用RIPA裂解液裂解外泌体囊泡膜,然后采用ELISA测量RANKL含量,发现siRNA-RNAKL敲低MLO-Y4中RANKL基因后,外泌体囊泡中RANKL蛋白含量降低(图5C)。细胞外泌体(siRANKL-MLO-Y4-Exo)用于BMM培养,TRAP染色显示siRANKL-MLO-Y4-Exo处理组较MLO-Y4-Exo组和siNC-MLO-Y4-Exo组的TRAP阳性的单核细胞和大于三个核的破骨细胞均减少(图5D~E)。
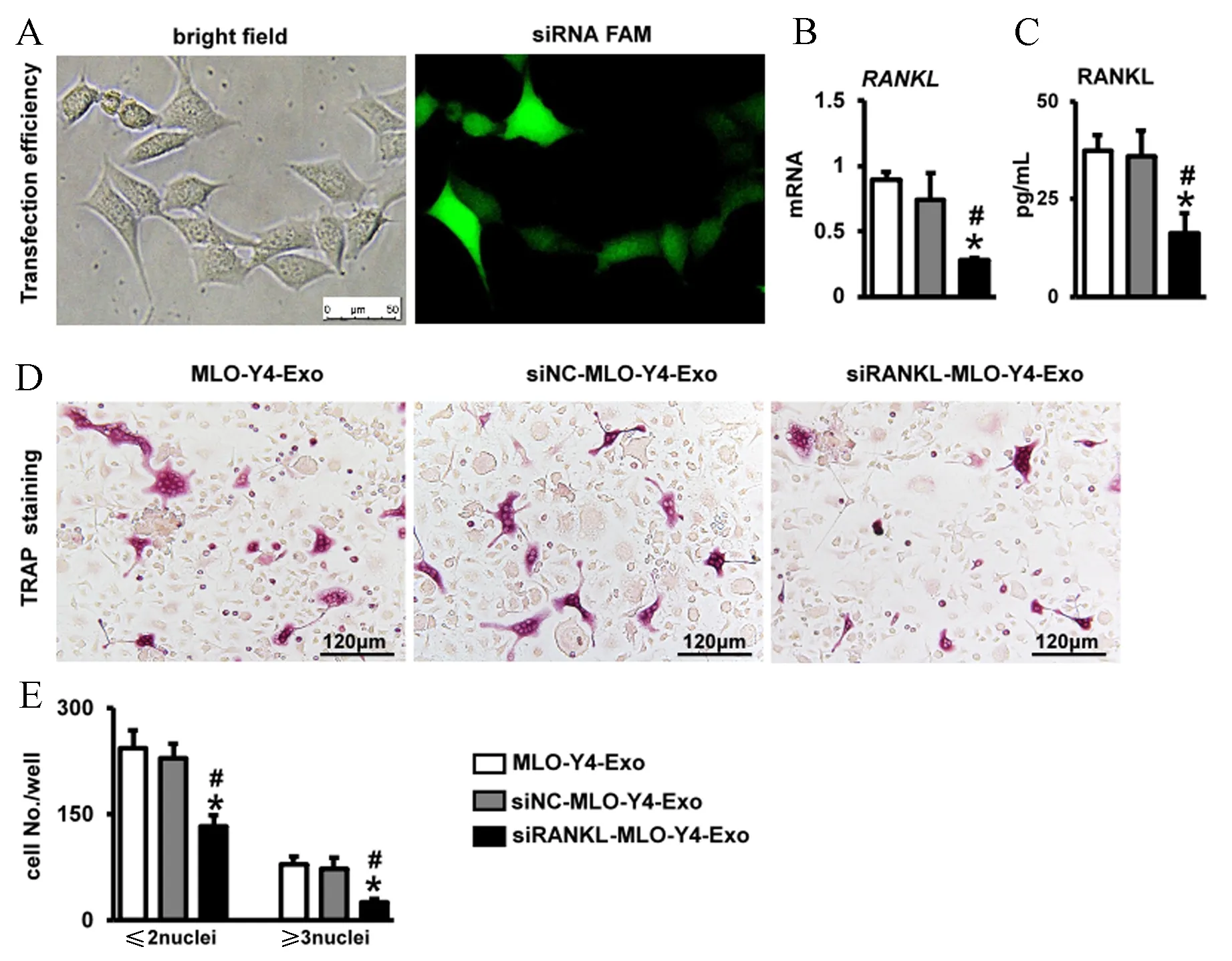
注:A:荧光显微镜检测FAM siRNA转染MLO-Y4细胞的效率;B:qPCR检测RANKL si-RNA的沉默效率;C:ELISA检测MLO-Y4外泌体中RANKL蛋白的浓度;D:TRAP染色;E:TRAP阳性细胞(红色)计数。n=3, 与MLO-Y4-Exo组比较,*P<0.05;与siNC-MLO-Y4-Exo组比较,#P<0.05。
3 讨论
骨细胞是一种古老的细胞,最早发现存在于奥陶纪无颌鱼类中,是骨骼中数量最多的细胞,因为骨细胞包埋在坚硬的矿化基质中,极难接近和获取,也是研究最少的细胞。自从骨细胞从钙化骨基质中的分离成为可能[11],骨细胞相关的研究越来越多,这些细胞的功能才逐渐为人所知。本研究通过提取骨细胞样细胞MLO-Y4的外泌体,在体外实验证实其具有促进破骨细胞分化的能力,小鼠颅骨皮下注射MLO-Y4-Exo也显示破骨细胞数量增加。共培养细胞RANKL免疫荧光和颅骨组织免疫组化结果都证实增多的破骨细胞数量和RANKL高表达有关,通过小干扰RNA技术降低MLO-Y4细胞中RANKL表达,MLO-Y4-Exo对破骨细胞分化的促进作用也随之被逆转,说明MLO-Y4-Exo通过向破骨前体细胞传递RANKL促进其向破骨细胞分化。
MLO-Y4是第一个应用于骨细胞样研究的细胞系,从在骨钙素启动子控制下表达永生化T抗原的转基因小鼠中获得高度机械敏感性。截至2019年已有270多篇出版物使用MLO-Y4细胞系来研究骨细胞功能[30]。MLO-Y4细胞同原代骨细胞,高表达RANKL,具有支持破骨细胞形成和激活的功能[9]。通过对无骨细胞的转基因小鼠血浆外泌体和MLO-Y4细胞衍生外泌体之间的miRNA表达水平的比较,证实循环骨细胞的外泌体中包含的miRNA在MLO-Y4细胞外泌体中富集[31]。所以,本研究选用的MLO-Y4细胞具有骨细胞代表性。
本研究的创新点之一是证实了骨细胞外泌体对破骨细胞分化的调控作用。破骨细胞介导的骨吸收与成骨细胞介导的骨形成处于耦合状态以维持骨稳态,成骨细胞和破骨细胞之间的平衡关系对健康骨骼的发展至关重要,骨细胞作为骨骼中含量最多、寿命最长的细胞,其对成骨细胞和破骨细胞的双重调控作用具有重要意义。本课题组前期研究显示骨细胞脱细胞基质不仅具有促骨生成的作用,同时具有促进破骨细胞分化的作用[11],这有利于骨健康,在吸收旧骨同时形成新骨,维持骨骼健康状态。本研究发现了骨细胞通过外泌体调控破骨细胞,进而证明骨细胞对骨稳态的重要调控作用。
其次,骨细胞深埋于骨基质中,骨细胞如何调控破骨细胞还缺乏相关证据。一项研究表明,衰老导致的皮质骨流失中,骨细胞分泌的RANKL是必要条件,展现了骨细胞对破骨细胞直接调控的证据[32]。尽管有实验证实骨细胞分泌RANKL,对破骨细胞的调控起到至关重要的作用[33];但骨细胞深埋于骨基质中,骨细胞分泌的RANKL如何调控破骨细胞还未阐明。但有研究证明,骨细胞嵌在腔隙-小管系统中,小管直径约210~260 nm[34-35]。所以骨细胞分泌的RANKL可能通过外泌体的方式,经过骨细胞小管系统,带出骨基质,然后参与周围破骨细胞调控。这一新的调控方式为防治骨质疏松及骨代谢机制提供有力基础和新的研究思路。
本研究证实,骨细胞系MLO-Y4来源的外泌体通过向破骨前体细胞传递促破骨细胞分化因子RANKL来促进破骨细胞生成。

