T2DM伴骨质疏松Cys-C、25(OH)D3、BGP变化及临床意义
吴聪 陈素芳 董捷 韦晓雯
郑州大学第一附属医院,河南 郑州 450003
糖尿病(diabetes mellitus,DM)属于全身代谢性内分泌疾病,2型糖尿病(T2DM)是其常见类型[1]。骨质疏松是T2DM常见并发症,T2DM伴骨质疏松发病率可达20 %以上,其致残率高于单纯骨质疏松患者[2]。骨密度检测难以准确预测T2DM伴骨质疏松患者骨折发生风险,而常规骨代谢指标诊断效能较低[3]。因而探寻预测T2DM伴骨质疏松患者发生骨折的指标有助于改善患者预后。胱抑素C(Cys-C)属于半胱氨酸蛋白酶抑制剂,可参与肾功能损伤过程,而早期肾功能损伤可增加髋骨骨折风险[4]。25羟维生素D3[25(OH)D3]是维生素D代谢产物,可影响局部骨质代谢,引起骨密度、骨质微结构异常,促进骨质疏松发生发展[5]。骨钙素(BGP)是一种由成骨细胞合成的非胶原蛋白,可作为骨转换标志物,其水平变化与骨代谢紊乱有关[6]。目前Cys-C、25(OH)D3、BGP在老年T2DM伴骨质疏松患者中的应用价值尚未完全阐明,本研究通过检测老年T2DM伴骨质疏松患者血清Cys-C、25(OH)D3、BGP水平,分析其水平变化值对骨质疏松性骨折的预测价值,为临床防治老年T2DM伴骨质疏松及改善患者预后提供参考。
1 材料和方法
1.1 一般资料
选取2020年2月至2022年5月本院88例老年T2DM伴骨质疏松患者作为研究组,另选同期、同年龄段88例老年T2DM骨量减少患者作为对照A组,88例老年T2DM骨量正常患者作为对照B组。各组一般资料比较差异无统计学意义,具有可比性(P>0.05),见表1。本研究经本院伦理委员会批准。纳入标准:符合T2DM诊断标准[7];符合骨质疏松诊断标准[8];符合骨量减少、骨量正常诊断标准[9];年龄≥60岁;服用降糖药物控制血糖,且未应用胰岛素;患者及家属知情同意且签署知情同意书。排除标准:糖尿病急性并发症;伴有消化系统、泌尿系统等器质性疾病;合并恶性肿瘤;创伤性骨折者;近期服用钙剂、皮质类固醇激素等药物影响骨代谢者;视听、肢体障碍者;长期卧床者;继发性骨质疏松。
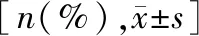
表1 一般资料
1.2 方法
1.2.1治疗方法:研究组均行常规对症治疗,常规控制血糖,同时予以骨化三醇(青岛正大制药有限公司,国药准字H20143141,规格:0.5 μg)0.25 μg/d、碳酸钙D3(江苏万高药业股份有限公司,国药准字H20183238,规格:500 mg)500 mg/d,连续治疗6个月。治疗结束后依据是否发生骨质疏松性骨折分为发生者、未发生者。采用DiscoveryWi型双X线骨密度仪(购自美国 Hologic公司)检测骨矿物质密度(BMD),由软件计算T值,T值≤-2.5视为发生骨质疏松性骨折,否则视为未发生[10]。
1.2.2收集临床资料:收集所有研究对象临床资料,统一录入计算机进行集中分析。分别采集入组时患者空腹静脉血3 mL,采用日立7660全自动生化检测仪(上海寰熙医疗器械公司)检测糖化血红蛋白(HbA1c)、空腹血糖(FPG)、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。
1.2.3检测血清Cys-C、25(OH)D3、BGP水平:采集对照A组、对照B组、研究组患者入组时空腹静脉血5 mL,另采集研究组治疗前、治疗1个月、3个月、6个月后空腹静脉血5 mL,3 500 r/min离心10 min,取上清液置于-80 ℃保存待检。采用AU5800全自动生化分析仪(美国贝克曼库尔特公司)检测血清Cys-C水平。采用ELISA法检测血清25(OH)D3水平,上海朗顿生物科技有限公司提供检测试剂盒。采用放射免疫法检测血清BGP水平,上海轩泽康生物公司提供检测试剂盒。
1.3 观察指标
①比较各组(入组时)血清Cys-C、25(OH)D3、BGP水平、实验室指标及BMD,并分析研究组血清各指标水平与血糖指标、血脂指标、BMD的相关性。②观察发生与未发生骨质疏松性骨折患者治疗前及治疗1个月、3个月、6个月后血清各指标水平及变化值,并分析治疗6个月后血清各指标变化值对骨质疏松性骨折的影响。③对比分析治疗1个月、3个月后血清各指标变化值对老年T2DM伴骨质疏松发生骨质疏松性骨折的预测价值。
1.4 统计学处理

2 结果
2.1 3组实验室指标及BMD比较
3组HbA1c、FPG、TG、TC、HDL-C、LDL-C水平比较差异无统计学意义(P>0.05);研究组血清Cys-C水平较对照A组、对照B组高,25(OH)D3、BGP水平、BMD较对照A组、对照B组低,对照A组血清Cys-C水平较对照B组高,25(OH)D3、BGP水平、BMD较对照B组低(P<0.05)。见表2。
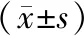
表2 3组实验室指标及BMD对比
2.2 血清Cys-C、25(OH)D3、BGP水平与血糖指标、血脂指标、BMD的相关性
相关性分析显示,研究组血清Cys-C、25(OH)D3、BGP水平与HbA1c、FPG、TG、TC、HDL-C、LDL-C水平无明显相关性(P>0.05),Cys-C水平与BMD呈负相关,25(OH)D3、BGP水平与BMD呈正相关(P<0.05)。见表3。
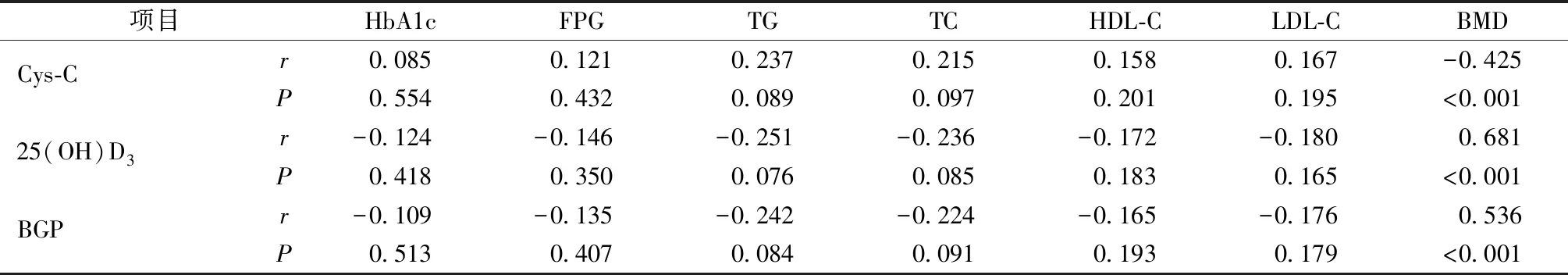
表3 血清Cys-C、25(OH)D3、BGP水平与血糖指标、血脂指标、BMD的相关性
2.3 发生与未发生骨质疏松性骨折患者血清Cys-C、25(OH)D3、BGP水平及变化值
研究组88例老年T2DM伴骨质疏松患者中,共有37例发生骨质疏松性骨折,51例未发生骨质疏松性骨折。重复测量方差分析:组间比较,发生骨质疏松性骨折患者治疗前、治疗1个月、3个月、6个月后血清Cys-C水平均较未发生骨质疏松性骨折患者高,25(OH)D3、BGP水平均较未发生骨质疏松性骨折患者低(P<0.05);组内比较,发生与未发生骨质疏松性骨折患者治疗前、治疗1个月、3个月、6个月后血清Cys-C水平均呈降低趋势,25(OH)D3、BGP水平呈升高趋势(P<0.05);组间-时间点交互作用比较,差异有统计学意义(P<0.05),见表4。发生骨质疏松性骨折患者治疗前、治疗1个月、3个月、6个月后血清Cys-C、25(OH)D3、BGP变化值均较未发生骨质疏松性骨折患者低(P<0.05),见表5。
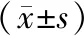
表4 发生与未发生骨质疏松性骨折患者血清Cys-C、25(OH)D3、BGP水平对比
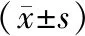
表5 发生与未发生骨质疏松性骨折患者血清Cys-C、25(OH)D3、BGP变化值对比
2.4 血清Cys-C、25(OH)D3、BGP变化值对骨质疏松性骨折的影响
以研究组血清Cys-C、25(OH)D3、BGP治疗6个月后与治疗前差值的绝对值Cys-C△3、25(OH)D3△3、BGP△3平均值(0.20 mg/L、4.56 ng/mL、1.40 ng/mL)为界,分为低变化(<平均值)、高变化(≥平均值)(P<0.05),通过相对危险度(RR)分析发现,Cys-C△3、25(OH)D3△3、BGP△3低变化均会导致骨质疏松性骨折发生风险增加(P<0.05)。见表6。

表6 血清Cys-C、25(OH)D3、BGP变化值对骨质疏松性骨折的影响
2.5 血清Cys-C、25(OH)D3、BGP变化值预测骨质疏松性骨折的价值
以发生骨质疏松性骨折患者为阳性样本,未发生骨质疏松性骨折患者为阴性样本,绘制治疗1个月、3个月后血清Cys-C、25(OH)D3、BGP变化值预测骨质疏松性骨折的ROC曲线,结果显示Cys-C△1、25(OH)D3△1、BGP△1单独预测的AUC分别为0.733、0.755、0.776,Cys-C△2、25(OH)D3△2、BGP△2单独预测的AUC分别为0.825、0.763、0.831,Cys-C△2、25(OH)D3△2、BGP△2联合预测的AUC大于Cys-C△1、25(OH)D3△1、BGP△1联合预测的AUC(Z=2.014,P=0.039)。见表7。
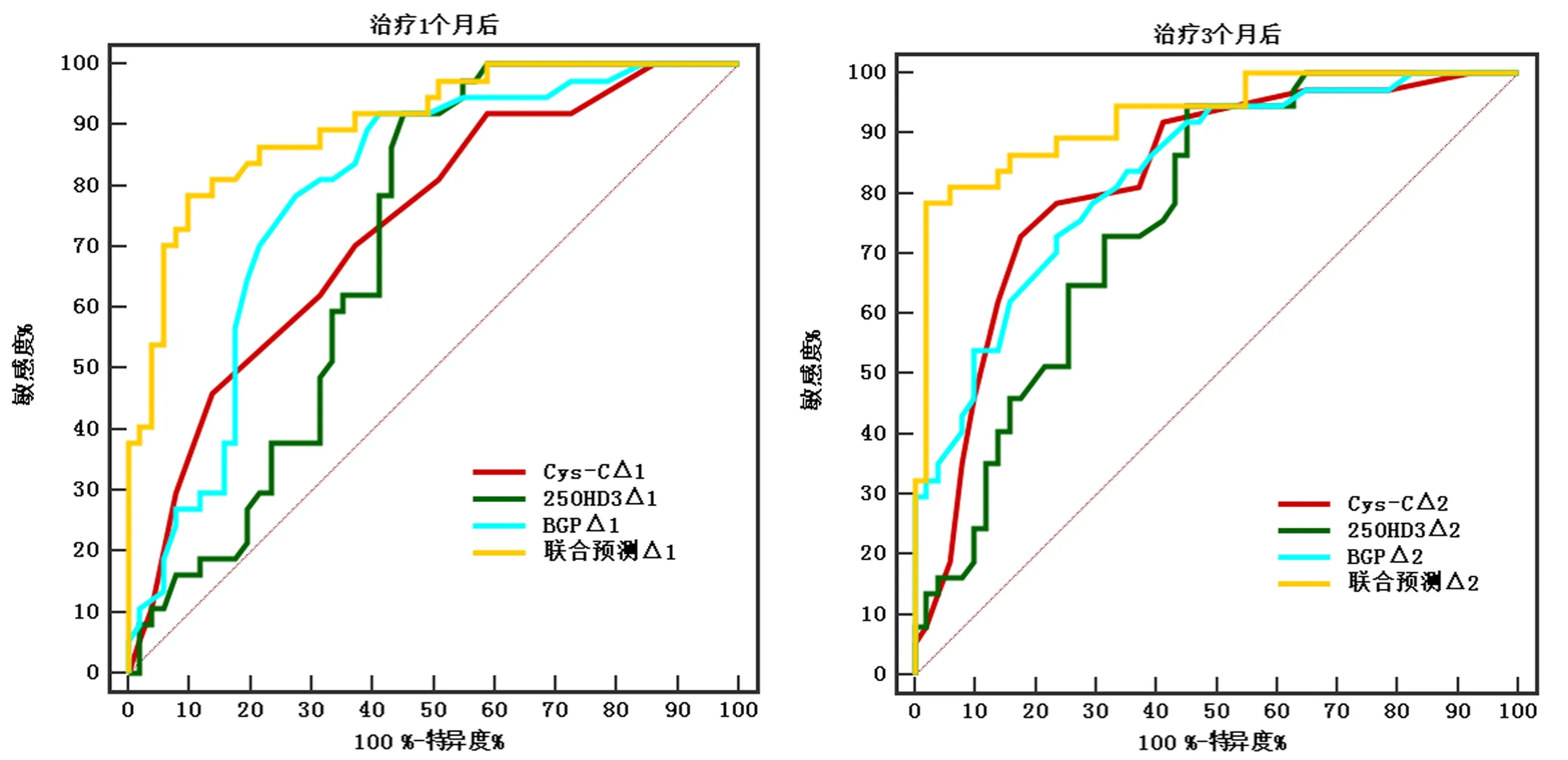
图1 血清Cys-C、25(OH)D3、BGP变化值预测骨质疏松性骨折的价值ROC曲线
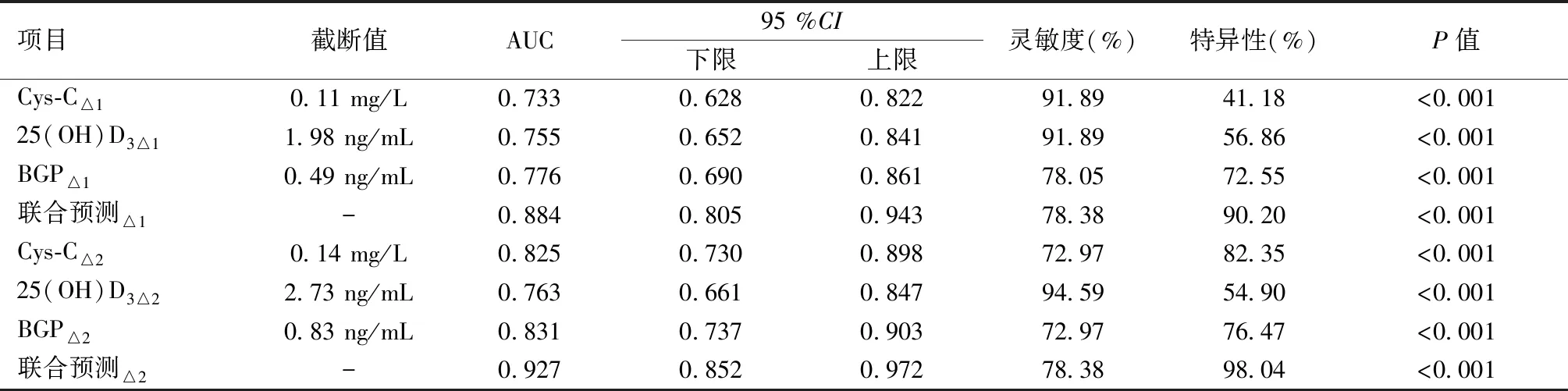
表7 血清Cys-C、25(OH)D3、BGP变化值预测骨质疏松性骨折的价值
3 讨论
T2DM伴骨质疏松发病机制可能与高血糖、低胰岛素水平、糖基化终末产物、微血管病变、肾功能衰竭、胰岛素样生长因子-1、炎性反应有关[11-12]。
Cys-C与同型半胱氨酸(Hcy)代谢过程密切相关,可增高Hcy水平,Hcy可增强氧化应激反应,改变血管扩张能力,增加血管血流阻力,减少骨血流量,并可降低成骨细胞活性,抑制破骨细胞凋亡,促进骨质流失,进而导致骨质疏松[13-14]。本研究结果显示,研究组血清Cys-C水平高于对照A组、对照B组,且对照A组高于对照B组,提示Cys-C水平升高可能参与老年T2DM患者骨质疏松发生发展过程。Cys-C可影响骨吸收活性,抑制胶原交联,促使单核巨噬细胞分化为破骨细胞,破坏骨骼稳态环境,影响骨转化过程,进而影响BMD[15];Cys-C可调节Hcy表达水平,Hcy与细胞外基质中胶原蛋白结合,影响骨胶原网状结构形成,减低骨强度,增加骨折发生风险[16]。本研究结果显示,Cys-C与BMD呈负相关,这与穆玉晶等[17]研究结果相似,提示BMD降低可能与T2DM伴骨质疏松患者肾脏损伤程度有关。同时本研究发现发生骨质疏松性骨折患者治疗前、治疗后血清Cys-C水平高于未发生者,治疗前后血清Cys-C水平变化值低于未发生者,进一步证实其变化值降低可增加骨质疏松性骨折发生风险。研究表明监测T2DM人群血清Cys-C水平有助于筛查骨质疏松[18]。本研究发现以Cys-C△2>0.14 mg/L作为判断标准时AUC为0.825,表明治疗3个月后Cys-C水平变化值对骨质疏松性骨折具有较高预测价值,但对于该部分患者是否需要干预还需进一步研究。
25(OH)D3可促进钙盐沉积、骨小梁再生,其水平降低可促使骨质中硫酸盐、碳酸盐沉积减少,诱发骨质流失[19]。T2DM患者肾功能损伤后可减少维生素D含量,25(OH)D3缺乏可影响人体内钙转运,促使肠钙吸收减少,并可激活成骨细胞,加之炎性反应刺激,可增加骨折发生风险[20]。本研究结果显示,研究组血清25(OH)D3水平低于对照A组、对照B组,且对照A组低于对照B组,这与岳斌等[21]研究结果相似。25(OH)D3对骨质疏松具有一定预测价值[22-23]。本研究结果显示发生骨质疏松性骨折患者治疗前后血清25(OH)D3变化值低于未发生者,并可增加骨质疏松性骨折发生风险,表明25(OH)D3水平变化与骨质疏松性骨折具有相关性。本研究发现治疗3个月后血清25(OH)D3水平变化值预测骨质疏松性骨折的AUC为0.763,提示25(OH)D3水平变化对骨折发生风险具有一定预测效能。
BGP可反映骨细胞活性、骨转换过程,并可激活破骨细胞,维持骨正常矿化速率,抑制软骨矿化,其水平升高表明骨功能增强[24-25]。本研究中,研究组血清BGP水平低于对照A组、对照B组,且对照A组低于对照B组,提示老年T2DM伴骨质疏松患者骨合成减少,骨吸收增多。可能是因为T2DM患者中胰岛素抵抗持续存在,减弱其对成骨细胞的刺激作用,增加骨细胞中氨基酸含量,减少骨胶原合成、成骨细胞数量,促使骨基质成熟,降低其转换速率,致使骨质疏松发生[26]。本研究发现BGP水平与BMD呈正相关,这与既往研究报道结果相似[27],BGP变化值降低可增加骨质疏松性骨折发生风险,表明BGP水平升高表明骨质流失速度增快,可能参与骨折发生过程。研究报道指出BGP可反映老年T2DM患者骨质疏松程度,并可用于评估骨质疏松治疗效果[28]。本研究结果显示治疗1个月、3个月后BGP变化值预测骨质疏松性骨折的AUC分别为0.776、0.831,表明血清BGP水平变化对预测骨质疏松性骨折具有一定价值。同时本研究发现治疗1个月、3个月后血清各指标变化值联合预测骨质疏松性骨折的AUC分别为0.884、0.927,提示血清各指标联合预测骨质疏松性骨折具有更高预测效能,其原因可能为各个指标用于预测骨折发生具有一定互补性,存在一定内在联系。
综上所述,老年T2DM伴骨质疏松患者血清Cys-C水平升高,25(OH)D3、BGP水平降低,治疗前后血清各指标水平变化值降低可增加骨质疏松性骨折发生风险,各指标变化值联合预测骨质疏松性骨折具有一定临床价值。但本研究病例数过少、观察周期过短、观察指标未涉及骨折相关指标,下一步将扩大样本量深入探究。

