稻前减饲对小龙虾生长性能、组织生理指标及肌肉营养成分的影响
吴雷明 韩光明 覃宝利 寇祥明 王守红 张家宏* 袁 秦 毕建花 唐鹤军
(1.江苏里下河地区农业科学研究所,扬州 225007;2.江苏省生态农业工程技术研究中心,扬州 225008)
克氏原螯虾(Procambarusclarkii)属十足目、鳌虾科,俗称小龙虾,其具有适应性广、繁殖能力强、营养丰富等特点[1]。该虾借助稻渔生态种养模式完成了从默默无名到万众瞩目的华丽转身[2],是目前我国养殖产量最大的淡水甲壳类动物[3]。2022年小龙虾产业报告显示,其养殖总产量为263.36万t,占全国淡水养殖产量的8.27%,位列我国淡水养殖品种第6位,产业总值突破了4 200亿元[4]。
农业绿色发展要求兼顾低碳生产、经济增收及安全供给[5],追求生态、经济、社会等多元目标共赢。饲料过量投入是造成小龙虾养殖生产成本增加和养殖环境污染的主要因素之一[6]。大量残饵、排泄物等废弃物,给生态环境造成了严重的负面影响,威胁系统生态平衡[7]。稻虾养殖系统内未被利用的氮、磷营养盐,可通过水草、浮游动物及浮游植物等天然饵料途径间接转移到小龙虾体内,促进系统的营养元素周转和物质循环[8]。通过提高饲料利用率、培育天然饵料及优化水草配置等技术手段[9],发展以循环、绿色、低碳为主要载体的小龙虾养殖业,能够达到节本增效、提高质量安全、绿色环保的目的[10]。
小龙虾属于杂食性动物,其食物来源颇为丰富,水草、藻类、水生昆虫、动物尸体及有机质等均可作为其天然饵料,食物匮缺时甚至会自相残食[11-12]。水草不仅可作为小龙虾等淡水虾蟹的天然生物饵料,而且可降低人工配合饲料的投喂量[13]。为了降低饲料投入量,节约养殖成本,减轻小龙虾养殖生态环境压力,本试验研究了减饲对小龙虾生长性能、组织生理指标和肌肉营养成分的影响,旨在为稻前小龙虾养殖过程中饲料的合理投喂提供理论参考,并促进稻虾连作模式的绿色健康发展。
1 材料与方法
1.1 试验材料
选择规格整齐、附肢齐全、活动能力强的克氏原螯虾幼虾为试验对象,其平均体重为(3.54±0.73) g。
试验饲料组成及营养水平见表1。饲料的制作流程为:原料经粉碎后,过60目筛,然后按比例称重并逐级混匀,均匀喷入豆油。加入30%的水混匀,用平磨式颗粒饲料机(105A-4-2)制粒,粒径为2.5 mm,制粒后晾干,4 ℃保存备用。

表1 试验饲料组成及营养水平(干物质基础)
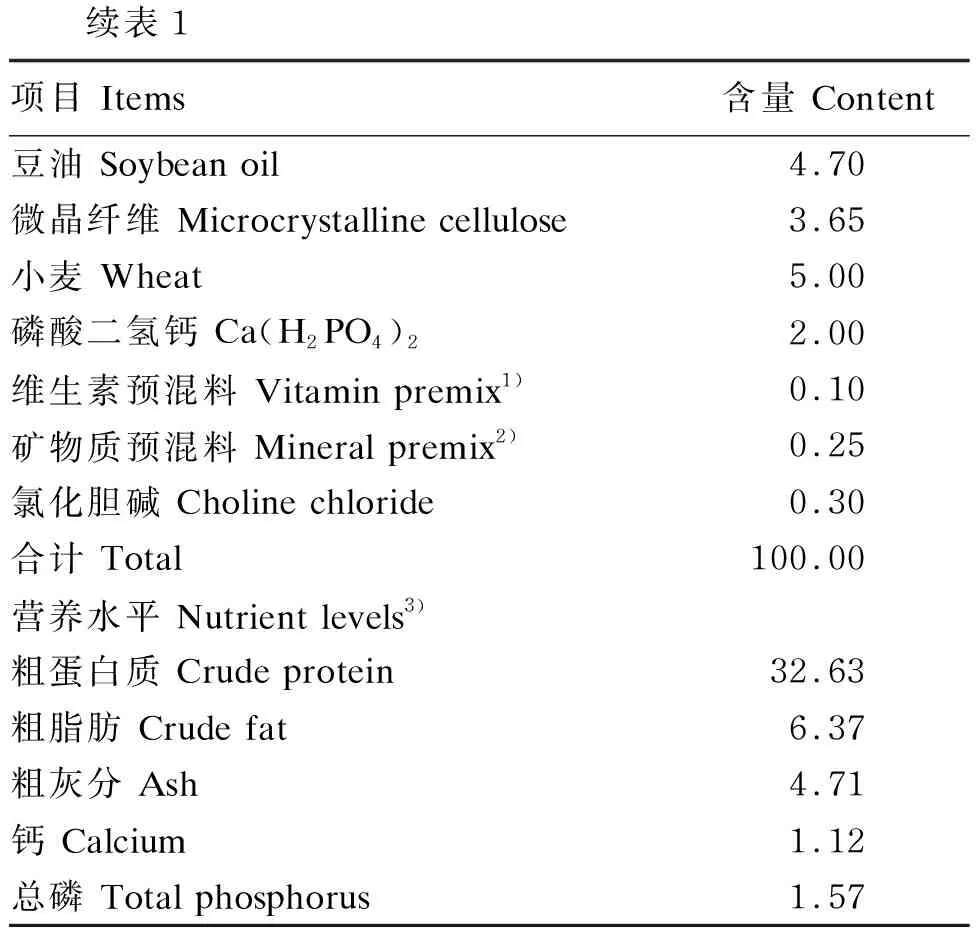
续表1项目 Items含量 Content豆油 Soybean oil4.70微晶纤维 Microcrystalline cellulose3.65小麦 Wheat5.00磷酸二氢钙 Ca(H2PO4)22.00维生素预混料 Vitamin premix1)0.10矿物质预混料 Mineral premix2)0.25氯化胆碱 Choline chloride0.30合计 Total100.00营养水平 Nutrient levels3)粗蛋白质 Crude protein32.63粗脂肪 Crude fat6.37粗灰分 Ash4.71钙 Calcium1.12总磷 Total phosphorus1.57
1.2 试验设计及饲养管理
幼虾暂养7 d,使其适应养殖水体环境,消除应激反应。试验共选择360尾幼虾,随机分为3组:对照组(G1组,投饲100%)、减饲2组(G2组,减饲20%)、减饲3组(G3组,减饲30%),每组3个重复,每个重复投放40尾幼虾。G1组每日饲料投喂量为幼虾总体重的5%(即投饲率为5%),G2组投饲率为4%,G3组投饲率为3.5%,并结合体重标定法[14]和饱食确定法[14]以及天气情况进行调整。养殖水族箱为长3.0 m、宽2.5 m、高1.2 m的帆布箱。按照常规稻虾种养模式的田间工程设计,进行试验养殖小区的构建及优化,在小区单侧开挖长2.5 m、宽0.5 m、深0.5m的虾沟。秸秆和稻茬淹水腐烂后,在田面种植伊乐藻,覆盖度为50%。阴雨天开启增氧机,进行增氧。水温为(23.51±2.92) ℃,溶氧含量为(6.72±2.96) mg/L,pH为7.57±0.08。日常记录饲料投喂、进排水及幼虾死亡等情况。试验养殖周期为52 d。
1.3 指标测定
1.3.1 生长性能指标测定
养殖周期结束后,采用电子天平测量全部小龙虾的体重、肌肉重及肝胰腺重,采用游标卡尺测量体长。同时,按照市场消费习惯将小龙虾分为小、中、大3种规格:体重≤20 g、20 g<体重<35 g、体重≥35 g,观察每个组小龙虾体重组成分布情况。小龙虾成活率、肝胰腺指数、特定生长率及饲料系数计算公式如下:
成活率(SR,%)=(终末试验虾数目/
初始试验虾数目)×100;
肝胰腺指数(HSI,%)=(肝胰腺重/
终末体重)×100;
特定生长率(SGR,%/d)=[(ln总终末体重-
ln总初始体重)/养殖天数]×100;
饲料系数(FCR)=饲料投喂量/(总终末体重-
总初始体重)。
1.3.2 消化酶(肝胰腺、肠道)活性和抗氧化指标(血淋巴、肝胰腺)测定
养殖周期结束后,首先,采用1.5 mL注射器吸取0.3 mL乙二胺四乙酸二钾(EDTA-2K)抗凝剂,于小龙虾头胸甲后方插入围心腔取血淋巴1.2~1.5 mL,振荡2 min,于4 ℃、8 000 r/min离心10 min,吸取上清液,保存于-70 ℃。然后,取小龙虾肝胰腺和肠道样品,保存于-70 ℃。样品加0.85%生理盐水,冰浴匀浆离心,取上清液于4 ℃保存用于后续分析。采用相应试剂盒(南京建成生物工程研究所)检测肝胰腺和肠道消化酶(胰蛋白酶、淀粉酶、脂肪酶、纤维素酶)活性,同时检测血淋巴和肝胰腺抗氧化指标[超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽-S转移酶(GSH-ST)活性,丙二醛(MDA)含量及总抗氧化能力(T-AOC)]。
1.3.3 肌肉营养成分测定
养殖周期结束后,取小龙虾腹部肌肉,保存于-70 ℃,用于检测肌肉氨基酸(水解氨基酸)和中长链脂肪酸含量。
氨基酸含量测定:精确称取样品置于厌氧水解管中,加入6 mol/L盐酸5 mL混匀,然后放入冷冻剂(液氮或干冰)冷冻,待溶液凝固后取出,在真空泵抽气管上抽真空封管,然后在110 ℃的恒温干燥箱内水解13 h,冷却后定容至10 mL,0.45 μm水系滤膜过滤除杂,吸取0.5 mL滤液置于EP管中,然后在真空浓缩仪内真空干燥,残留物用1 mL去离子水溶解,再干燥,反复进行2次,最后加入1 mL pH 2.2样品稀释液溶解,0.22 μm水系滤膜过滤,采用氨基酸自动分析仪进行分析。委托南京建成科技有限公司检测。
中长链脂肪酸含量测定:称取适量样本于15 mL离心管中,精确加入2 mL 1%硫酸甲醇溶液,充分混匀振荡1 min,80 ℃水浴锅中酯化30 min,取出后冷却,精确加入1 mL正己烷萃取,振荡混匀30 s,静置5 min,再加入5 mL水(4 ℃)洗涤,4 ℃、3 500 r/min离心10 min,精准吸取700 μL上清液于2 mL离心管中,再加入100 mg无水硫酸钠粉末除去多余水分,振荡混匀30 s,12 000 r/min离心5 min,精确吸取300 μL上清液于2 mL离心管中,加入15 μL 500 mg/L水杨酸甲酯作为内标,振荡混匀10 s,吸取200 μL上清液加入到检测瓶中,采用脂肪酸自动分析仪进行分析。委托上海拜谱生物科技有限公司检测。将所有样本及相关数据进行距离矩阵计算,并采用层次聚类(hierarchical cluster)对所有样本进行聚类分析,同时利用偏最小二乘判别分析方法,分析各组小龙虾肌肉脂肪组成差异情况。
1.4 统计分析
采用SPSS 18.0统计软件中的单因子方差分析(one-way ANOVA)对数据进行统计分析,若达到显著性差异,则采用Duncan氏法进行多重比较,P<0.05表示差异显著,P>0.05表示差异不显著。
2 结 果
2.1 不同减饲比例对小龙虾生长性能的影响
由表2可知,G1组和G2组小龙虾体重显著高于G3组(P<0.05),3组之间体长无显著差异(P>0.05)。G1组肝胰腺指数与G2组无显著差异(P>0.05),而显著高于G3组(P<0.05)。3组小龙虾的饲料系数无显著差异(P>0.05)。与G1组相比,G2组和G3组小龙虾饲料系数分别降低了5.48%、13.70%。3组之间小龙虾的成活率无显著差异(P>0.05)。3组小龙虾的特定生长率无显著差异(P>0.05),但呈下降趋势。
由图1可知,G1组无小规格个体(体重≤20 g),G2组和G3组小规格个体数量分别占3.70%和7.14%,两者之间无显著差异(P>0.05)。G3组中规格个体(20 g<体重<35 g)数量显著高于G1组(P<0.05),与G2组之间无显著差异(P>0.05)。G1组和G2组大规格个体(体重≥35 g)数量显著高于G3组(P<0.05)。

表2 不同减饲比例对小龙虾生长性能的影响

数据柱形标注不同小写字母表示差异显著(P<0.05)。
2.2 不同减饲比例对小龙虾肝胰腺和肠道消化酶活性的影响
由表3可知,G1组小龙虾肝胰腺胰蛋白酶活性显著低于G2组和G3组(P<0.05),后两者之间无显著差异(P>0.05)。G1组与G2组小龙虾肝胰腺淀粉酶活性无显著差异(P>0.05),两者显著低于G3组(P<0.05)。3组之间小龙虾肝胰腺脂肪酶和纤维素酶活性无显著差异(P>0.05)。
由表3可知,G1组与G3组小龙虾肠道胰蛋白酶活性显著高于G2组(P<0.05),前两者之间无显著差异(P>0.05)。G3组小龙虾淀粉酶活性显著高于G2组(P<0.05),与G1组无显著差异(P>0.05)。3组脂肪酶活性变化规律与淀粉酶相同。G3组小龙虾肠道纤维素酶活性显著高于G1组和G2组(P<0.05),后两者之间无显著差异(P>0.05)。

表3 不同减饲比例对小龙虾肝胰腺和肠道消化酶活性的影响
2.3 不同减饲比例对小龙虾血淋巴和肝胰腺抗氧化指标的影响
由表4、表5可知,3组小龙虾肝胰腺SOD、CAT及GSH-Px活性及MDA含量无显著差异(P>0.05)。G1组小龙虾肝胰腺GSH-ST活性与G3组之间无显著差异(P>0.05),两者显著低于G2组(P<0.05)。G1组小龙虾肝胰腺T-AOC与G2组和G3组均无显著差异(P>0.05)。3组小龙虾血淋巴SOD、GSH-ST、GSH-Px活性及T-AOC无显著差异(P>0.05)。G1组小龙虾血淋巴CAT活性与G2组、G3组均无显著差异(P>0.05)。G2组小龙虾血淋巴MDA含量显著高于G1组(P<0.05),而与G3组之间无显著差异(P>0.05)。

表4 不同减饲比例对小龙虾肝胰腺抗氧化指标的影响

表5 不同减饲比例对小龙虾血淋巴抗氧化指标的影响
2.4 不同减饲比例对小龙虾肌肉营养成分的影响
由表6可知,G2组小龙虾肌肉谷氨酸(Glu)、缬氨酸(Val)、异亮氨酸(Ile)、亮氨酸(Leu)、苯丙氨酸(Phe)及赖氨酸(Lys)含量显著高于G1组(P<0.05)。G3组小龙虾肌肉天冬氨酸(Asp)、苏氨酸(Thr)、丝氨酸(Ser)、Glu、Val、Ile、Leu、Phe、组氨酸(His)及Lys含量显著高于G1组(P<0.05)。3组之间小龙虾肌肉甘氨酸(Gly)、丙氨酸(Ala)、蛋氨酸(Met)、酪氨酸(Tyr)及精氨酸(Arg)含量无显著差异(P>0.05)。G2组小龙虾肌肉鲜味氨基酸含量与G1组无显著差异(P>0.05)。G3组小龙虾肌肉鲜味氨基酸含量显著高于G1组(P<0.05),与G2组无显著差异(P>0.05)。G2组和G3组小龙虾肌肉必需氨基酸含量显著高于G1组(P<0.05)。G2组和G3组小龙虾肌肉总氨基酸含量显著高于G1组(P<0.05),前两者之间无显著差异(P>0.05)。

表6 不同减饲比例对小龙虾肌肉氨基酸含量的影响

续表6项目 Items组别 GroupsG1G2G3亮氨酸 Leu14.16±0.35b15.63±0.53a15.93±0.42a酪氨酸 Tyr6.84±0.507.53±0.157.14±0.34苯丙氨酸 Phe8.09±0.13b8.95±0.24a9.17±0.10a组氨酸 His4.57±0.20b5.24±0.26ab5.44±0.48a赖氨酸 Lys14.91±0.45b16.20±0.12a16.39±0.44a精氨酸 Arg20.47±0.63a21.02±0.54a21.39±0.65a鲜味氨基酸 DAA88.01±3.75b94.55±1.96ab97.65±3.79a必需氨基酸 EAA61.63±2.28b67.18±1.57a69.42±1.97a总氨基酸 TAA173.77±7.02b186.90±3.63a193.03±6.56a
由表7可知,G1组小龙虾肌肉C6∶0、C8∶0、C11∶0、C13∶0、C16∶0及C18∶0含量显著高于G2组、G3组(P<0.05)。G3组小龙虾肌肉C10∶0含量显著高于G1组和G2组(P<0.05),后两者之间无显著差异(P>0.05)。G1组小龙虾肌肉C15∶1和C17∶1含量显著低于G2组和G3组(P<0.05),后两者之间无显著差异(P>0.05)。G1组小龙虾肌肉C20∶1含量显著低于G3组(P<0.05),而与G2组之间无显著差异(P>0.05)。G3组小龙虾肌肉C18∶3n3含量显著高于G1组和G2组(P<0.05),后两者之间无显著差异(P>0.05)。3组之间小龙虾肌肉C20∶5n3含量无显著差异(P>0.05)。G2组小龙虾肌肉C22∶6n3含量显著低于G1组和G2组(P<0.05),后两者之间无显著差异(P>0.05)。G1组小龙虾肌肉总饱和脂肪酸含量显著高于G2组和G3组(P<0.05),后两者之间无显著差异(P>0.05)。3组之间小龙虾肌肉总单不饱和脂肪酸、总多不饱和脂肪酸含量无显著差异(P>0.05)。
3组小龙虾肌肉脂肪酸组成存在一定的差异(图2),与G3组小龙虾肌肉脂肪酸组成相比,G1组与G2组更加相似(图3)。

表7 不同减饲比例对小龙虾肌肉脂肪酸含量的影响

图2 不同减饲比例组肌肉脂肪酸组成偏最小二乘判别分析

图3 不同减饲比例组肌肉脂肪酸组成层次聚类分析
3 讨 论
3.1 不同减饲比例对小龙虾生长发育的影响
明确适宜投饲水平是水产养殖生态和营养生理研究中的一个重要内容,过低或者过高均不利于养殖对象的快速生长和养殖效益的提高[15]。本研究结果显示,减饲组小龙虾饲料系数存在下降现象,与G1组之间无显著差异;另外,减饲影响了养殖群体体重分布组成,随着减饲比例增大,大规格个体数量显著减少。因此,从整体养殖经济效益角度出发,小龙虾池塘养殖饲料可减饲20%,即适宜投饲率为4%。武汉蔡甸区黄金湖小龙虾食物组成以竹叶眼子菜、黑藻等大型水生植物为主,占总摄食量的85.6%[16]。通过同位素技术分析,在小龙虾养殖过程中,伊乐藻具有重要的营养功能[13],对小龙虾的食源贡献率为55.9%,显著提高其生长性能[17]。本试验研究结果显示,小龙虾养殖过程中合理种植伊乐藻,减饲一定的比例对其生长性能无明显的影响,推测此结果源于伊乐藻养殖环境能够为小龙虾提供充足的天然饵料营养源[18],与饲料协同促进了小龙虾生长。
3.2 不同减饲比例对小龙虾消化酶活性和抗氧化指标的影响
消化酶活性与养殖对象的生长发育存在密切关系,其活性变化可反映动物在环境中的生理状态和对环境的适应性[19]。本研究结果显示,减饲对小龙虾消化酶活性产生了重大影响,尤其是30%减饲组,其小龙虾肝胰腺胰蛋白酶、淀粉酶活性及肠道纤维素酶活性显著高于G1组。推测出现上述结果原因主要有以下2点:首先,减饲组小龙虾通过提高消化酶活性的方式,提升对饲料的利用效率,应对食物匮乏的生活环境[20]。其次,减饲组小龙虾的食物组成发生了重大变化,使得肝胰腺和肠道的消化酶活性出现了重大变化。食物作为消化酶的作用底物,养殖对象分泌的消化酶在一定程度上会受摄食的饵料影响而发生改变[21],其营养组成与消化酶的活性密切相关[22]。本试验研究结果显示,30%减饲组小龙虾肠道纤维素酶活性的显著提高,可能与小龙虾大量摄食了水草、浮游植物等食物有关,需要通过胃含物分析法、高通量测序的方法进一步确认[23]。
正常生理状态下,动物体内活性氧作为新陈代谢的产物浓度极低且处于动态平衡状态,而过量的自由基会对鱼体内细胞、组织甚至其他活性物质造成损害[24],SOD、CAT和MDA是几种经典的反映机体氧化胁迫状况的生理指标[25]。本试验研究结果显示,3组间小龙虾血淋巴SOD、CAT、GSH-Px活性、T-AOC、MDA含量均无显著差异,肝胰腺SOD、GSH-ST、GSH-Px活性及T-AOC亦无显著差异,表明本研究饲料减饲量未对小龙虾机体产生强烈的应激反应。
3.3 不同减饲比例对小龙虾肌肉营养成分的影响
生活环境和食物组成是影响鱼肌肉品质的主要因素[26],主要影响其肌肉组织的营养成分、品质特性和代谢特征[27]。本试验研究结果显示,减饲显著影响了小龙虾肌肉氨基酸组成,其中G2组和G3组分别有9和6种氨基酸含量显著高于G1组,同时G2组和G3组肌肉必需氨基酸含量显著高于G1组。小龙虾肌肉风味鲜美与其体内的鲜味氨基酸含量具有密不可分的关系,主要取决于蛋白质中鲜味氨基酸(Asp、Glu、Gly、Ala、Tyr、Phe)的总量[28]。本试验研究结果显示,G3组小龙虾肌肉总必需氨基酸和总鲜味氨基酸含量显著高于G1组,表明饲料减饲有利于改善小龙虾肌肉营养组成,提高小龙虾肌肉风味。伊乐藻可以显著改善中华绒螯蟹肌肉的必需氨基酸和鲜味氨基酸含量[29],减饲组小龙虾可能摄食了部分伊乐藻,从而改善了肌肉营养组成。
小龙虾腹部肌肉脂肪酸含量和组成差异是评价其营养价值的重要指标[30],其含量和组成受生活环境、饵料类型、养殖模式等多种因素影响[31]。饱和脂肪酸可为机体提供能量,不饱和脂肪酸对机体生长发育有促进作用[32-33]。本试验研究结果显示,减饲显著降低了肌肉饱和脂肪酸含量,且G3组小龙虾肌肉单不饱和脂肪酸(C15∶1、C17∶1、C20∶1)和多不饱和脂肪酸(C18∶3n3)含量显著高于G1组。结合小龙虾肌肉脂肪酸组成的PLS-DA分析和聚类分析,结果显示,减饲对小龙虾肌肉脂肪酸组成产生了显著影响,尤其是G3组与G1组差异性较大。脂肪酸在天然饵料中的含量会影响特定组织的生存、生长发育以及生殖性能[34]。本试验G1组和减饲组小龙虾肌肉营养成分的差异可能是食物组成差异造成的。伊乐藻能够改善中华绒螯蟹的营养品质,摄食伊乐藻的中华绒螯蟹,其肝胰腺饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸含量均显著高于无水草组[29]。
4 结 论
稻前虾小龙虾养殖,按照本试验减饲方式:5%的投饲率基础上减饲20%、30%,对小龙虾养殖产量无显著影响,但会影响养殖群体体重分布组成,同时改善小龙虾肌肉氨基酸和脂肪酸组成。结合生产过程中不同小龙虾规格经济效益进行分析,认为稻前小龙虾养殖适宜投饲方式为减饲20%,即适宜投饲率为4%。

