外源性营养物质与肠道微生物群-肠-脑轴互作途径及机制研究进展
杨 雨 肖定福* 邢月腾 王昭喆
(1.湖南农业大学动物科学技术学院,长沙 410128;2.安阳工学院生物与食品工程学院,安阳 455000)
肠道内含有数以万亿计的微生物,包括细菌、病毒、真菌以及原生生物和古菌等,统称为肠道微生物群[1]。肠道环境有利于来自7个主要分支细菌的生长,分别是厚壁菌门、拟杆菌门、放线菌门、梭杆菌门、变形菌门、疣微菌门和蓝藻菌门。在这7个门中,拟杆菌门和厚壁菌门占总数的90%以上,对宿主生命活动调控产生重要作用[2]。肠道中不仅含有大量的肠道微生物群,还存在丰富的神经细胞和免疫细胞,肠道微生物群、中枢神经系统和肠神经系统形成交互调控的新通路,称为肠道微生物群-肠-脑轴,这种交流是双向的,对维持内环境稳态非常重要。肠道微生物可以通过神经[迷走神经、肠神经系统(enteric nervous system,ENS)和脊神经]、免疫(细胞因子)和代谢[短链脂肪酸(short chain fatty acid,SCFA)]等途径调节大脑[3],进而影响大脑的结构与功能。外源性营养物质已被证明是调节肠道微生物群组成,进而调节大脑和行为的关键因素之一,其对微生物多样性以及特定微生物的丰度和代谢能力有显著影响[4]。除此之外,补充特定营养物质可以改变肠道微生物组成和多样性,积极调节肠道与大脑的沟通,为治疗精神疾病和代谢性疾病(糖尿病和肥胖症)开辟新的途径[5-6]。
本文总结了外源性营养物质、肠道微生物群和有关肠-脑轴研究的现状,讨论了肠道微生物群与大脑相互作用的潜在机制,旨在为开发针对肠道微生物群的精准营养调控措施来预防或减轻相关疾病和保护肠道健康提供参考。
1 肠道微生物群-肠-脑轴的双向交流
肠道微生物群和大脑之间有许多潜在的沟通途径,从复杂和可调节的神经元途径,到微妙和难以测量的小分子信息系统,虽然肠道微生物群-肠-脑轴双向交流的具体机制还不完全清楚,但主要与以下几个途径相关。
1.1 神经途径
1.1.1 自主神经系统(autonomic nervous system,ANS)
ANS由交感神经系统、副交感神经系统和ENS组成,结合来自ENS和中枢神经系统(central nervous system,CNS)的调节,ANS负责维持宿主的生理稳态,以及对内分泌、运动、血压和行为区域的调节。ANS与神经元和神经内分泌信号相结合,可诱导肠道中CNS调节的变化[7]。ANS会影响ENS神经回路,改变抗性淀粉等营养物质的传递速率,从而影响益生元和益生菌在小肠和结肠的分布[8]。ANS活动可直接或者间接影响微生物群相互作用。微生物可以通过代谢物相互交流,在肠道通透性增强的情况下(如在炎症或应激期间),微生物信号分子可以直接与传入神经末梢相互作用[9]。细菌已被证明产生和消耗多种哺乳动物神经递质,包括多巴胺、去甲肾上腺素、5-羟色胺(5-hydroxytryptamine,5-HT)或γ-氨基丁酸(γ-aminobutyric acid,GABA)[10]。另外,有研究表明,肠道自主神经携带的感觉信息可以在胃肠道微生物代谢产物刺激下直接向大脑发送信号[11]。
1.1.2 ENS
ENS由2个神经节丛组成,即黏膜下丛和肌间丛,其在调节包括运动和液体分泌在内的许多胃肠功能中起着重要作用。ENS异常不仅与胃肠道疾病有关,还与中枢神经系统疾病有关,如阿尔茨海默病和帕金森病[12]。在肠道与大脑的双向交流中,ENS能直接或间接地对微生物群及其代谢物作出反应,并可直接与其支配的迷走神经和脊髓传入神经相互作用,产生的局部信号可通过感觉神经回路传递到相应的大脑区域;反过来,迷走神经和脊髓传入神经会传递信号至肠黏膜,直接或间接影响胃肠稳态[13],特别是新出现的证据表明,微生物群的特定成员有能力合成和调节各种已知调节神经传递的神经化学物质,以及可能直接或间接影响神经元活动的其他代谢物的大量环境。微生物群还可以通过激活模式识别受体的方式来影响ENS的发育和功能,如Toll样受体(Toll like receptor,TLR),特别是参与微生物分子识别的TLR2和TLR4,TLR2能促进由肠道细菌调节的结肠神经再生,且结肠微生物群通过特定的信号通路帮助维持ENS[14];而TLR4可以在高脂饮食中诱导神经变性[15]。
1.1.3 神经内分泌系统
下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴是主要的神经内分泌系统,也是肠道微生物群-肠-脑轴内互作的重要途径之一。在神经系统内,HPA轴激活后产生的皮质醇能影响肠道的通透性,也可以通过激活ENS的神经元,改变肠道环境和肠道微生物群的组成[16]。在肠道内,宿主和微生物相互作用会影响神经和免疫信号分子的释放,这些物质会影响神经内分泌和免疫系统,通过ENS和交感神经的信号传导,影响代谢途径,从而影响大脑的功能[17]。
另外,肠内分泌细胞(enteroendocrine cell,EEC)对维持肠道内环境稳定至关重要,能分泌一系列胃肠激素参与代谢调节,如胰高血糖素样肽-1是肠内分泌L细胞响应进餐分泌的一种促胰岛素激素,在血糖控制中起关键作用;它调节胰岛素和胰高血糖素分泌物、胃排空、食物摄入和血流量[18]。胰高血糖素样肽-1能局部结合其受体,通过旁分泌作用模式,由ENS和迷走神经,激活肠-脑-外周轴。肠道微生物可以调节EEC分泌胰高血糖素样肽-1和肽YY等神经肽,它们可以直接作用于下丘脑中枢,或通过迷走神经-脑干-下丘脑通路间接作用[19]。通过蛋白质组学分析发现,神经肽参与食物摄入、昼夜节律和记忆的调节[20]。
目前,研究较多的肠道微生物代谢物是SCFA,SCFA能通过多种局部效应改善肠道健康[21],包括维持肠道屏障的完整性、黏液生成和防止炎症等。此外,SCFA可以调节神经营养因子(神经生长因子、脑源性神经营养因子和胶质细胞源性神经营养因子)或神经递质合成(谷氨酸、谷氨酰胺和GABA),从而调节CNS中神经元和突触的生长、存活和分化[22-23]。且SCFA是位于CNS的组织巨噬细胞——小胶质细胞功能和成熟的重要因素,研究表明,SCFA可促进组蛋白乙酰化,且高浓度SCFA可抑制小胶质细胞增殖并促进其活化[24],因此肠道微生物能对CNS产生影响。SCFA诱导的迷走神经信号能激活CNS中的各种神经元[25],通过直接相互作用影响大脑生理活动[26]。
1.2 免疫通讯
肠道微生物群与肠道免疫系统之间有着密切的关系。肠道微生物与局部免疫细胞相互作用,可引起胃肠道功能的变化,如改变进入体循环的细胞因子的释放。除了激活先天免疫系统,许多肠道微生物代谢产物包括神经调节剂、细菌素、胆汁酸、胆碱和SCFA都具有免疫调节作用[27],如SCFA可以介导免疫细胞的分化和激活,如细胞因子、树突状细胞、巨噬细胞和T细胞[28],肠道微生物群与宿主相互作用会导致细胞因子、趋化因子、神经递质、神经肽及内分泌信使的释放,这些物质可以渗透到血液和淋巴系统,或影响迷走神经和脊髓传入神经元携带的神经信息,从而与大脑沟通,更新健康状态,并有可能以此调节大脑和行为[29]。
2 营养物质通过肠道微生物群-肠-脑轴调节肠道生理
外源性营养物质在肠道生态系统的微生物多样性产生、成熟和保护中发挥着重要作用,如今已被证明外源性营养物质是调节肠道微生物群组成,进而调节大脑和行为的关键因素之一[30]。不同的饮食来源能显著影响肠道微生物群的组成,从而影响肠-脑轴的反应和功能。微生物-大脑通信的多种机制已经被提出,其中一些机制容易受到营养物质调节,部分机制见图1[31-32]。
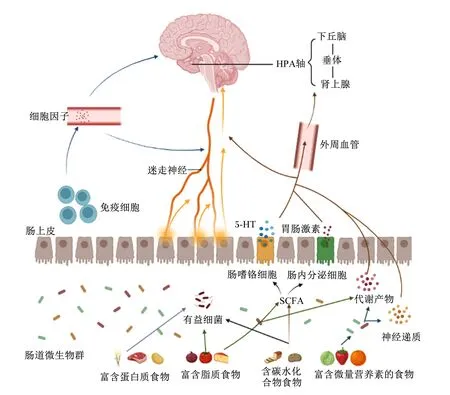
5-HT:5-羟色胺 5-hydroxytryptamine;SCFA:短链脂肪酸 short-chain fatty acid;HPA:下丘脑-垂体-肾上腺 hypothalamic-pituitary-adrenal。
2.1 常量营养素
肠道微生物参与未消化的常量营养素的消化、吸收、代谢和转化,为宿主提取有益的生物活性化合物。由于微生物群的特殊功能,每种常量营养素都以不同的方式影响微生物的分布。特定微生物选择性依靠常量营养素繁衍生息,从而增加其丰度。
2.1.1 碳水化合物
碳水化合物是动物和人体的主要能量来源,在调节和塑造肠道微生物群方面发挥着重要作用,不能被消化道消化的植物源碳水化合物被归类为膳食纤维,例如果胶、低聚果糖和低聚半乳糖等。纤维的不同化学性质(例如聚合、溶解性和黏度)决定了胃肠道内代谢的位置,从而导致特定的微生物变化,以响应其摄入。例如,给予大鼠高胆固醇饮食,含低分子量的大麦β-葡聚糖可影响盲肠中双歧杆菌的数量,而中等分子量的大麦β-葡聚糖减少了盲肠中的拟杆菌属/普氏菌属的比例和乳酸杆菌的数量[33]。除了改变微生物组成外,膳食纤维能结合并调节营养物质和胆汁酸的吸收与代谢,并且不同的膳食纤维能影响微生物酶活性和代谢物的类型和浓度[34]。膳食纤维干预导致双歧杆菌丰度更高,果聚糖和低聚半乳糖导致双歧杆菌属和乳酸杆菌属的丰度显著提高,产生SCFA,即醋酸盐、丙酸盐和丁酸盐[35]。其中,特别是丁酸酯,与胃肠道(结肠细胞的主要能量来源,支持肠道屏障功能)和代谢(葡萄糖内稳态,脂质氧化)健康有关,具有抗炎和免疫调节特性,并可影响中枢功能[36]。因此,在饲粮中添加膳食纤维有利于肠道结构完整以及肠道功能的改善,进而提升营养物质的利用率,促进仔猪生长[37]。研究表明,SCFA对大脑功能的潜在影响可能有助于某些神经系统疾病的症状学[38]。例如,在动物试验中,丙酸盐可诱发自闭症样行为[39]。
除此之外,4种不同的结肠拟杆菌门成员(包括肠道拟杆菌门)在复合阿拉伯木聚糖上的生长导致阿魏酸的积累,而阿魏酸是一种已知具有抗氧化和免疫调节特性的化合物[40]。研究表明,阿魏酸抑制猪细小病毒在PK-15细胞中的增殖,降低猪细小病毒感染细胞激活炎症因子的表达水平,具有较好的抗炎和抗病毒活性[41]。阿魏酸还可以通过调节磷酸化糖原合成酶激酶-3和抑制促凋亡蛋白如半胱天冬酶的表达来发挥神经保护作用,对阿尔茨海默病等神经退行性疾病具有一定的治疗作用[42]。
2.1.2 脂质
虽然总膳食脂肪中只有很小一部分(<5%)能到达结肠[43],但食物中的脂质对微生物分布有显著影响。脂肪酸不同的饱和度对微生物组成有不同的影响。例如,在人类营养干预中,多不饱和脂肪酸促进有益细菌的生长,包括乳酸杆菌、乳酸菌、罗氏菌属和双歧杆菌[44]。饱和脂肪饮食通过促进宿主胆汁成分的变化而改变了肠道微生物的组成,抑制SCFA的产生,并增加了到达结肠的胆汁酸,胆汁酸被微生物去羟基化后,会生成致癌的次级胆汁酸[45]。另外,动物研究结果表明,一方面,中链脂肪酸增加了溶组织梭菌、双歧杆菌、乳杆菌、拟杆菌和大肠杆菌的丰度;另一方面,长链脂肪酸会改变动物模型中梭状芽孢杆菌、粪球菌、链球菌、乳球菌和类杆菌的丰度[46]。
2.1.3 蛋白质
膳食蛋白质的来源和浓度是影响肠道微生物组成、结构和功能的主要因素。在小鼠模型中,动物蛋白质会提高潜在的有害肠道微生物的丰度,例如消化链球菌属、肠球菌属、链球菌属和埃希氏菌属[47];植物蛋白质能提高双歧杆菌、毛螺旋菌和乳酸杆菌的丰度,降低脆弱类杆菌和产气荚膜梭菌等病原体的丰度[48]。植物蛋白质的低消化率经常被认为是植物蛋白质和动物蛋白质之间差异的原因[49]。动物蛋白质的不同来源与特定细菌相对丰度的显著变化有关。例如,使用大鼠体外研究表明,鸡蛋清蛋白可以提高阿克曼氏菌、放线菌、双歧杆菌和类杆菌的丰度;喂食鸭蛋清蛋白的大鼠,变形菌和消化链球菌科的丰度明显较高,而拉克氏球菌科的丰度较低[50]。此外,不同的蛋白质摄入量对微生物丰度有不同的影响。在成年猪模型中,饲粮中蛋白质水平的降低导致回肠细菌丰富度和梭状芽孢杆菌丰度降低,而大肠杆菌和志贺菌氏丰度提高,适度蛋白质限制与消化链球菌科丰度的升高有关[51]。
2.2 微量营养素
2.2.1 维生素和微量矿物元素
维生素和矿物质是神经递质合成与代谢的重要辅助因子[52]。众所周知,肠道微生物群可以合成B族维生素、维生素C和K族维生素,维生素也可被非维生素产生菌(如粪杆菌属)利用,调节肠道微生物群。微生物群组成和维生素含量密切相关,如缺乏维生素D小鼠的肠道菌群多样性会降低,厚壁菌门增多,疣微菌门和拟杆菌门减少[53]。维生素可调节肠道氧化还原平衡,维生素A、维生素C、维生素E等具有抗氧化作用,有利于肠道厌氧菌的生存。维生素还可以直接作用到肠道免疫系统和肠屏障,如维生素A可以提高感染流行性腹泻病毒母猪血清中免疫球蛋白A抗体含量并通过泌乳提升仔猪免疫能力[54],或者影响肠道微生物,进而通过改变微生物代谢物来影响肠道免疫和肠屏障[55]。
与维生素类似,微量矿物元素以共生关系与肠道微生物群积极互动。铁对肠道微生物群有显著影响,细菌及其产物脂多糖可刺激常规树突细胞产生铁调素,铁调素作用于表达铁转运蛋白的肠道吞噬细胞,限制其释放铁,降低肠腔内的铁含量,从而调节肠道菌群,增加帮助肠屏障修复的双歧杆菌数量,促进肠黏膜愈合[56]。另外,在饲粮中添加适宜剂量的铁,能够提升育肥期猪的生长性能,改变直肠菌群结构,通过代谢组学分析,直肠差异代谢物富集到了氨基酸代谢通路和SCFA代谢通路上[57]。
2.2.2 多酚类
富含多酚的食物包括水果、蔬菜、草药和谷物等,90%~95%的多酚没有被小肠吸收,可以到达结肠。多酚类物质的摄入有许多益处,如抗癌、抗氧化和抗炎等。例如,白藜芦醇可以抑制大肠杆菌的增殖,减轻热应激对肉鸡的影响[58]。多酚类物质可改变肠道菌群的组成和功能,增加丁酸盐产生菌及乳杆菌属和双歧杆菌属等益生菌,并减少致病菌(如产气荚膜梭菌和溶组织梭菌)[59]。茶多酚能调节高脂诱导肠道损伤小鼠肠道中阿克曼菌乳杆菌、双歧杆菌和乳杆菌等的相对丰度,通过上调肠道紧密连接蛋白表达水平,改善肠道上皮组织的结构损伤,并进一步抑制TLR4/髓样分化因子88(myeloid differentiation factor 88,MyD88)和核因子-κB(nuclear factor-κB,NF-κB)/核因子-κB抑制因子α(nuclear factor-κB inhibitor α,IκBα)信号通路的激活,降低炎症水平[60]。多酚还可提高SCFA(尤其是丁酸盐)的水平,减少微生物产生的次级胆汁酸及毒素,抑制微生物群对上皮的侵袭[61]。肠道微生物群可将多酚代谢为可吸收的代谢产物,以发挥抗癌(诱导细胞凋亡、抗增殖)、抗炎症(减少炎症因子、降低丝裂原活化蛋白激酶的活性)和保护肠道屏障功能等作用。
3 营养物质对肠-脑轴的作用机制探讨
肠道-大脑沟通的机制容易受到营养物质调节。营养物质可以通过多种机制调节肠道与大脑之间的沟通,包括微生物衍生的代谢产物、激素、免疫、代谢和神经元途径。健康的饮食摄入(如膳食纤维、多酚等)可以促进有益微生物的生长。这些微生物可以刺激生物活性代谢物、神经递质(如5-HT)和肠道激素的产生,这些物质可以通过直接或间接的信号途径影响大脑和行为。
3.1 微生物代谢物途径
3.1.1 SCFA
由于微生物代谢未消化食物的能力,产生的代谢物是饮食-微生物群-大脑三角的关键介质。代谢物影响宿主脑功能和行为的各种机制已经被描述[62]。SCFA是膳食纤维的微生物代谢产物,主要通过下调炎症细胞因子分泌调节肠上皮细胞的紧密连接和完整性,促进肠道健康。研究表明,SCFA能够改善肠道屏障功能,丁酸通过促进肠道巨噬细胞M2极化,经Wnt-细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)1/2轴,恢复肠上皮杯状细胞的数量和功能,从而促进结肠炎中的肠道黏液屏障的修复[63]。SCFA可与G蛋白偶联受体或组蛋白去乙酰酶相互作用来影响心理功能[64],并经体液、激素、免疫和神经途径,直接或间接地作用于大脑[65]。
3.1.2 色氨酸代谢产物
色氨酸代谢产物,特别是5-HT、犬尿酸和吲哚衍生物,受到肠道微生物群的密切调节[66]。虽然肠道产生的5-HT不太可能对大脑产生直接影响,因为它不能穿透血脑屏障,但刺激迷走神经传入和调节免疫反应可能是潜在的信号通路。
色氨酸在体内除参与产生新蛋白和5-HT外,还可通过吲哚胺-2,3-二氧化酶介导的犬尿氨酸通路被代谢[67]。犬尿氨酸可以穿过血脑屏障,进一步代谢为犬尿酸和喹啉酸等。喹啉酸会促进神经退行性变;犬尿酸可通过芳烃受体的激活和提高氧化磷酸化水平,促进肠道上皮细胞的存活和增殖,降低结肠炎的严重程度[68]。
吲哚衍生物通过与电压门控钾通道和线粒体脱氢酶相互作用从L细胞分泌胰高血糖素样肽-1,通过激活芳烃受体合成犬尿氨酸。吲哚-3-丙酸显著降低小胶质细胞中促炎因子肿瘤坏死因子-α(TNF-α)浓度,使神经元细胞的脑源性神经营养因子和神经生长因子增加,具有神经保护作用[69]。
3.1.3 其他微生物代谢物
其他微生物代谢物也被发现介导肠脑沟通。研究表明,胆汁酸可以穿过血脑屏障,作为信号分子,通过与胆汁酸受体(如法尼醇X受体)结合或G蛋白偶联受体5结合来向中枢神经系统途径发出信号[70]。胆汁酸是肠上皮屏障功能的重要调控物质。研究表明,胆汁酸通过G蛋白偶联受体5激活SRC/YAP和下游靶标基因调控肠道干细胞的更新和分化来对肠上皮进行修复和再生[71]。
3.2 免疫途径
免疫系统已成为肠道微生物群和心理健康之间的关键联系,营养物质可能是这种相互关系的关键调节因素[72]。饮食调控的微生物代谢物通过宿主受体信号改变免疫反应,SCFA可以激活多个G蛋白偶联受体,其中游离脂肪酸受体2和3在结肠和各种免疫细胞中均有表达[73]。饮食改变微生物组的组成和活性,从而调节免疫反应[74]。饮食能改变具有免疫调节功能的菌群的适应性,菌群改变宿主对具有免疫调节功能的饮食组分的吸收和代谢。另外,ENS与免疫细胞密切相关,能持续监测和调节肠道稳态和功能[75],脑-肠轴功能与肠道炎症性疾病、营养物质吸收与代谢密切相关[76],当肠黏膜受损或肠道炎症刺激时,ENS使脊髓后角神经元兴奋性增强,再由胃肠道神经内分泌与CNS整合处理信息,以调节胃肠道消化、吸收和排泄等生理功能[77]。
3.3 激素途径
肠道微生物群影响宿主激素的各种机制,包括通过微生物的直接产生,以及通过代谢物或微生物成分调节EEC的间接分泌[78]。EEC与肠道中的营养相关信号协调,并释放不同的肠道激素,然后向CNS发送信号,下丘脑表达多种营养传感器和激素受体,并直接接收循环营养和激素信号。胃肠激素不仅在食欲和食物摄入的中枢调节中起作用,还与不同的大脑疾病有关,如焦虑和抑郁[79]。在动物和人类研究中,高度发酵的益生元影响了微生物群,引起高血糖素样肽-1和肽YY的变化,并导致食欲变化,为肠道内分泌功能参与营养物质与肠道微生物群-肠-脑轴相互作用提供了一些初步证据[80]。
3.4 其他途径
营养干预已被证明能使HPA轴活动正常化。对宿主营养干预,增加饮食中的碳水化合物可降低皮质醇水平[81]。SCFA调节HPA轴活性并减弱皮质醇对急性应激源的反应,这表明可能膳食纤维的微生物代谢参与了HPA轴的调节[82]。
除此之外,胰岛素也与大脑功能有关,胰岛素信号转导减少与神经退行性疾病的发病机制之间存在关联[83]。微生物群组成与外周和中枢胰岛素敏感性之间存在直接联系[84],高脂饮食能改变微生物群组成,促进代谢变化(包括胰岛素抵抗和葡萄糖稳态)[85]。
4 小 结
越来越多的研究表明了外源性营养物质对微生物群的影响以及微生物群在大脑功能和行为中的关键作用。虽然临床前研究已经开始阐明外源性营养物质-微生物群-大脑的相互作用,但大多数研究都集中在使用动物模型研究高脂肪、高糖或高热量饮食对微生物群-大脑的有害影响,还需要进行更多的试验来进一步揭示饮食中的特定成分影响肠道微生物群进而影响大脑功能的途径和作用机制,通过了解外源性营养物质对肠道和大脑功能的影响,进而为其在动物和人类疾病预防和治疗方面的研究与应用提供参考。

