硒对奶牛热应激的缓解及其作用机制研究进展
李 潇 胡亚鹏 程建波 卓 钊
(安徽农业大学动物科技学院,合肥 230036)
随着全球气候变暖趋势的发展,以及奶牛产奶量的日益提高,夏季热应激发生的强度和频率不断增加,高温环境对奶牛健康和奶业生产造成的影响也更加严重。泌乳奶牛的热负荷会随着产奶相关的代谢产热增加和炎热条件下机体散热能力变差而显著增加,这种热量增加又进一步影响了高产奶牛在热应激条件下维持体温恒定的能力[1]。因此,越是高产的奶牛,对热应激也就越敏感,热应激直接造成的奶牛经济效益损失,始终是生产中面临的一个重大问题。
硒(selenium,Se)是动物体必需的微量元素之一,在动物的生长发育、繁殖、免疫等方面都具有重要的作用。目前畜禽饲粮中添加的硒主要有无机硒、有机硒和纳米硒3种形式。研究表明,饲粮中添加硒能有效提高奶牛的产奶量和机体的抗氧化能力,对奶牛夏季热应激的缓解具有积极的作用[2]。本文以近几年的研究为基础,综述了热应激对奶牛的危害及其防治措施、饲粮添加硒对奶牛的影响及其对热应激的缓解,以及硒缓解热应激可能的作用机制,旨在为奶牛热应激的防治以及硒产品的合理使用提供参考。
1 热应激对奶牛的危害及其防治措施
热应激是指高温、高湿的外界环境超过了动物生理承受范围,机体不能通过代谢和散热来维持体温恒定,在引起动物体温升高的同时,诱发机体产生一系列非特异性生理反应[3]。奶牛对高温敏感,热应激条件下,奶牛出现体温升高、呼吸加快、躺卧时间缩短及站立时间延长等行为变化,为了降低代谢产热,还会减少瘤胃蠕动、降低采食量,引起机体营养物质吸收利用率下降、内分泌代谢紊乱,从而导致产奶量显著下降等一系列问题[4]。生产中对奶牛热应激的评定,一般采用温湿指数(temperature-humidity index,THI)作为判定指标,THI在72~79被认为会引起轻度热应激,THI在79~89被认为会引起中度热应激,THI超过89则会引起严重热应激[5]。Ranjitkar等[6]研究表明,即使在中国北方,6、7、8月份的THI仍然高于生产阈值,奶牛面临着热应激风险。2008—2016年的生产数据显示,基于THI计算的奶牛产奶量损失在2016年7月每天是0.7~4 kg,预计2050年因为热应激损失的产奶量将达到每天1.5~6.5 kg,2070年将达到每天2~7.2 kg[6]。
热应激除了直接降低奶牛的产奶量外,还会对乳成分造成影响,降低乳中乳蛋白、乳脂和乳糖含量,导致奶牛出现“乳蛋白降低症”[7]。此外,热应激还会诱导奶牛机体产生大量自由基和过氧化物,激发机体炎症反应,进而影响机体的抗氧化能力和免疫能力[8]。热应激降低了奶牛血液中葡萄糖和胰岛素的含量以及谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)的活性,同时增加了非酯化脂肪酸(nonestesterified fatty acid,NEFA)和丙二醛(malondialdehyde,MDA)的含量[9]。热应激条件下奶牛还易发生各种炎症反应,导致白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症因子及白细胞介素-10(interleukin-10,IL-10)等抗炎因子含量增高,引起奶牛乳房炎的发生,从而进一步导致产奶量和乳品质的降低[10-12]。
生产中对于热应激的防治,一般采用遮荫、喷淋、通风等物理性降温措施,降低牛群所处环境温度、提高体表水分蒸发,从而缓解热应激对奶牛的危害[13]。但如喷淋等物理性降温措施会导致牛舍湿度的上升,引起病毒、细菌的滋生,会导致奶牛乳房炎、肢蹄病的产生;此外,物理性降温措施涉及到环境的改变,在实施过程中可能需要更多的人力和物力投入。除了物理降温,加强营养调控也是缓解奶牛热应激的有效措施,如增加饲粮营养密度,补充矿物质、维生素、过瘤胃氨基酸等养分,添加植物提取物、中草药成分等[14-15]。营养调控缓解热应激是当前研究的热点,但也存在应用效果不统一、机制了解不够深入等问题,有待进一步的研究。
2 饲粮添加硒对奶牛的影响及其对热应激的缓解
近年来,硒在奶牛生产中的应用研究逐渐增多,饲粮添加硒会对奶牛的生产性能和血液生化指标等产生影响。Sun等[16]研究发现,饲粮中随着羟基硒蛋氨酸(hydroxy-analogue of selenomethionine,HMSeBA)添加量的升高,牛奶和血浆中总硒浓度呈线性增加,牛奶中乳脂率和总固形物含量升高,乳脂产量和能量校正乳产量增加;王建[17]研究表明,不同添加水平的HMSeBA(0.1、0.3、0.5 mg/kg,以硒计)对奶牛产奶量和乳成分无显著影响,但乳脂率随HMSeBA添加水平的提高呈线性增加趋势,且HMSeBA的添加效果优于亚硒酸钠(sodium selenite,Na2SeO3);而Sun等[18]认为饲喂酵母硒的奶牛比饲喂Na2SeO3的奶牛产奶量更高,而乳脂率则是饲喂Na2SeO3的奶牛更高;Séboussi等[19]向奶牛青贮料中添加不同形式的硒后,饲喂酵母硒的奶牛比饲喂Na2SeO3的奶牛有更高的乳蛋白率。此外,研究还发现摄入0.3 mg/kg Na2SeO3对奶牛血清抗氧化指标无明显改善作用,而摄入同等硒含量的HMSeBA却可显著提高血清GPx、超氧化物歧化酶(superoxide dismutase,SOD)、硫氧还蛋白还原酶1(thioredoxin reductase 1,TrxR1)的活性,同时降低MDA的含量[16-17]。这些研究结果表明,硒的添加形式和剂量与奶牛生产性能和抗氧化能力密切相关,相较于无机硒,有机硒的作用效果更好。
缺硒也会对奶牛造成严重的影响。曹宇等[20]研究了缺硒对集约化牧场泌乳奶牛的影响,发现缺硒会导致奶牛血清GPx活性显著降低,总一氧化氮合成酶(total nitric oxide synthases,T-NOS)活性以及MDA和过氧化脂质(lipid peroxides,LPO)含量显著升高,IL-1β、IL-6、TNF-α的含量显著降低。研究显示,补充硒可以提高奶牛血清GPx、硫氧还蛋白还原酶(thioredoxin reductase,TrxR)、过氧化氢酶(catalase enzymes,CAT)、SOD的活性与总抗氧化能力(total antioxidant capacity,T-AOC),并降低活性氧(reactive oxygen species,ROS)、活性氮(reactive nitrogen species,RNS)、MDA的含量,从而缓解机体的氧化应激[21]。因此,硒对于维持奶牛机体正常的免疫功能和抗氧化功能具有十分重要的作用,缺硒会严重影响奶牛的健康状况。
此外,生产中利用硒来缓解热应激对奶牛的影响也有相关报道。曹铮[22]研究了富硒女贞子饲喂热应激奶牛的效果,发现与普通女贞子相比,富硒女贞子能显著改善因热应激导致的奶牛产奶量下降,降低血清促肾上腺皮质激素和皮质醇水平,提高白细胞介素-2(interleukin-2,IL-2)、白细胞介素-4(interleukin-4,IL-4)、IL-6、干扰素-γ(interferon-γ,IFN-γ)的分泌水平;Sun等[18]研究表明,在热应激条件下,不同硒源对奶牛的直肠温度、呼吸频率、干物质采食量没有显著影响,但与添加Na2SeO3相比,添加同等硒含量的HMSeBA可以增加产奶量,提高血清T-AOC,降低血清MDA、过氧化氢(hydrogen peroxide,H2O2)和一氧化氮(nitric oxide,NO)含量。王尚[23]的研究结果表明,酵母硒可以显著降低热应激奶牛的呼吸频率和直肠温度,显著降低乳体细胞数(somatic cell count,SCC),提高乳硒含量,显著提高血清中GPx活性与T-AOC,显著降低血清皮质醇、MDA含量,从而增强机体的抗氧化能力和免疫能力。因此,饲粮中添加硒,特别是有机硒,是有效缓解奶牛热应激的一种营养调控方案。
3 硒缓解奶牛热应激作用机制的探讨
热应激会影响机体的抗氧化系统,诱导自由基的大量产生,打破机体氧化/抗氧化平衡状态,从而引起氧化应激[24];机体氧化应激水平的增加又会加速细胞炎症进程,引发多种炎症反应[25]。氧化应激促进炎症反应,炎症又通过炎症介质反过来加重氧化应激,造成机体免疫系统紊乱,形成恶性联动[26]。目前关于硒缓解热应激的潜在机制,包括调控胃肠道微生物影响养分的可消化性、改善机体抗氧化状态和免疫功能等[2]。本文主要从机体氧化应激-炎症反应-免疫功能三方联动反应的角度,结合已有研究,总结了硒调控热应激的可能机制,如图1所示。
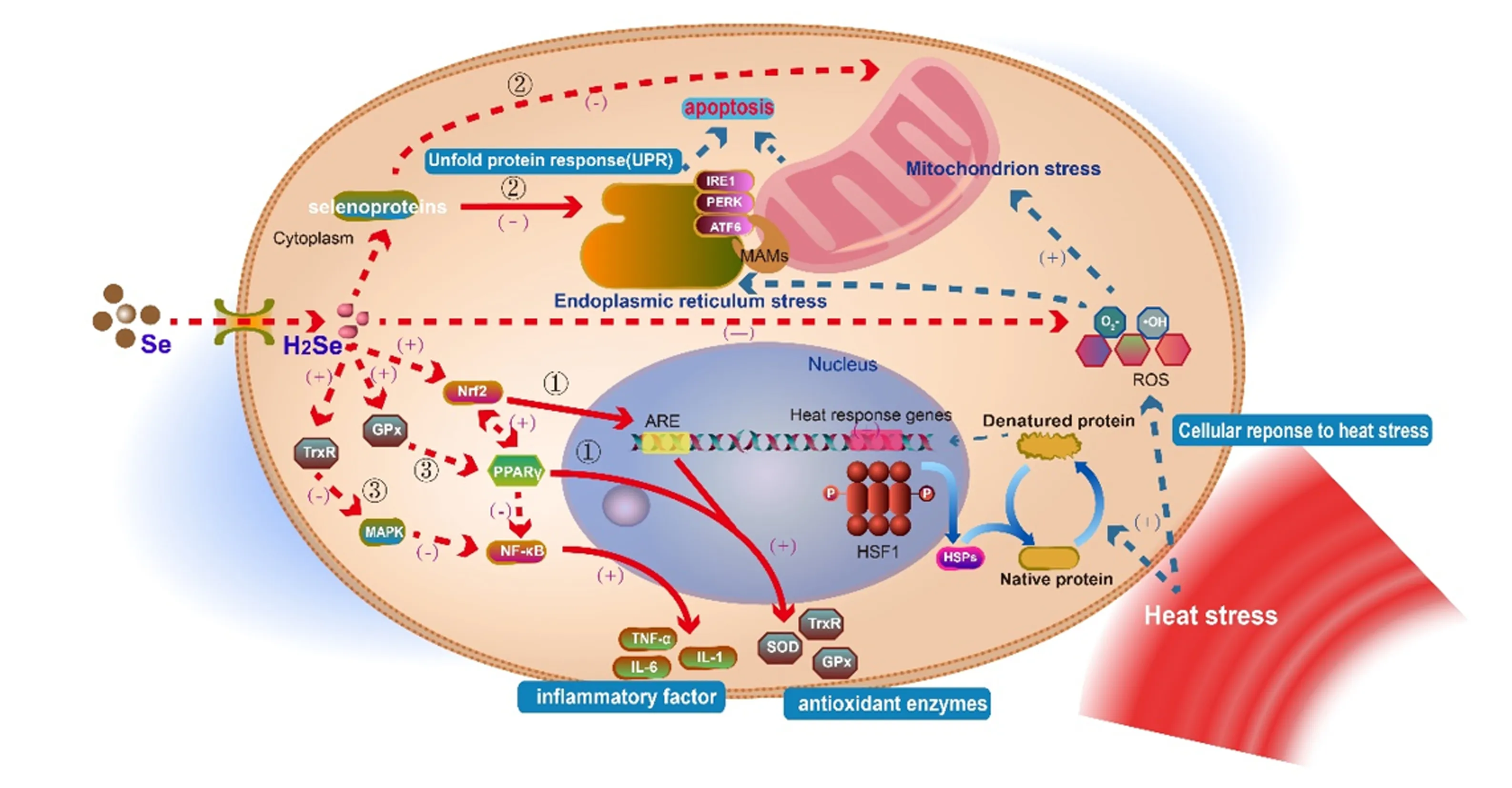
①:硒通过PPARγ/Nrf2-ARE信号通路促进抗氧化酶表达;②:硒通过内质网/线粒体应激途径抑制细胞凋亡;③:硒通过GPx-PPARγ-NF-κB和TrxR-MAPK-NF-κB信号通路降低炎性因子表达水平。(+)代表促进作用;(-)代表抑制作用。实线代表两者间存在确定调控关系;虚线代表两者间可能有其他中间调节环节。①: Se promotes the expression of antioxidant enzymes through the PPARγ/Nrf2-ARE signal pathway; ②: Se inhibits apoptosis through endoplasmic reticulum/mitochondrion stress pathway; ③: Se reduces the expression of inflammatory factors through the GPx-PPARγ-NF-κB signal pathway. (+) stands for promoting effect; (-) stands for inhibiting effect. The solid line represents that there is a definite regulatory relationship between the two; the dotted line indicates that there may be other intermediate adjustments between the two.
3.1 硒通过过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptor γ,PPARγ)/核因子E2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)-抗氧化反应元件(antioxidant response element,ARE)途径促进抗氧化酶表达,缓解热应激损伤
热应激引起的氧化应激及其后续反应,是造成热应激损伤最重要的原因之一。Nrf2是氧化应激过程中重要的转录因子,控制着GPx、TrxR、SOD等多种抗氧化相关基因的转录[27]。王建强[28]以2、4、8 μmol/L的硒代蛋氨酸(selenomethionine,Se-Met)与奶牛乳腺上皮细胞(bovine mammary epithelial cells,BMECs)共孵育,发现Se-Met通过调节Nrf2信号通路和硒蛋白基因的转录,增强GPx、CAT、SOD活性;Guo等[29]研究发现,硒可以激活Nrf2表达,从而上调TrxR等抗氧化酶的表达,增强BMECs的抗氧化功能。Nrf2和PPARγ之间可能通过核因子-κB(nuclear factor kappa-B,NF-κB)相互调控,添加硒可以显著增加BMECs内PPARγ和Nrf2的表达,而PPARγ可以促进谷胱甘肽过氧化物酶1(glutathione peroxidase 1,GPx1)、TrxR、CAT等抗氧化酶的表达[30]。此外,Nrf2与其下游因子ARE共同构成了重要的氧化应激通路Nrf2-ARE。GPx催化谷胱甘肽(glutathione,GSH)的还原,以维持细胞氧化还原状态,而合成GSH的转运载体——胱氨酸/谷氨酸逆向转运体xCT(overexpression of cystine/glutamate gntiporter xCT)和抗氧化硒蛋白TrxR1均受到Nrf2-ARE通路的调控[31]。因此,硒可以通过PPARγ/Nrf2-ARE信号通路,上调GPx、TrxR等抗氧化酶的表达,增强机体对氧化应激的抵抗力,缓解热应激引起的氧化损伤。
3.2 硒通过内质网(endoplasmic reticulum,ER)/线粒体途径抑制热应激造成的细胞凋亡
热应激引起细胞的氧化应激,进一步导致内质网应激和线粒体损伤,是引发细胞凋亡最常见的途径。内质网是细胞内重要的细胞器,当生理或病理条件发生改变时,引起未折叠蛋白或错误折叠蛋白在内质网聚集,损伤内质网的正常生理功能,称为内质网应激。葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)和C/EBP环磷酸腺苷反应元件结合转录因子同源蛋白(C/EBP homologous protein,CHOP)表达的增加被认为是内质网应激的发生标志[32]。热应激会引起胞内蛋白质稳态紊乱,导致内质网应激;真核生物通过内质网应激对内质网功能障碍作出反应,激活未折叠蛋白反应(unfolded protein response,UPR),重新建立内质网稳态。
内质网中有多种硒蛋白定位:硒蛋白S(selenoprotein S,SelS)参与内质网相关蛋白降解(endoplasmic reticulum-associated degradation,ERAD)拮抗内质网应激,当内质网应激发生时,SelS表达上调[33];硒蛋白K可以保护内质网应激诱导的细胞凋亡[34];此外,硒蛋白M、T、W、O等同样参与了内质网稳态的维持、氧化还原平衡、内质网应激反应信号通路等[35]。硒缺乏可能通过氧化应激途径使钙稳态失衡,导致内质网肿胀、粗面内质网减少,上调相关因子GRP78、转录因子4(activating transcription factor 4,ATF4)、CHOP的mRNA表达水平,介导内质网应激的发生[36]。补硒使GRP78和CHOP的表达降低,缓解内质网应激,而高浓度的硒则会诱发内质网应激[37]。内质网应激发生后,GRP78与内质网应激传感酶1(inositol-requiring enzyme 1,IRE1)、蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)和活化转录因子6(activating transcription factor 6,ATF6)复合体分离,这导致UPR的3条主要信号通路的激活。IRE1、PERK和ATF6分别再通过不同的机制激活NF-κB,产生TNF-α等炎性因子,进一步引发炎症反应[38]。在某些情况下,内质网应激还可以通过激活CHOP基因转录、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)通路以及半胱氨酸蛋白酶12(cysteinyl aspartate specific proteinase 12,Caspase12)级联反应3条途径诱导细胞凋亡的发生[39]。
持续的内质网应激会将应激信号通过线粒体相关膜(mitchondria associated endoplasmic reticulum membrane,MAMs)传递到线粒体,过度的内质网应激通过CHOP、JNK及其他信号通路的激活导致线粒体功能紊乱,引起线粒体应激并诱导细胞凋亡[40-41]。许多研究证实了硒对缓解线粒体应激的重要性:硒在体内转化的中间产物硒化氢(hydrogen selenide,H2Se),能抑制ROS介导的内质网应激与线粒体之间的相互作用(内质网应激-线粒体串扰凋亡信号通路),从而缓解细胞凋亡的发生[42-43]。王彩霞[44]研究表明,纳米硒可以激活肝脏、肾脏中的3-磷脂酰肌醇激酶(phosphatidylin-ositol-3-kinase,PIK3)-蛋白激酶B(protein kinase B,Akt)通路,抑制线粒体途径的细胞凋亡;另有研究表明,硒能抑制ROS介导的线粒体膜电位崩溃和细胞色素C释放,进而抑制半胱氨酸蛋白酶(cysteinyl aspartate specific proteinase,Caspase)激活,提高B细胞淋巴瘤-2相关X蛋白(B-cell lymphoma-2 associated X protein,Bax)的表达水平,降低B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)的表达水平,从而阻止线粒体介导的细胞凋亡[45]。
以上研究表明,内质网应激和线粒体应激在细胞凋亡过程中发挥着关键性的作用,硒及其相关化合物在调控内质网和线粒体功能方面具有重要作用,硒可以通过内质网/线粒体途径抑制热应激造成的细胞凋亡。
3.3 硒通过GPx-PPARγ-NF-κB和TrxR-丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)-NF-κB信号通路降低炎性因子表达水平
热应激还会引起细胞的炎症反应,而NF-κB是调节炎症/免疫反应的关键信号因子。研究发现,沉默NF-κB基因能降低诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)及TNF-α、IL-6、IL-1β等促炎因子的表达水平,从而减轻BMECs的炎症反应[46]。多项研究证实硒能抑制NF-κB信号通路活化,改善细胞炎症。例如,Se-Met抑制NF-κB信号通路激活,降低炎症因子TNF-α、IL-1β、白细胞介素-8(interleukin-8,IL-8)的表达水平,缓解金黄色葡萄球菌(S.aureus)感染BMECs引起的炎性损伤[28];Na2SeO3通过阻断巨噬细胞的NF-κB信号通路,降低TNF-α和IL-1β的表达,改善细胞炎症[47];硒抑制脂多糖(lipopolysaccharide,LPS)诱导的NF-κB核转录,降低NO及促炎因子的生成[48]。缺硒可能会导致NF-κB激活,致使TNF-α含量升高,GPx1活性降低,诱导炎症发生[49]。此外,NF-κB信号通路又受PPARγ调节,沉默GPx1会抑制PPARγ的基因表达,激活NF-κB信号通路,上调下游炎性因子的表达[50]。上述结果提示,硒可以通过GPx-PPARγ-NF-κB信号通路,降低炎症因子及iNOS的表达水平,减轻细胞炎症反应。
MAPK信号通路是一条关键的氧化还原调控通路,其激活可进一步诱导NF-κB的活化,促使IL-1β等炎症因子和NO等自由基的大量产生[51]。硒可以通过抑制关键蛋白的磷酸化来阻断MAPK和NF-κB信号通路活化,从而发挥抗炎功能[52]。孙珺[53]利用肽聚糖诱导BMECs炎症,发现硒通过抑制NF-κB和MAPK信号通路激活,减少炎性细胞因子TNF-α、IL-1β和IL-6的表达和释放;毕崇亮[54]通过建立S.aureus感染BMECs模型,证实硒通过调节核苷酸结合寡聚化结构域2(nucleotide-binding oligomerization domain 2,Nod2)、受体相互作用蛋白2(receptor interacting protein 2,RIP2)、JNK和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)等蛋白表达,调控Nod2/MAPK/mTOR信号通路,从而缓解细胞炎症反应。此外,TrxR作为一种硒蛋白酶,其表达也可以受硒的激活[55]。研究显示,在BMECs遭受氧化应激时,TrxR活性下降,导致MAPK通路激活[56];相反,当沉默TrxR基因时,MAPK家族成员p38丝裂原激活蛋白激酶(p38MAPK)、JNK和胞外信号调节激酶(extracellular regulated protein kinases,ERK)的活化程度得到增强,这提示TrxR活性下降会激活MAPK通路[57]。硒能够通过促进TrxR1基因和蛋白表达,抑制p38MAPK和JNK/MAPK信号通路的磷酸化水平,从而降低IL-1β和iNOS的基因及蛋白表达,抑制NO的过量释放[58]。这些研究表明,硒通过TrxR-MAPK-NF-κB信号通路,增强TrxR表达,抑制MAPK磷酸化,降低NF-κB活性,下调炎性因子的表达,从而发挥抗炎功能。
3.4 硒通过缓解氧化应激、炎症反应,调节机体免疫功能
当奶牛受到热应激时,会使体内自由基生成增加,大量自由基的产生也会激活机体的免疫系统,引起炎症反应,形成氧化应激与炎症反应的联动效应。正常情况下,机体可以通过抗氧化系统以及炎症反应的抗炎机制来缓解热应激造成的影响,但夏季长期的热应激条件会使自由基大量生成,超过机体的清除能力,过度的氧化应激加重炎症反应,而炎症反应通过炎性介质又能进一步促进氧化应激,损害机体的免疫功能,从而形成恶性循环[26]。
硒具有促进抗氧化酶表达的作用,可以缓解氧化应激。此外,硒还能通过TrxR-MAPK-NF-κB等信号通路降低炎性因子的表达水平。硒蛋白可以直接参与胞内信号通路调节,优化信号通路中免疫调节物质的基因表达,从而有助于修复免疫稳态[59]。此外,动物试验结果也表明,硒能够有效提高血清免疫球蛋白A(immunoglobulin A,IgA)、免疫球蛋白G(immunoglobulin G,IgG)的含量,增强机体的免疫功能[60-61]。Lanni等[62]向奶牛饲粮中添加0.45 mg/kg的Se-Met,发现乳中SCC明显降低;Séboussi等[19]向奶牛青贮料中添加硒后,同样发现乳中SCC显著减少,且酵母硒的效果优于Na2SeO3。SCC作为评估奶牛乳腺炎和乳品质的重要指标,可以反映奶牛机体的免疫状况,SCC的减少说明机体免疫系统功能得到改善。因此,硒在奶牛热应激防治中具有重要的作用,硒可以通过多种途径调节机体的免疫功能,维持免疫系统的健康。
4 小 结
综上所述,热应激会引起奶牛体温升高、呼吸加快、采食量下降等变化,导致产奶量和乳品质下降、机体氧化应激和炎症反应发生,严重影响奶牛的健康。饲粮添加硒可以缓解奶牛热应激,提高奶牛抗氧化能力和免疫能力,是一种有效缓解热应激的营养调控方案。硒可能通过多种途径发挥其缓解热应激的作用,包括通过PPARγ/Nrf2-ARE信号通路促进抗氧化酶的表达,通过内质网/线粒体应激途径抑制细胞凋亡,通过GPx-PPARγ-NF-κB和TrxR-MAPK-NF-κB信号通路降低炎性因子的表达水平,以及提高机体的免疫功能,从而维持机体氧化应激-炎症反应-免疫功能三方联动反应的平衡。然而,关于硒在热应激调控中的直接作用以及各种信号通路之间的相互联系仍有待进一步研究。

