电针对慢性肛门直肠痛模型大鼠痛觉敏化及脊髓胶质细胞的影响
曾禹沙,李婧婧,许新意,薛雅红
(1.南京中医药大学研究生院,江苏 南京 210023;2.南京中医药大学附属南京中医院,江苏 南京 210001)
慢性肛门直肠痛(Chronic anorectal pain,CAP)是非器质性疾病引起的肛门或直肠部位坠胀疼痛、刺痛等不适,属于功能性肛门直肠痛(Functional anorectal pain,FAP) 之一,根据罗马Ⅳ标准可细分为肛提肌综合征(Levalor ani syndrome,LAS) 和非特异性功能性肛门直肠痛(Unspecified functional anorectal pain,UFAP),临床上患病率高达7.7%,以女性多见[1]。CAP为肛肠科难治性疾病,目前发病机制尚不明确,近期相关研究显示可能与脊髓胶质细胞、促炎因子有关[2-5],但尚缺乏有关证据。临床发现CAP患者的疼痛可放射至阴道、骶尾部、会阴等区域,涉及整个骶神经支配区[6],临床可见顽固的CAP经各种治疗后疼痛仍持续存在或加重。推测引起慢性疼痛的原因很可能是支配肛门直肠的S2-4脊髓段继发病变,引起持续性神经牵涉痛。在治疗方面,近年来针刺八髎穴的研究是重点关注领域,相关临床研究已经证实针刺八髎穴能明显改善慢性肛门直肠痛的症状[7],但目前针刺八髎穴具体的治疗机制仍需进一步探索[8]。慢性肛门直肠痛虽不会对患者生命造成威胁,但疾病导致的痛苦往往会引起一系列异常的精神心理表现,Dong等[9]研究发现功能性肛门直肠痛患者普遍存在抑郁和焦虑症状,不仅损害患者健康,还严重影响患者生活质量。
本实验旨在通过建立CAP大鼠模型,观察大鼠S2-3脊髓背角中胶质细胞活化情况及电针八髎穴对其干预作用,探讨脊髓胶质细胞活化及相关炎症因子白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)的表达是否引起CAP并参与电针镇痛。
1 材料与方法
1.1 实验动物 18只6~7周龄SD大鼠,体重约200~225 g,购于杭州医学院,饲养于浙江省医学科学院动物中心[SYXK (浙) 2019-0011]。饲养期间各组大鼠正常饮水,喂养饲料。饲养中心的室温保持在(21±0.5)℃,湿度保持在45%~50%,光照保持12 h明暗交替。所有动物实验均得到了浙江百越生物技术有限公司实验动物伦理委员会的许可(伦理编号:ZJBYLA-IACUC-20220110),实验过程遵循了中国动物协会的指导方针。
1.2 实验药物与试剂 戊巴比妥钠(P010,Merck,德国)、辣椒素(SC8100,Solarbio,中国)、苏木-伊红染液(G1031,Servicebio,中国)、4%多聚甲醛(E672002,Sangon,中国)、0.2%苦味酸的磷酸盐缓冲液(pH 7.4,PML4280,Coolaber,中国)、5%山羊血清(E510009,Sangon,中国)、抗-IL-1β抗体(E-EL-R0012c,Elabscience,中国)、抗-TNF-α抗体(E-EL-R2856c,Elabscience,中国)、抗-IL-6 抗体(E-EL-R0015c,Elabscience,中国)、抗-GFAP 抗体 (GFAP,1∶10;ab4648,Abcam,英国)、Triton X-100(A600198,Sangon,中国)、抗-OX42 抗体 (1∶1000,GTX76060,46 kDa)、山羊抗兔二抗(Alexa Fluor® 647,ab150083,Abcam,英国)。
1.3 实验仪器 针灸针(0.35 mm×25 mm,华佗牌,中国)、电针仪(SDZ-Ⅱ,华佗牌,中国)、低温切片机(KD-2850,KEHUAI,中国)、激光共聚焦显微镜(BX53M,Olympus,日本,×40)、荧光显微镜(Ⅸ73,Olympus,日本,×200)、电子Von Frey 测痛仪(IITC,美国)、酶标仪(VL0000D2,Thermo Fisher,美国)。
1.4 实验方法 参考文献进行造模[10],18只大鼠根据体重被随机分为三组(n=6):正常组、模型组和电针组。具体操作方法为:使用戊巴比妥钠(剂量:45 mg/kg)麻醉大鼠后,将凡士林涂抹在肛门周围暴露的皮肤上,直径为1.5 mm的圆头细管通过肛门快速插入大鼠直肠,模型组及电针组注入0.5 ml辣椒素(浓度:10-4mmol/L),每间隔5 min注入1次,共注入4次,正常组注入等体积0.9%氯化钠溶液。电针组在造模完成且大鼠清醒2 h后予以针刺八髎穴干预。正常组和模型组大鼠不针刺,但需要经历抓取、固定过程。
针刺干预方法:大鼠只有三对骶后孔,相当于人体次髎、中髎和下髎穴[11-12]。根据骨性标志定位大鼠骶后孔的位置:首先将大鼠放入限制笼内,提起大鼠的尾根部,大拇指和中指捏起大鼠尾根处反复上下提放鼠尾,食指感觉到的能活动的关节即为第1尾椎和骶骨结合处;第1尾椎的棘突较尖,骶骨的棘突较长,沿尖棘突顺势向上越过2个较长棘突即是第2、3骶骨的棘突间隙,在此棘突间隙正中偏上处旁开5~10 mm处取次髎穴和中髎穴;第3、4骶骨棘突间隙正中偏上旁开5~10 mm处取下髎穴。针刺部位用碘伏消毒后,采用自制大鼠针刺固定器在其清醒状态下进行针刺。采用华佗牌0.35 mm×25 mm针灸针直刺,进针深度约为10~15 mm,双侧次、中髎和下髎穴接华佗牌电针仪SDZ-Ⅱ型的4个电极,刺激频率为2/15 Hz,疏密波,电流强度以见大鼠大腿内收内旋为度,电针时间为30 min/次,1次/d,连续治疗7 d。
1.5 观察指标
1.5.1 内脏疼痛行为学记录:观察并记录各组大鼠的内脏痛相关行为的数目,如背部出现弓形、舔腹、伸展、收缩腹部等动作[10],4次辣椒素注入完成且刺激20 min 后,7次电针刺激完成20 min后测量。
1.5.2 机械刺激阈值测量:将大鼠置于底部有金属丝网的透明有机玻璃盒中。使用电子Von Frey纤维系统研究大鼠尾部、后足底和腹部对机械刺激反应的变化[10]。Von Frey纤维刺激强度以2 g/s的恒定力(截止力50 g)升高。直到大鼠收回爪子、向后拱起或抬起尾巴,记录为机械痛阈。分别在4次辣椒素注入完成且刺激1 h后、7次电针刺激完成1 h后测量。
1.5.3 苏木素-伊红(HE)染色:机械刺激结束后,戊巴比妥钠(剂量45 mg/kg)麻醉大鼠,逐层开放胸腔,暴露心脏和血管,经左心室插管至升主动脉,用0.9%氯化钠溶液快速冲洗残留血液后灌注含有4%多聚甲醛和0.2%苦味酸的磷酸盐缓冲液固定40 min。收集大鼠直肠组织和S2-3脊髓组织,浸入30%蔗糖溶液中。用低温切片机将直肠组织制成30 μm的切片。使用苏木素染液染色10 min,蒸馏水洗去浮色。分化液分化3 min,自来水冲洗两次。将切片置于伊红染液中1 min,蒸馏水稍洗2 s后快速脱水。封片后放在显微镜下观察。
1.5.4 免疫荧光测定大鼠脊髓中标志物OX42和GFAP的荧光表达强度:将上述步骤所获脊髓组织用OCT包埋并利用低温切片机制成40 μm的冰冻切片。切片置于冷丙酮中固定15 min。将冰冻切片室温充分晾干,浸于4%多聚甲醛溶液固定15 min。用PBS漂洗切片5 min后吸出PBS。加入0.1%Triton X-100通透15 min后吸出Triton X-100溶液,用PBS漂洗切片5 min。5%山羊血清对切片上组织进行封闭处理1 h。胶质纤维酸性蛋白抗体(GFAP),稀释比例1∶10,CD11b单克隆抗体(OX42),稀释比例1∶100,孵育组织,4 ℃避光过夜。第2天用PBS漂洗组织3次,每次5 min。切片上加入山羊抗兔二抗,室温孵育1 h。用PBS漂洗组织3次,每次5 min。使用荧光显微镜观察阳性荧光信号(红色)。
1.5.5 ELISA吸附试验检测大鼠脊髓和血清中IL-1β、TNF-α和IL-6的含量:用IL-1β试剂盒、TNF-α试剂盒和IL-6试剂盒检测脊髓和血清,实验操作均按照试剂盒说明书进行。IL-1β、TNF-α和IL-6抗体被包被在ELISA检测板上,待测样品和标准品加入检测板并与抗体结合,随后将生物素化抗体、辣根过氧化物酶标记的抗生物素蛋白、显色底物和终止溶液依次加入反应板中。终止反应后使用酶标仪在450 nm波长下检测吸光度,并计算IL-1β、TNF-α和IL-6的含量。
1.6 统计学方法 采用Graphpad 8.0统计学软件进行分析。计量资料以平均值±标准差表示,组间比较使用单因素方差分析;P<0.05表示差异具有统计学意义。
2 结 果
2.1 各组大鼠的内脏痛行为次数比较 与正常组(21.83±1.34)相比,模型组大鼠内脏痛行为次数(39.83±1.77)明显增加(P<0.01);与模型组相比,电针组大鼠的内脏痛行为次数(30.33±0.94)减少,差异具有统计学意义(P<0.01)。
2.2 各组大鼠的机械疼痛阈值比较 见表1。与正常组相比,模型组大鼠尾部、后足底、腹部的机械痛阈值上升(P<0.01);与模型组相比,电针组大鼠尾部、后足底、腹部的机械痛阈值降低,差异具有统计学意义(P<0.01)。

表1 各组大鼠尾部、后足底和腹部机械痛阈值
2.3 各组大鼠直肠黏膜下组织HE染色结果比较 HE染色结果显示,正常组大鼠直肠黏膜下组织无水肿现象,模型组大鼠直肠黏膜下组织出现明显的水肿病变,电针组大鼠直肠黏膜下组织水肿较模型组明显减轻(图1)。
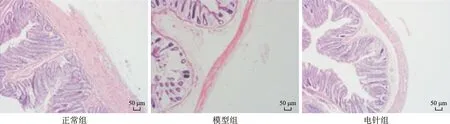
图1 各组大鼠直肠黏膜下组织病理学表现(HE染色,×40)
2.4 各组大鼠脊髓中小胶质细胞标志物OX42和星形胶质细胞标志物GFAP的表达程度比较 免疫荧光染色结果显示,与正常组相比,模型组大鼠脊髓中小胶质细胞标志物OX42和星形胶质细胞标志物GFAP的阳性表达显著增加(P<0.01);与模型组相比,电针组大鼠脊髓中标志物OX42和GFAP的阳性表达降低,差异具有统计学意义(P<0.05)。见表2(图2)。
2.5 各组大鼠脊髓及血清中IL-1β、TNF-α和IL-6水平比较 见表3、4。ELISA结果显示,与正常组相比,模型组大鼠脊髓和血清中IL-1β、TNF-α和IL-6水平上升,差异具有统计学意义(P<0.01);与模型组相比,电针组大鼠脊髓及血清中IL-1β、TNF-α和IL-6水平下降,差异具有统计学意义(P<0.05)。
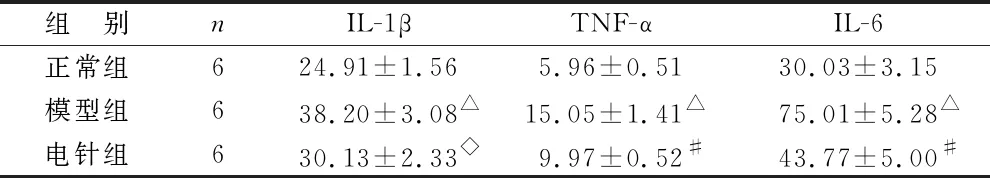
表4 各组大鼠血清中IL-1β、TNF-α和IL-6含量比较(pg/ml)
3 讨 论
本研究采用辣椒素构建CAP大鼠模型,与目前研究神经病理性疼痛的其他模型如福尔马林大鼠结肠炎模型[13]、球囊扩张IBS模型[14]、TNBS灌肠模型[15]等相比,直接通过圆头塑料管注入大鼠直肠,不易引起大鼠躯体疼痛,操作简单且具有良好可重复性;大鼠相关内脏痛反应出现在刺激后20 min内,1 h后基本消失,反应呈单相,耗时短;本模型大鼠直肠黏膜下组织仅表现为明显的水肿病变,无组织结构的破坏,更符合神经病理性疼痛的模型特点。
本研究中,测定机械痛阈的原理为测定大鼠在接受纤维丝刺激后产生缩脚或其他动作的反应时间,经辣椒素刺激后,大鼠表现出明显内脏痛行为,大鼠后足底、腹部及尾部对机械痛阈上升。此时机械痛阈上升是因辣椒素刺激产生的内脏疼痛远比纤维丝剧烈,内脏痛的神经冲动传导在向高级中枢传入过程中抑制了机械刺激所引起的神经冲动信号的传导,此结果与部分研究结果相同[16]。电针治疗后大鼠内脏疼痛减轻,内脏疼痛神经冲动传导中对机械疼痛神经冲动信号传导的抑制减弱,表现为机械疼痛敏感,机械痛阈值降低。
目前CAP发病机制尚不清,多认为是盆底肌过度活动影响中枢神经系统,引起中枢神经系统传出信号增加和改变导致的一种神经病理性疼痛[17]。近年来大量研究发现,此类疼痛是由神经元、胶质细胞及免疫炎症因子和趋化因子共同作用的结果[18]。李立等[19]研究发现神经病理性疼痛模型大鼠脊髓背角中 A1 型反应性星形胶质细胞明显增加。胶质细胞激活及其产生的炎症介质,使伤害性感觉神经元敏感导致疼痛慢性化,其中小胶质细胞参与了对行为和认知的有害后果[20]。本研究免疫荧光染色结果示CAP大鼠脊髓中小胶质细胞特异性标志物OX42和星形胶质细胞特异性标志物GFAP的阳性表达显著增加,表明CAP模型大鼠存在脊髓胶质细胞活化现象,可能引起神经元敏感,导致慢性疼痛发生及维持,成为CAP发病机制之一。此外,神经病理性疼痛可见促炎因子的产生[21]。促炎和抗炎细胞因子是强大的神经调节剂,作为介质通过神经元-胶质细胞相互作用,调节突触传递和疼痛信号[22]。本研究中ELISA结果示CAP大鼠受辣椒素刺激后,脊髓及血清中促炎因子IL-1β、TNF-α和IL-6释放增加,可能参与调节突触传递,促进大鼠内脏疼痛神经信号传导,导致肛门直肠疼痛持续。
目前国际公认最佳的治疗是生物反馈[23-24],采用温水或中药坐浴[25]、中药热奄包[26]、电刺激、针灸、SNS[27]、A型肉毒素注射[28]等有一定疗效。针灸作为“简、便、廉、效”的中医特色疗法,近年来在功能疾病治疗方面受到关注。目前发现针刺可通过影响疼痛信号的外周传入、脊髓内传导途径及信号中枢的整合,调节体内致痛与镇痛物质的分泌等达到镇痛的效果[29]。电针可抑制大鼠胶质细胞活化及中枢敏化,阻断疼痛的信号传导,减轻大鼠疼痛[30-31],临床研究已证实了电针八髎穴能有效治疗CAP[7]。
中医学上CAP可归为大肠疼痛、谷道痛、魄门痛等范畴,该病初起多因气血亏虚,脏腑经络失于濡养,不荣则痛;或久病虚实夹杂,气血亏虚则推动无力,气血瘀滞,不通则痛[32],故治疗当以通络止痛、补益气血为主。临床上可采用益气补血方[33](黄芪、熟地黄、酒炒当归、炒白芍、川芎、党参、麸炒白术、茯苓、陈皮、槲寄生、蒸黄精、木香、生山楂、鸡血藤、姜黄等)或益气养血汤[34](炙黄芪、熟地黄、炒白术、白芍、升麻、柴胡、川芎、青皮、陈皮、当归、地龙、巴戟天、炙甘草等)治疗。其中多以黄芪、熟地补血养血;配以血中之气药川芎及活血之当归、白芍;加之行气健脾药如陈皮、青皮、白术、党参等,总体以补益气血、行气活血通络之效为主。根据中医“腧穴所在,主治所在”理论,八髎穴位于腰骶部,正对骶后孔,包括上、次、中、下髎穴,针刺有调节经络气血,协调脏腑阴阳之效。解剖学上八髎穴位于髂后上棘与后正中线之间,正对S1-4骶后孔,深部为S1-4骶神经,而支配肛门直肠的神经主要源于骶神经,故相比其他穴位,本实验选取八髎穴,能有效治疗肛门直肠痛。本研究结果显示CAP大鼠在电针治疗后内脏疼痛行为减少,机械痛阈降低,ELISA试验结果示CAP模型大鼠在电针治疗后脊髓和血清中IL-1β、TNF-α和IL-6含量降低,表明电针可通过抑制其脊髓胶质细胞的免疫因子激活,抑制痛觉敏化,从而达到缓解疼痛的效果。
本实验结果表明,模型组大鼠出现明显内脏疼痛行为,机械痛阈升高,脊髓中小胶质细胞标志物OX42和星形胶质细胞标志物GFAP的阳性表达显著增加,脊髓及血清IL-1β、TNF-α和IL-6水平上升;而在电针治疗后,CAP模型大鼠的内脏疼痛次数减少,大鼠机械痛阈值降低,脊髓中OX42和GFAP的阳性表达降低,脊髓及血清IL-1β、TNF-α、IL-6、GAFP水平下降。综上所述,大鼠脊髓胶质细胞活化及促炎因子IL-1β、TNF-α和IL-6释放与CAP发病相关,电针可通过抑制CAP模型大鼠脊髓胶质细胞活化及其免疫激活达到缓解CAP疼痛的效果。本研究结果部分阐释了CAP的发病机制,为临床针刺八髎穴治疗CAP提供了理论依据。

