慢性牙周炎龈下菌群与龈沟液炎症因子及种植修复后种植体周围骨吸收的关系
谢宝强,孙田力
(蚌埠市第三人民医院口腔科,安徽 蚌埠 233000)
口腔种植技术是当代牙科医学的重要成就,为牙列缺损患者提供了更优质、稳定的修复方案,但其伴随的并发症如种植体周围炎、种植体黏膜炎等种植体周围病已成为影响种植体存活率和稳定性的主要因素[1]。种植体周围病的病理过程与牙周病类似,都与口腔内微生物菌群失衡有关,龈下菌斑中一些主要的致病菌如牙龈卟啉单胞菌(Porphyromonas gingivalis,P.g)、中间普氏菌(Prevotella intermedia,P.i)、具核梭杆菌(Fusobacterium nucleatum,F.n)、粘性放线菌(Aggregatibacter actinomycetemcomitans,A.v)、变形链球菌(Streptococcus mutans,S.m)等起关键作用,可引发口腔内炎症反应,刺激龈沟液中炎症因子的释放,进而导致破坏牙周组织和种植体周围骨的吸收[2]。近年来,临床已明确了牙周病与种植体周围病的关联,但对于龈下菌群数量与种植体周围骨吸收量之间关系的深入探讨尚不足[3]。此外,龈下菌群的数量与种植体周围病的严重程度有关,然而在慢性牙周炎(chronic periodontitis,CP)患者种植修复后的龈下菌群变化的报道尚少[4]。基于此,本研究拟探讨CP患者种植修复前后龈下菌群数量的变化,以及龈下菌群数量与龈沟液炎症因子水平与种植术后种植体周围骨吸收的相关性。
1 资料与方法
1.1 一般资料
选取2020年1月至2023年1月蚌埠市第三人民医院收治行种植修复的108例CP牙列缺损患者纳入CP组,另选取同时期牙周健康的50例牙列缺损患者作为对照组。纳入标准:(1)年龄>18岁;(2)牙列缺损时间≥90 d,剩余骨量充足,在蚌埠市第三人民医院进行种植修复;(3)CP组符合CP诊断标准[5];(4)对照组牙周健康,无牙周疾病史。排除标准:(1)孕期或哺乳期女性;(2)患糖尿病等系统性疾病者;(3)有其他口腔疾病;(4)近期接受过其他口腔手术;(5)有严重牙周疾病且未经有效治疗者;(6)长期使用口腔冲洗液、抗生素、糖皮质激素、免疫抑制药物者;(7)有骨质疏松症或长期使用影响骨代谢的药物者。CP组中,男性56例,女性52例;年龄25~65岁;缺牙数目1~5颗,平均3.25颗。对照组中,男性27例,女性23例;年龄19~64岁;缺牙数目1~4颗,平均3.12颗。两组患者性别、年龄、缺牙数目比较,差异均无统计学意义(P>0.05)。本研究已获医院伦理委员会审批通过,并由患者签署知情同意书。
1.2 治疗方法
(1)CP组:术前进行牙周基础治疗,利用超声波洁牙器和手工刮治器具,除去牙菌斑和牙结石,包括龈下和深达牙根表面的部分;初期治疗后6~8周,重新测量牙周袋深度,以确定是否需要进行进一步的治疗,必要时可能会再次进行根面刮治;局部麻醉后,通过切开牙龈形成翻瓣,暴露牙齿的根面和牙槽骨,清洁、平滑牙根表面;择期行种植手术,麻醉后,在牙槽骨上钻出一个合适大小的孔,将种植体螺入孔中,将种植体表面覆盖,进入恢复期等待骨愈合,在种植体与骨愈合稳定后进行修复,包括安装基台、印模和试戴,然后固定最终修复体,如冠、桥或义齿。
(2)对照组:术前由专业的口腔卫生医师进行口腔卫生指导,包括正确的刷牙方式,如修饰性刷牙法和巴塞尔刷牙法,以及正确使用牙线和口腔冲洗器,种植手术及修复步骤同CP组。
1.3 龈下菌群检测方法
分别于治疗前后采用无菌刮治器从龈下腔深度≤4 mm的牙周袋取样,取样前采用生理盐水冲洗口腔,采用吸盘吸去多余唾液,采集的样品置入无菌试管,用含有保护剂的生理盐水溶液稀释,菌液分别接种于P.g、P.i、F.n、A.v、S.m培养基中,厌氧菌培养5 d,需氧菌培养2 d,采用美国APU 20-A鉴定系统对菌落进行计数。
1.4 龈沟液炎症因子检测方法
分别于治疗前后,采用滤纸条采集龈沟液样本,采集过程中尽量避免接触到口腔其他部位,避免唾液污染,采集到的样本置于EP管中,-80 °C冻存待检。样本解冻离心,取上清液,采用酶联免疫吸附法测定上清液白细胞介素6(interleukin-6,IL-6)、白细胞介素1β(IL-1β)、基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)水平。
1.5 骨吸收检测
种植修复后3个月,采用锥形束CT检查种植体周围骨吸收量,也即是种植体-基台结合部至牙槽嵴顶冠方距离差异,分别测量种植体周围近中、远中边缘部位的骨吸收量,接受多颗种植体植入的患者,计算种植体平均吸收量纳入分析。
1.6 观察指标
比较两组患者种植修复前后龈下菌群分布情况、龈沟液炎症因子水平及修复后3个月种植体周围骨吸收情况,分析CP患者术前龈下菌群数量与龈沟液炎症因子及修复后3个月种植体周围骨吸收量的相关性。
1.7 统计学分析
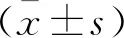
2 结果
2.1 两组修复前后龈下菌群数量比较
种植修复后3个月,两组患者龈下菌斑中P.g、P.i、F.n、A.v、S.m数量均下降(P<0.05),且CP组修复前后各菌群数量均大于对照组(P<0.05)。见表1。

表1 两组修复前后龈下菌群数量比较
2.2 两组修复前后龈沟液炎症因子水平比较
修复后3个月,两组龈沟液IL-6、IL-1β、MMP-9水平均下降(P<0.05),且CP组修复前后各指标水平均大于对照组(P<0.05)。见表2。

表2 两组修复前后龈沟液炎症因子水平比较
2.3 两组种植修复后种植体周围骨吸收比较
修复后3个月,CP组患者种植体周围近中、远中边缘骨吸收量均大于对照组(P<0.05)。见表3。
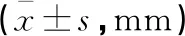
表3 两组种植修复后种植体周围骨吸收比较
2.4 术前龈下菌群数量与龈沟液炎症因子水平相关性分析
CP组龈下P.g、P.i、F.n、A.v、S.m菌群数量与龈沟液IL-6、IL-1β、MMP-9水平均呈正相关关系(P<0.05)。见表4。

表4 术前龈下菌群数量与龈沟液炎症因子水平相关性分析
2.5 术前龈下菌群数量与种植体周围骨吸收的相关性分析
CP组龈下P.g、P.i、F.n、A.v、S.m菌群数量与种植修复后3个月近中、远中边缘骨吸收量均呈正相关关系(P<0.05)。见表5。

表5 术前龈下菌群数量与种植体周围骨吸收的相关性分析
3 讨论
CP是一种由口腔内特定病原菌引起的,以牙周袋形成、牙槽骨吸收为主要特征的疾病。近年来,随着口腔种植学的发展,种植修复在压裂缺损患者中得到了广泛的应用[6]。然而,CP患者口腔环境复杂,种植修复的成功率受到牙周病原菌的影响,病原菌刺激宿主产生炎症反应,导致种植体周围的骨组织破坏,从而影响种植体的稳定性和成功率[7]。
本研究选取了CP患者进行种植修复前后以及牙周健康的牙列缺损患者进行种植修复前后的口腔样本,对比分析了修复前后龈下菌群数量的变化,发现无论是种植修复前还是种植修复后,CP组患者的龈下菌群数量P.g、P.i、F.n、A.v、S.m均高于对照组,提示在CP患者中,口腔内微生物环境的失衡情况严重,病原菌数量显著增多。P.g、P.i、F.n、A.v、S.m等病原菌可通过破坏宿主口腔菌群平衡,触发和加剧炎症反应,可改变口腔内活动,刺激宿主产生炎症反应,进一步诱导免疫细胞产生并释放炎症因子,进而促进骨溶解,导致骨组织破坏[8]。P.g不仅可刺激宿主炎症反应,还可影响其他口腔菌群的活动,比如通过产生酶和毒素,破坏宿主的口腔黏膜,为P.i、F.n等其他病原菌提供更有利的生存环境,进一步加剧口腔菌群的失衡,加重口腔炎症[9]。A.v、S.m是口腔内的共生菌,但在特定环境下,如口腔卫生条件差或宿主免疫力下降时,也可转变为病原体,进一步加重口腔炎症[10]。此外,本研究发现虽然种植修复后CP组患者的龈下病原菌数量有所下降,但仍然高于对照组,这可能是由于CP患者的口腔卫生管理不佳,无法有效抑制病原菌的生长。种植修复后,适应和恢复期较长,患者的身体条件、口腔卫生状况以及个体生理差异等诸多因素均会影响到口腔内的微生物平衡状态,若术后未能进行有效的口腔卫生管理,病原菌易过度繁殖[11]。
本研究发现,种植修复后两组龈沟液IL-6、IL-1β、MMP-9水平均有所下降,提示患者口腔内炎症反应得到缓解,然而CP组修复前后龈沟液炎症因子水平均高于对照组,可能是由于CP患者口腔微生物环境失衡,导致病原菌持续刺激宿主的免疫反应。IL-6、IL-1β、MMP-9是重要的炎症反应标志物,均在牙周病和种植体周围病中都发挥着关键作用,其中IL-6和IL-1β可刺激免疫反应,调节骨重塑,影响种植体的骨结合和骨吸收;MMP-9是一种能够降解骨基质的酶,过量的MMP-9可能导致种植体周围骨的破坏[12]。因此,虽然种植修复后,IL-6、IL-1β、MMP-9表达下调,但基于CP组患者口腔中病原菌数量较多,该类因子的水平仍高于健康者,极可能会对种植体的稳定性产生影响。本研究显示,CP组种植体周围近中和远中边缘骨吸收量均高于对照组,这可能是由于CP组患者龈下病原菌数量较多,导致持续性炎症反应。本研究表明,CP患者龈下P.g、P.i、F.n、A.v、S.m菌群数量与龈沟液中IL-6、IL-1β、MMP-9水平呈正相关,免疫系统产生的炎症反应越剧烈,龈沟液炎症因子水平越高。此外,本研究还显示CP组患者的龈下病原菌数量与种植修复后3个月的近中和远中边缘骨吸收量存在正相关关系,进一步证实病原菌可通过刺激宿主产生的炎症反应,导致骨组织的破坏和吸收,且这种破坏不仅限于口腔局部,还可能影响到整个种植体的稳定性和成功率。
综上,在种植修复过程中控制口腔内病原菌数量尤为重要,龈下菌群P.g、P.i、F.n、A.v、S.m数量与龈沟液炎症因子IL-6、IL-1β、MMP-9表达呈正相关关系,密切影响种植修复后骨吸收。

